miR-122-5p靶向PPP2R2A在婴儿胆道闭锁中的作用机制研究①
赵成基 李斌德 李 刚 王文赟 马仲福 曾永娟 胡继科
(兰州大学第二医院小儿外科,兰州 730000)
胆道闭锁(biliary atresia,BA)是一种仅见于婴儿的胆管闭塞性疾病,其特征是胆道进行性梗阻、肝纤维化和炎症,若BA患儿前期接受积极治疗则可以存活至成年[1]。统计显示,BA的发病有明显的地区与种族差异,相较于北美和西欧,其在亚洲的发病率明显较高[2,3]。在临床上,肝移植仍然是提高BA患儿存活率的主要治疗手段,但至今为止BA的发病机制尚不明确,增加了其治疗的难度[4]。MicroRNA是内源性的小分子非编码RNA,可以通过与靶基因的3′非翻译区(3′-UTR)结合调节靶基因的翻译和表达,从而参与多种生物学过程[5-7]。Peng等[8]在2016年的报道中表明,miR-122-5p在BA患儿血清中的表达显著上调,且Gao等[9]的研究显示miR-122-5p参与了肝癌细胞的增殖、迁移和侵袭。因此,本研究通过构建细胞模型,在体外探究miR-122-5p在BA中的作用机制,为后续的体内实验及临床治疗提供理论基础。
1 资料与方法
1.1资料
1.1.1临床资料 收集2018年1月至2018年12月间到本院就诊并诊断为的BA的10例患儿血清,选取同期在本院诊断为非BA的9例患儿血清,基本信息见表1。所有参与本研究的患儿均征得监护人同意且通过我院伦理委员会的批准。

表1 BA及CC患儿临床信息Tab.1 Clinical information in infants with BA and CC
1.1.2细胞与试剂 人源肝星形细胞LX-2购自武汉益普生物科技有限公司,货号YCL-0560。胎牛血清和LipofectamineTM2000 Reagent购自Invitrogen公司;TRIzol和RNA提取试剂盒购自北京天健生物技术有限公司;SYBR Premix Ex TaqTMⅡ试剂盒、PrimescripTMRT reagent Kit、miRNA PrimescripTMRT reagent Kit购自TaKaRa公司;引物委托Sangon Biotech设计并合成;青霉素和链霉素购自上海源叶生物科技有限公司;RPMI1640培养基、CCK-8和DMSO购自Sigma-Aldrich公司;蛋白提取试剂盒购自南京凯基生物公司;Annexin V-PE/7-AAD Apoptosis Kit购自上海钰博生物科技有限公司。
1.2方法
1.2.1细胞培养与转染 将LX-2细胞培养于含10%胎牛血清、100 U/L青霉素及100 mg/L链霉素的DMEM培养基中,培养箱培养条件为37℃、5% CO2。待细胞长势稳定后将miR-122-5p mimics、Anti-miR-122-5p及pc-PPP2R2A按实验分组转染入细胞中。用LipofectamineTM2000试剂盒按操作指导完成转染。48 h后收集转染细胞进行后续实验。
1.2.2RT-qPCR 使用TRIzol和RNA提取试剂盒提取总RNA。NanoDrop检测RNA质量和浓度,统一稀释为500 ng/μl。使用PrimescripTMRT试剂盒和miRNA PrimescripTMRT试剂盒将PPP2R2A mRNA及miR-122-5p的RNA反转录为cDNA,然后使用SYBR Premix Ex TaqTMⅡ试剂盒作为qPCR扩增的模板。在LightCycle 96荧光定量PCR仪上进行RT-qPCR:95℃预变性30 s,95℃变性5 s,共40个循环,退火,60℃延伸30 s。GAPDH用作mRNA内参,U6用作miRNAs内参,并使用2-ΔΔCt法计算相对表达量,重复3次。引物序列见表2。

表2 引物序列Tab.2 Primer sequences
1.2.3Western blot 使用RIPA裂解液分离细胞中的蛋白质。将相同浓度的蛋白质混合物在95℃下煮沸10 min。然后将20 μl的混合物(包含30~50 μg样品)加入到含有10%聚丙烯酰胺凝胶的平板中,电泳分离蛋白质。将蛋白质从凝胶转移到PVDF膜上,封闭,然后在4℃与一抗(1∶1 000)孵育过夜。样品用TBST洗涤,然后与二抗(1∶2 000)在室温下孵育1 h。β-actin或GAPDH用作内参,用Image J测定条带灰度,重复3次。
1.2.4细胞凋亡检测 先在不同分组下处理48 h,600 g离心5 min,弃上清并用PBS洗涤细胞1次,各组细胞以1×105个/孔的密度接种到6孔板中培养12 h,然后根据试剂盒的操作流程,使用Annexin V-PE/7-AAD Apoptosis Kit和流式细胞仪检测不同处理下细胞凋亡情况,重复3次。
1.2.5CCK-8 将细胞以5×103个/孔的密度接种于96孔板,孵育过夜。在经过不同组处理后继续培养72 h,向各孔中加入CCK-8试剂10 μl,继续在37℃、5%CO2条件下孵育30 min,使用酶标仪测量各孔在450 nm处的吸光度(OD450),使用CV=(试验OD450/对照OD450)×100% 计算细胞增殖活性。
1.3统计学处理 采用GraphPad Prism8软件绘制相关统计图和进行统计分析。组间数据差异采用t检验和单因素方差分析(one-way ANOVA)进行统计分析,P<0.05表示差异具有统计学意义。
2 结果
2.1miR-122-5p在BA患者及CC患者血清中的表达 miR-122-5p在BA患儿血清中的表达量显著高于CC患儿血清中的表达量(P<0.000 1),提示miR-122-5p可能是婴儿BA潜在治疗靶点。见图1。

图1 miR-122-5p在CC及BA患儿血清中的表达量Fig.1 Expressions of miR-122-5p in serum of children with CC and BA
2.2miR-122-5p对LX-2细胞的影响 转染Anti-miR-122-5p或miR-122-5p mimics入LX-2细胞内miR-122-5p的表达量均有显著变化(P<0.05)。相较于对照组LX-2细胞,转染Anti-miR-122-5p显著抑制LX-2细胞的增殖活性(P<0.000 1),并促进LX-2细胞的凋亡(P<0.000 1),转染miR-122-5p mimics显著促进LX-2细胞的增殖活性并抑制LX-2细胞的凋亡(P<0.000 1)。Western blot实验结果显示,转染Anti-miR-122-5p会显著抑制p-AKT蛋白和Ki67蛋白的表达(P<0.001);转染miR-122-5p mimics则得到相反的结果。见图2。

图2 miR-122-5p对LX-2细胞的影响Fig.2 Effect of miR-122-5p on LX-2 cells
2.3miR-122-5p通过3′-UTR直接靶向PPP2R2A 如图3A所示,PPP2R2A在其3′-UTR端与miR-122-5p有部分靶向结合位点。双荧光素酶报告基因实验结果显示,过表达miR-122-5P降低了野生型PPP2R2A的荧光素酶活性(P<0.01,图3B),但对突变型PPP2R2A的荧光素酶活性影响无统计学意义。Western blot实验结果显示,过表达miR-122-5p显著下调LX-2细胞中PPP2R2A蛋白的表达(P<0.01,见图3C、D)。

图3 PPP2R2A是miR-122-5p的靶基因Fig.3 PPP2R2A is target gene of miR-122-5p
2.4miR-122-5p靶向PPP2R2A影响LX-2细胞生物学行为 如图4所示,通过RT-qPCR实验检测miR-122-5p与PPP2R2A mRNA的转染效率。转染Anti-miR-122-5p或pc-PPP2R2A均显著上调PPP2R2A蛋白在LX-2细胞中的表达量(P<0.01),同时抑制LX-2细胞的增殖(P<0.001)并促进LX-2细胞的凋亡(P<0.000 1)。共转染miR-122-5p mimics和pc-PPP2R2A对PPP2R2A蛋白的表达量、LX-2细胞的增殖和凋亡无显著影响。Western blot实验结果显示,转染Anti-miR-122-5p或pc-PPP2R2A均会显著抑制p-AKT和Ki67蛋白在LX-2细胞内的表达(P<0.01),并上调AKT蛋白在LX-2细胞内的表达(P<0.01),同时过表达miR-122-5p和PPP2R2A对上述蛋白的表达影响差异无统计学意义。
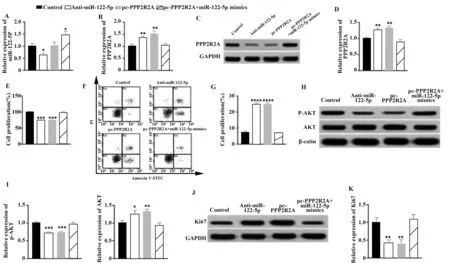
图4 miR-122-5p/PPP2R2A对LX-2细胞的影响Fig.4 Effect of miR-122-5p/PPP2R2A on LX-2 cells
3 讨论
众所周知,肝纤维化是BA的显著特征,然而肝纤维化的形成机制仍然是未知的[10]。研究显示,LX-2细胞不仅保留了细胞因子的表达且还具有有效转染等能力,因此非常适用于人类肝纤维化的体外研究[11]。本研究采用LX-2细胞作为体外研究模型,探究miR-122-5p在BA中的作用机制。
研究显示,miRNA有助于BA的诊断[12,13]。在本研究中通过对在我院就诊的BA及CC患儿血清miR-122-5p的表达进行检测发现,miR-122-5p在BA患儿血清中的表达显著上调,且抑制miR-122-5p在LX-2细胞中的表达,从而显著降低LX-2细胞的增殖活性并抑制Ki67蛋白的表达,这说明miR-122-5p在LX-2细胞的增殖中发挥重要作用。PI3-K/AKT信号通路是参与细胞功能的重要途径之一,如细胞增殖、分化、迁移和细胞内转运等,且在肝纤维化的过程中也常被激活[14-19]。本研究发现,抑制miR-122-5p在LX-2细胞中的表达可显著降低AKT蛋白的磷酸化水平,表明miR-122-5p可能参与了AKT蛋白的活化,影响肝纤维化的进程。生物信息学网站预测结果显示,PPP2R2A是miR-122-5p的下游作用靶点,且双荧光素酶报告基因实验证实了这一预测。
PPP2R2A是PPP2A磷酸酶的调控亚基之一,参与了多种细胞功能,其中就包括细胞增殖[20-22]。PPP2A是公认的AKT活性调控因子[23]。有研究报道称PPP2R2A的异位表达能有效削弱AKT的Ser-473和Thr-308残基的磷酸化[24]。本研究发现,miR-122-5p靶向并抑制了PPP2R2A蛋白的翻译,且过表达PPP2R2A在LX-2细胞中能有效抑制AKT蛋白的磷酸化,这表明PPP2R2A可能是miR-122-5p与AKT产生作用的中间信号蛋白。
总之,本研究结果显示miR-122-5p在BA患儿血清中的表达显著增加,下调miR-122-5p的表达对LX-2细胞的增殖产生抑制作用并促进LX-2细胞的凋亡,下调miR-122-5p对AKT蛋白的活性也有显著的抑制作用。综上,本研究证明miR-122-5p在LX-2细胞内通过调控PPP2R2A的表达影响LX-2细胞的生物学行为,可能成为BA肝纤维化治疗的一种新策略。

