蛋氨酸脑啡肽联合紫杉醇对肺癌细胞A549增殖和凋亡的影响
陈 灏 呼芳竹 邓煜瑶 王晓楠 单风平
(中国医科大学基础医学院,沈阳 110122)
全球癌症的发病率和死亡率迅速上升,使癌症成为大多数地区的主要死因。而其中,肺癌是最常诊断的癌症,也是全球癌症死亡的主要原因。根据最新统计,肺癌占新发癌症总数的11.6%,占癌症总死亡人数的18.4%,发病率和死亡率均排名第一[1,2]。约85%的肺癌患者是非小细胞型肺癌(non-small cell lung cancer,NSCLC),腺癌和鳞状细胞癌是其最常见的亚型。临床上,超过60%的肺癌患者在诊断时出现局部晚期或转移性疾病,手术切除不再是最佳选择,此时肺癌患者的主要治疗方法是常规化学疗法和放射疗法[3]。紫杉醇(paclitaxel,PTX)是一种用于治疗癌症的有效药物,广泛应用于NSCLC的临床治疗。但是,PTX也具有严重的副作用,包括呕吐、腹泻和骨髓抑制[4]。近年来,药物联合用是降低细胞毒性并且提高疗效的有效方法。因此,研究新型抗肿瘤药物与传统化疗药物的联合应用方案,对于肺癌治疗具有十分重要的意义。
蛋氨酸脑啡肽(methionine enkephalin,MENK)是衍生自肾上腺素原激素脑啡肽的内源性阿片样五肽,具有Try-Gly-Gly-Phe-Met氨基酸序列,也称为阿片生长因子。MENK不仅具有神经内分泌和免疫调节活性,而且在与阿片受体结合后也具有直接的抗肿瘤活性[5]。根据既往研究报道,MENK可抑制胃癌、胰腺癌、卵巢癌、黑色素瘤、肝细胞癌和三阴性乳腺癌细胞生长[6]。前期实验结果显示,MENK对肺癌A549细胞的增殖具有抑制作用。因此,本文以肺癌A549细胞为研究对象,旨在探讨MENK联合PTX对肺癌A549细胞增殖和凋亡的影响。
1 材料与方法
1.1材料
1.1.1细胞 肺癌A549细胞由我院实验室传代保存,用含有10%胎牛血清和1%的青霉素、链霉素双抗的RPMI1640培养基,置于37℃、5%CO2孵箱中传代培养。
1.1.2药物与试剂 MENK购于美国Penta Biotech公司;PTX购于北京索莱宝科技有限公司;RPMI1640培养基购于美国HyClone公司;CCK-8试剂盒、青霉素链霉素双抗、0.25%胰酶均购于北京鼎国昌盛生物技术有限公司;标准胎牛血清购于天津市灏洋生物制品公司;Hoechst33258试剂盒购于上海碧云天生物技术有限公司;Annexin V-FITC凋亡检测试剂盒购于南京诺唯赞生物技术有限公司。
1.2方法
1.2.1CCK-8法检测细胞增殖 取处于对数生长期的细胞,轻轻吹打混匀制成单细胞悬液,计数后按照5×103个/孔接种于96孔板,每孔加入200 μl培养基。24 h后各组吸去培养基,分别加入相应的药物。单药组每孔加入200 μl MENK或200 μl PTX;联合用药组MENK和PTX药物浓度均浓缩1倍后,每孔分别加入100 μl药物,使得终浓度与单药组相同。具体分组为:MENK组(2 mg/ml、6 mg/ml、10 mg/ml),PTX组(2 ng/ml、6 ng/ml、10 ng/ml),MENK联合PTX组(2 mg/ml+2 ng/ml、6 mg/ml+6 ng/ml、10 mg/ml+10 ng/ml)。实验设置空白对照组,加入200 μl RPMI1640培养基,每个浓度设置3个复孔。培养24 h,48 h后,加入CCK-8试剂,按照10∶1加入CCK-8试剂,以换液的形式加入。放入孵箱继续培养2 h后,在酶标仪上用450 nm的波长测出各组OD值,实验重复3次。
1.2.2药物联合应用效应评价 每个实验组设置5个不同的浓度,分别为MENK组(2 mg/ml、4 mg/ml、6 mg/ml、8 mg/ml、10 mg/ml),PTX组(2 ng/ml、4 ng/ml、6 ng/ml、8 ng/ml、10 ng/ml),MENK联合PTX组(2 mg/ml+2 ng/ml、4 mg/ml+4 ng/ml、6 mg/ml+6 ng/ml、8 mg/ml+8 ng/ml、10 mg/ml+10 ng/ml),空白对照组加入RPMI1640培养基,细胞加入药物作用48 h后,通过CCK-8法检测各组抑制率,应用中效原理评价药物间的相互作用[7,8]。
计算公式:药物作用效应fa=1-实验组平均OD值/对照组平均OD值。先将中效方程fa/fu=(D/Dm)m(fa 为药物作用效应,即抑制率;fu=1-fa,D为药物浓度,Dm为中效浓度,m 为斜率)两边取对数,得到对数方程log(fa/fu)=mlogD-mlogDm。设a=-mlogDm,b=m,x=logD,y=logfa/fu,代入后得到线性方程式y=bx+a。根据实验所得fa和D值进行线性回归分析,计算出单用及两药联合应用时在各种效应所需药物的浓度D=Dm(fa/fu)1/m,最后计算两药联合应用在各种效应时的合用指数CI=D1/DX1+D2/DX2+α(D1D2)/(DX1DX2)。D1、D2是两药联合应用时产生X效应的两药各自所需浓度,DX1、DX2是两药单独使用时产生X效应的两药各自浓度。α=0为两种相互排斥性药物,α=1为两种相互非排斥性药物。由于MENK与PTX的作用机制不同,故本实验中α=0。CI<1表示两药合用为协同效应,CI=1表示两药合用为相加效应,CI>1表示两药合用为拮抗效应。
1.2.3Hoechst33258法观察细胞凋亡形态 取处于对数生长期的细胞,按照2×104个/孔接种于24孔板中,放入孵箱培养。24 h后吸去培养基,加入相应的药物,各组浓度分别为MENK组(6 mg/ml),PTX组(6 ng/ml),MENK联合PTX组(6 mg/ml+6 ng/ml),空白对照组加入RPMI1640培养基,继续放入孵箱培养。48 h后吸去培养基,加入0.5 ml固定液,在4℃条件下固定15 min。然后吸去固定液,用PBS洗涤2遍,每次3 min,再加入0.5 ml Hoechst33258染色液,室温条件下避光染色10 min。最后用PBS洗涤2遍后避光风干,加入抗荧光淬灭封片剂封片,于倒置荧光显微镜下观察细胞核形态并拍照。每组选取3个显微镜视野计算细胞凋亡个数,并计算细胞凋亡率。
1.2.4流式细胞术Annexin V/PI双染色法检测细胞凋亡 取处于对数生长期的细胞,接种于6孔板中,2×105个/孔。培养24 h后吸去培养基,加入相应的药物,分别为MENK组(6 mg/ml),PTX组(6 ng/ml),MENK联合PTX组(6 mg/ml+6 ng/ml),空白对照组加入RPMI1640培养基,继续放入孵箱培养。48 h后吸去培养基,用不含EDTA的胰酶消化并收集细胞。之后用预冷的PBS清洗离心2次,每组用100 μl的Binding Buffer重悬。分别加入5 μl的Annexin V-FITC和5 μl PI试剂,轻轻混匀后,室温避光孵育15 min。最后加入400 μl Binding Buffer至每管,细胞经300目尼龙网过滤后,在流式细胞仪上进行检测。

2 结果
2.1药物单用及两药联合应用对A549细胞增殖的抑制作用 CCK-8实验结果显示,作用24 h时,与对照组相比,MENK组(6 mg/ml、10 mg/ml)、PTX组(6 ng/ml、10 ng/ml)、MENK联合PTX组(6 mg/ml+6 ng/ml、10 mg/ml+10 ng/ml)对细胞增殖的抑制效果更为明显,差异具有统计学意义;与单药组相比,MENK联合PTX组抑制细胞增殖的效果略强,但是没有统计学意义。作用48 h时,与对照组相比,除2 ng/ml PTX组外,其余各实验组对细胞增殖的抑制效果都比较明显,差异具有统计学意义;与单药组相比,MENK联合PTX组(6 mg/ml+6 ng/ml、10 mg/ml+10 ng/ml)抑制细胞增殖的效果更明显,且差异具有统计学意义。在加入相应的药物后,各实验组对细胞增殖均表现出不同程度的抑制作用,并且随着药物作用时间的延长和药物作用浓度的增加,其抑制效果也越来越明显。见图1。

图1 单药组及联合用药组对A549细胞增殖的抑制作用Fig.1 Inhibition of proliferation of A549 cells by single drug group and combination drug group
2.2MENK联合PTX应用效应的评价 通过CCK-8实验测出各个实验组加入药物作用48 h后的抑制率,绘制剂量-效应曲线。按照中效方程,计算不同fa下的CI,并绘制fa-CI曲线(图2)。MENK与PTX联合使用对于A549细胞增殖的抑制作用,在整个效应范围中CI<1,说明两药联合应用在整个浓度区间均产生协同效应。
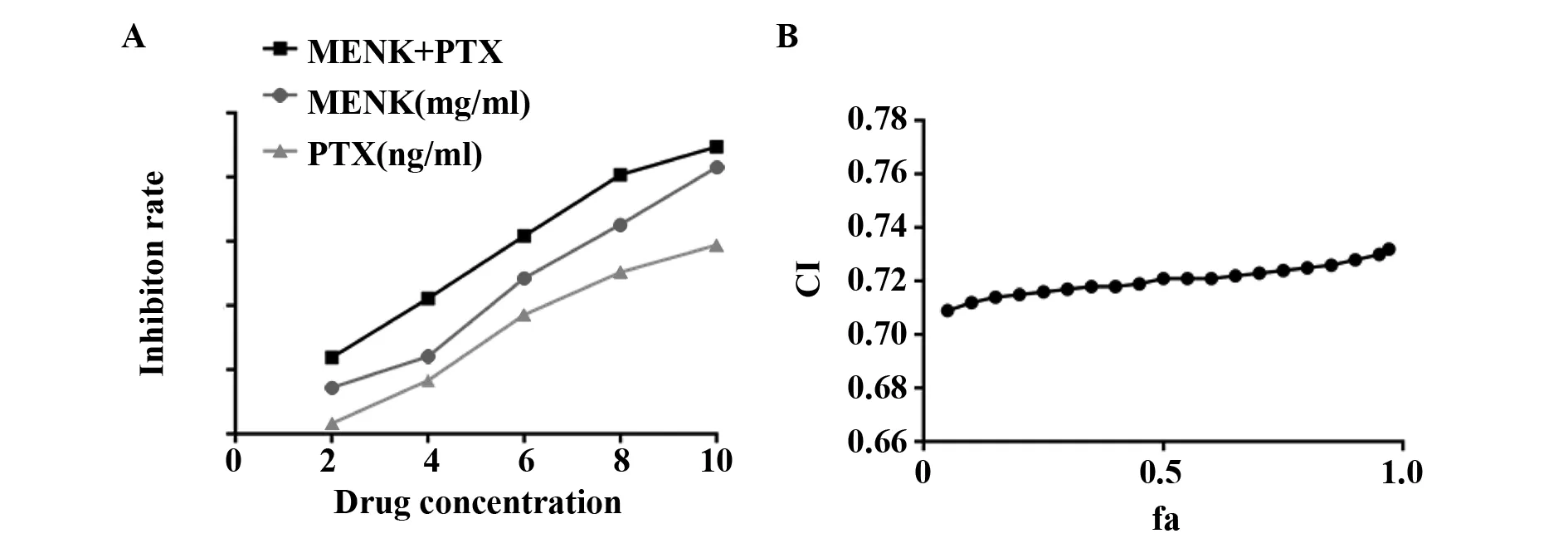
图2 MENK与PTX联合应用48 h的剂量-效应曲线、fa-CI曲线Fig.2 Combination of MENK and PTX for 48 h dose-effect curve,fa-CI curve
2.3Hoechst33258染色法观察各组细胞凋亡形态及凋亡率 Hoechst33258是一种可以透过细胞膜的蓝色荧光染料,染色后,空白对照组的细胞呈均匀的淡蓝色,形状为圆形或椭圆形,比较规则。而MENK组,PTX组,MENK联合PTX组的细胞呈现亮蓝色,细胞核固缩、浓染、形状不规则。根据荧光显微镜下计数,空白对照组的凋亡率为0.8%,而MENK组、PTX组、MENK 联合PTX组的凋亡率分别为14%、21%、34%,各给药组的细胞凋亡率均显著升高。与单药组相比,MENK联合PTX组的细胞凋亡数量最多,差异具有统计学意义。见图3。

图3 荧光显微镜观察各组细胞凋亡形态及凋亡率Fig.3 Fluorescence microscopy observation of apoptosis morphology and apoptosis rate of each group
2.4流式细胞术Annexin V/PI双染色法检测细胞凋亡 细胞加入相应的药物作用48 h后,经流式细胞仪检测,空白对照组的细胞凋亡率为1.53%,而MENK 组、PTX组、MENK联合PTX组的细胞凋亡率分别为6.23%、6.04%、13.22%。与空白对照组相比,各加药组的细胞凋亡率均明显升高,并且MENK联合PTX组细胞凋亡率高于单独用药组。结果表明,MENK、PTX均能诱导细胞凋亡,而两者联合应用后诱导细胞凋亡的作用更强。见图4。
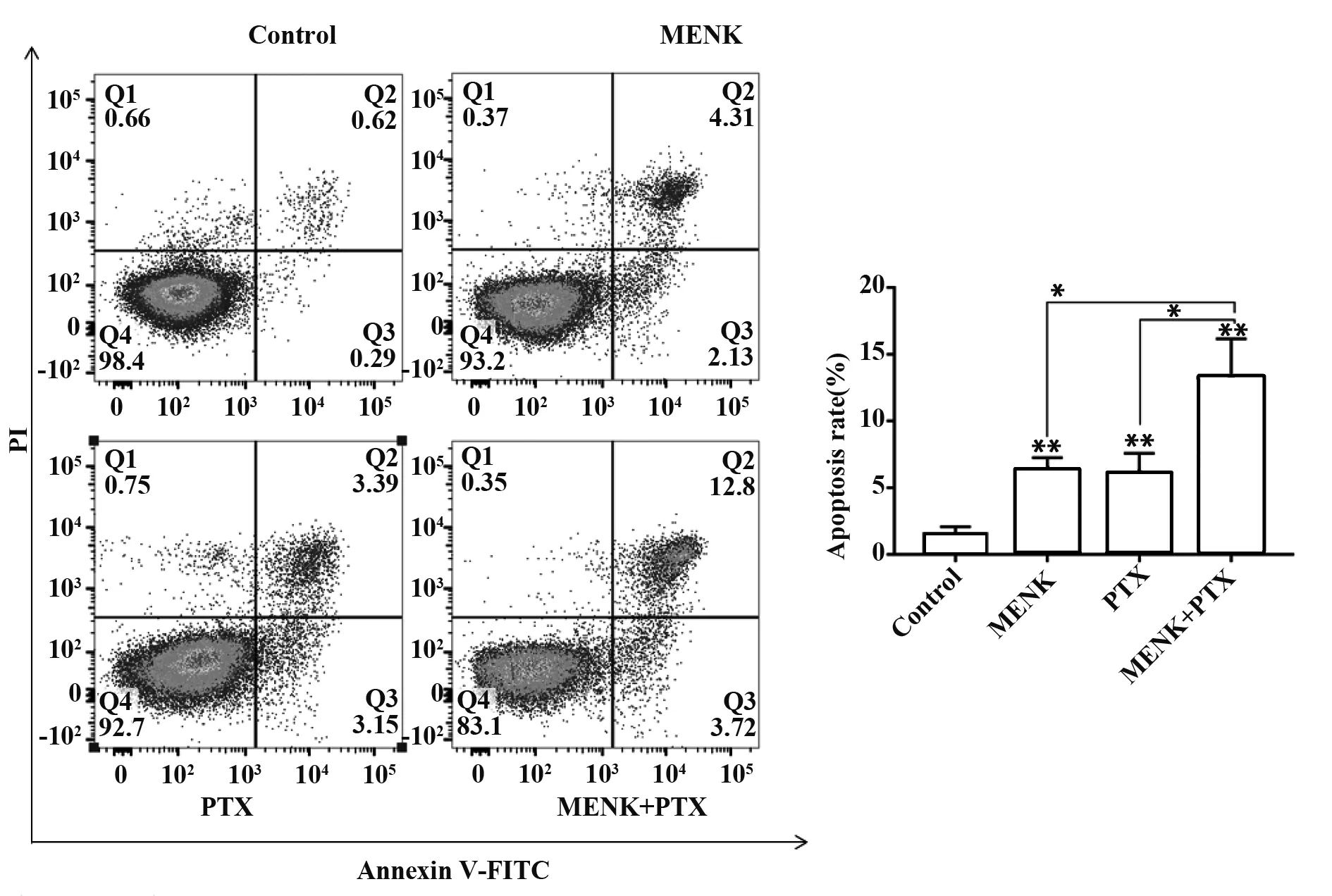
图4 流式细胞术检测各组细胞凋亡率Fig.4 Flow cytometry was used to detect apoptosis rate of each group
3 讨论
肺癌作为一种严重危害人类健康的恶性疾病,具有增殖周期短,转移活性强,死亡率高的特点。目前临床上针对肺癌的主要治疗手段是手术切除、化疗和放疗[9]。然而,手术切除仅适用于被诊断为早期肺癌并且癌细胞尚未转移到附近淋巴结外的患者,化疗在肺癌的综合治疗中仍然占据着十分重要的地位。PTX是肺癌化疗的首选药物,并广泛用于治疗多种癌症,如乳腺癌、卵巢癌、黑色素瘤[10]。它通过结合微管蛋白和稳定非功能性微管束来阻断正常的有丝分裂纺锤体发育和随后的细胞分裂,从而表现出抗肿瘤活性[11]。另一方面,PTX自身的缺点也限制了其应用。一个是水溶性差,传统上需要Cremophor EL或Polysorbate 80等载体进行静脉输送,而这些溶剂可能导致神经毒性和超敏反应;第二个缺点是紫杉醇具有多药耐药性,细胞抗性的发生限制了其功效和应用。多药耐药性是暴露于一种抗癌药物的癌细胞显示出对各种其他抗癌药物的抗性的机制。通过激活跨细胞蛋白从细胞中排出化学物质,激活解毒系统的酶或改变基因控制细胞凋亡来实现多药耐药性。
MENK最初由Hughes于1975年发现,是一种内源性阿片类药物,可调节先天性和适应性免疫系统,控制树突状细胞、巨噬细胞、CD4+T细胞、上皮细胞和间充质细胞的活化和调节功能[12]。不仅具有神经内分泌和免疫调节活性,而且在与阿片受体结合后也具有直接的抗肿瘤活性[5]。此外,MENK还在细胞发育、细胞更新、伤口愈合、血管生成、肿瘤发生和肿瘤进展中起作用。近年来的报道显示,MENK以剂量依赖性方式,可以调节癌症患者的免疫功能并通过结合阿片受体的方式来抑制肿瘤生长[13]。本研究团队之前发表的文章表明,MENK可以加强DC和CD4+T细胞之间的通路,通过激活CD8+T细胞,抑制调节性T细胞(Tregs),在肿瘤微环境中将M2型巨噬细胞转变为M1型并诱导DC成熟,从而增强特殊细胞毒性以杀死肿瘤细胞。此外,头颈部小细胞癌、胰腺腺瘤和结肠腺瘤的肿瘤移植研究也表明,当MENK与PTX、顺铂或吉西他滨联合使用时,给予MENK可通过抑制细胞增殖阻止肿瘤生长,并降低毒性[14]。表明MENK可以作为细胞增殖的调节剂,影响在致瘤状态中表达的免疫因子。
本研究结果显示,MENK与PTX单独使用以及联合应用24 h、48 h后对A549细胞的增殖有不同程度的抑制作用,并且联合用药组的抑制效果要强于单独用药组。从实验数据可以看出,无论是单独用药组,还是MENK联合PTX组,随着时间的延长和浓度的增加,其对细胞增殖的抑制率均有所增加,但是否具有时间依赖性和浓度依赖性还需要增加浓度梯度和时间点做进一步的研究。为明确两药之间是否具有协同作用,设置了5个不同的浓度梯度,并通过CCK-8法测出每个浓度所对应的药物效应。通过中效原理计算分析发现,两药联用指数(CI)在浓度范围内均<1,两药间作用为协同效应。荧光染色实验和流式细胞术结果表明,MENK和PTX均能诱导细胞凋亡,并且联合用药组的细胞凋亡率高于单独用药组。由此说明,MENK可以通过诱导细胞凋亡,从而抑制细胞增殖;与PTX合用后,能进一步加强对细胞的抑制作用,不过具体机制还有待研究。
综上所述,肺癌是癌症相关死亡的主要原因,化疗期间的耐药性是其治疗中的主要障碍[15]。另外,由化疗药物所带来的毒副作用也是临床治疗肺癌的不利因素。因此,探索药物联合应用方案,发挥药物之间的协同潜力,可以提高肺癌化疗的有效性,并且降低毒性。MENK作为一种潜在的新型抗肿瘤药物,与PTX联合应用,可以增强抗肿瘤活性,抑制肿瘤细胞的增殖,降低PTX的剂量,减轻它所带来的毒副作用,为临床化疗用药提供了一个新的思路。

