自噬在红景天甙诱导胃癌细胞凋亡中的作用及机制①
荣 黎 李 桓 欧阳净 王 丽 池祥波 陈耀凯
(重庆市公共卫生医疗救治中心,重庆 400036)
自噬作为Ⅱ型程序性细胞死亡,通过降解自噬成分清除蛋白质异常聚集和受损细胞器调控细胞稳态,与多种疾病发生密切相关[1-3]。在肿瘤发生发展中,细胞自噬呈“两面性”,在肿瘤药物治疗中发挥不同作用[4-9]。
mTOR(mammalian target of rapamycin)是哺乳动物雷帕霉素的靶点,在肿瘤细胞中表达上调从而抑制自噬,是调控细胞自噬的关键节点[10,11]。PI3K/AKT(磷脂酰肌醇3激酶/蛋白激酶B)作为肿瘤细胞中调控凋亡的经典信号通路,同时也是mTOR的上游靶点,对于后者的激活起重要调控作用[12,13]。
本课题组前期功能实验已发现红景天甙不仅能诱导胃癌细胞凋亡,且能诱导自噬[14]。LC3(light chain 3)是自噬发生发展过程中的重要标志性蛋白,其表达水平与自噬水平相对应[15]。本研究聚焦于自噬,探讨自噬在红景天甙促进胃癌细胞凋亡中的作用及机制,为进一步研究红景天甙在胃癌中的治疗作用提供参考。
1 材料与方法
1.1材料
1.1.1细胞株 人胃癌细胞株AGS由重庆医科大学基础医学院馈赠。
1.1.2试剂与仪器 红景天苷(南京格尔狄生物科技有限公司),1640培养基(美国Hyclone),胎牛血清(美国Gibco),IGF-1、氯喹(美国Sigma Aldrich),Hoechst33342、AV/PI细胞凋亡检测试剂盒(北京碧云天生物公司),Bcl-2、Bax、cleaved-Caspase3、cleaved-Caspase9、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR、LC3b及Beclin-1抗体(上海abways technology),腺病毒载体(上海Hansheng),流式细胞仪(BD,Intra),透射电镜(Philips TECNAI20),激光扫描共聚焦显微镜(Leica TCS-SP2)。
1.2方法
1.2.1细胞培养及分组 细胞培养于含10%胎牛血清的1640培养基,取对数生长期细胞用于实验。以不含红景天甙的1640培养基作为对照组,以40 μmol/L红景天甙处理的胃癌细胞为实验组;以10 μmol/L IGF-1和10 μmol/L氯喹(CQ)分别预处理胃癌细胞30 min作为干预组。
1.2.2Hoechst33342细胞核染色 细胞以1×105个/孔接种于含无菌玻片的24孔板,培养24 h,40 μmol/L 红景天甙(或先经10 μmol/L CQ预处理30 min)处理细胞48 h,PBS洗涤3次,500 μl 4%多聚甲醛室温固定10 min,PBS洗涤3次,以PBS稀释DAPI(1∶20),200 μl/孔稀释液常温染色10 min,PBS洗涤3次,封片,正置荧光显微镜观察。
1.2.3AV/PI流式细胞术 1×106个/孔AGS细胞接种至6孔板,培养24 h,加入40 μmol/L红景天甙(或先经10 μmol/L CQ预处理30 min)。48 h后收集细胞,800 r/min离心5 min,弃上清,PBS洗涤,悬浮于缓冲液中,Annexin V-FITC和PI室温暗处染色 15 min,流式细胞仪分析。
1.2.4Western blot 收集处理后的AGS细胞,预冷PBS洗涤1次。100 μl预冷Western细胞裂解液重悬细胞后冰浴裂解30 min,4℃、12 000 r/min离心10 min,收集上清。以牛血清白蛋白(BSA)作为标准品,Lowry法测定样品蛋白浓度以确定上样量。样品经SDS-PAGE电泳后,转膜、封闭,分别加入一抗和二抗,DAB显色。室温轻摇5 min后观察蛋白条带,待显色清晰,转入PBS中漂洗,ECL化学发光照相。
1.2.5透射电镜 收集处理后的细胞PBS冲洗2次,2.5%戊二醛室温固定90 min;1%四氧化锇固定30 min。梯度脱水后,细胞被包埋、切片,饱和乙酸铀酰和柠檬酸铅染色;透射电镜观察双膜自噬囊泡。
1.2.6mRFP-GFP-LC3转染 收集1×104个处理好的细胞,置于激光共聚焦显微镜专用的培养皿中。将10 μl 携带mRFP-GFP-LC3腺病毒载体与细胞共培养2 h,换液后继续培养24 h,利用激光扫描共聚焦显微镜拍照观察荧光自噬斑点的数量与强弱。

2 结果
2.1红景天甙诱导胃癌细胞自噬体形成 透射电镜观察结果表明,与对照组相比,红景天甙组出现明显的双膜自噬囊泡(图1),说明红景天甙成功诱导自噬体的形成。

图1 透射电镜观察红景天甙诱导胃癌细胞形成双膜自噬囊泡Fig.1 Formation of double membrane autophagy vesicles in AGS cells induced by salidroside was observed by transmission electron microscope
2.2红景天甙增加荧光自噬斑点数量和强度 与对照组相比,红景天甙组胃癌细胞胞浆内荧光自噬斑点数量与强度均明显上调(图2),证明红景天甙能诱导AGS细胞自噬。

图2 激光扫描共聚焦显微镜观察红景天甙对荧光自噬斑点的影响Fig.2 Effect of salidroside on number of fluorescence autophagic spots as determined by laser scanning confocal microscopy
2.3氯喹增加红景天甙诱导的细胞核固缩 Hoechst33342染色结果显示,红景天甙处理细胞后细胞核染色质固缩增加,自噬抑制剂氯喹预处理后,红景天甙诱导的核固缩显著增加,表明抑制自噬可促进红景天甙诱导的细胞凋亡(图3)。

图3 Hoechst33342染色观察AGS细胞凋亡形态学变化Fig.3 Morphological changes of AGS cell apoptosis were observed by Hoechst33342 staining
2.4氯喹促进红景天甙诱导的细胞凋亡 流式细胞分析结果表明,与对照组(4.5±0.7)%相比,红景天甙组细胞凋亡率(13.7±0.9)%明显提高,自噬抑制剂氯喹预处理后,红景天甙的促凋亡效应显著增强(图4),凋亡率由(13.7±0.9)%上升为(25.2±1.2)%。表明抑制自噬可增强红景天甙的促凋亡作用。

图4 流式细胞检测胃癌细胞凋亡数量Fig.4 Apoptosis number of gastric cancer cells was detected by flow cytometry
2.5氯喹红景天甙对凋亡相关蛋白的表达影响 与对照组相比,红景天甙下调抗凋亡蛋白Bcl-2表达,上调促凋亡蛋白Bax、cleaved-Caspase3、cleaved-Caspase9表达。自噬抑制剂氯喹预处理后,红景天甙诱导的促凋亡蛋白表达上调(图5)。
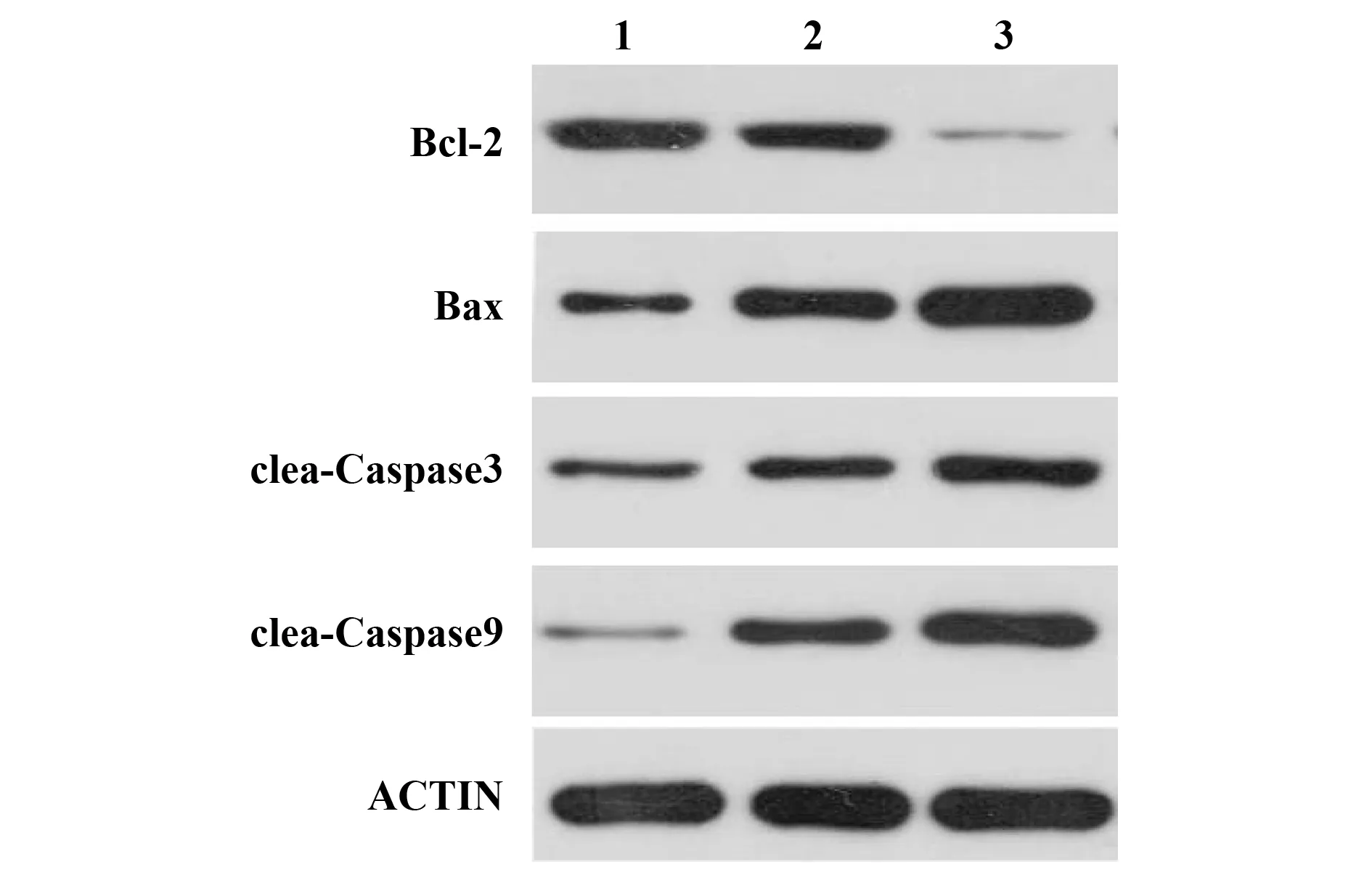
图5 Western blot检测氯喹预处理对凋亡相关蛋白表达的影响Fig.5 Effect of chloroquine on apoptosis-related protein expressions was detected by Western blot
2.6红景天甙通过抑制PI3K/AKT/mTOR通路诱导胃癌细胞自噬 红景天甙明显抑制PI3K、AKT和mTOR活化,磷酸化PI3K蛋白、磷酸化AKT蛋白和磷酸化mTOR蛋白表达下调(图6)。PI3K/AKT激动剂IGF-1干预处理后,自噬关键蛋白LC3Ⅱ和Beclin-1表达降低(图7),荧光自噬斑点的数量和强度明显减弱(图8)。表明激活mTOR上游调节通路PI3K/AKT可抑制自噬蛋白表达。

图6 Western blot检测红景天甙对PI3K/AKT/mTOR通路蛋白的影响Fig.6 Effect of salidroside on PI3K/AKT/mTOR pathway proteins was detected by Western blot

图7 Western blot检测IGF-1对自噬蛋白表达的影响Fig.7 Effect of IGF-1 on autophagy proteins expressions was detected by Western blot

图8 激光扫描共聚焦显微镜观察IGF-1预处理对荧光自噬斑点表达的影响Fig.8 Effect of IGF-1 on expression of fluorescent autophagy spots was observed by laser scanning confocal microscope
3 讨论
自噬是Ashford和Porter在1962年发现细胞内“自己吃自己”现象后提出的概念,是必需的溶酶体降解过程,通过清除蛋白质聚集物和受损细胞器控制细胞质量[1]。自噬形成的双膜自噬小体与溶酶体融合形成自噬溶酶体,进而降低自噬成分,满足细胞本身代谢需要和实现部分细胞器更新[2]。自噬对机体自我平衡具有重要调节作用,其降解作用与多种疾病密切相关,包括代谢失调、神经病变、癌症及感染性疾病等[3]。
自噬有利于维持细胞稳态,应激条件下,自噬可防止有毒或致癌的蛋白质和细胞器累积,防止细胞癌变。而肿瘤一旦形成,自噬则为癌细胞提供更丰富的营养,促进肿瘤生长[16]。因此,在肿瘤发生发展过程中,细胞自噬的作用呈现完全相反的“两面性”[17]。各种病理状态下,自噬的作用到底是正向还是负向尚未完全阐明,尤其是肿瘤研究。研究表明,自噬在不同药物治疗肿瘤中发挥不同作用,可能增强药物疗效,也可能抑制药物对肿瘤细胞的杀伤作用[6-9,18]。因此,自噬作为调控肿瘤细胞生长的重要机制值得重点关注。
mTOR在肿瘤细胞中通常表达上调从而抑制细胞自噬[10]。作为细胞自噬中众多信号传导通路的关键节点和最主要的抑制性通路,具有重要作用[11]。PI3K/AKT作为肿瘤细胞中调控凋亡的经典信号通路,同时也是mTOR的上游靶点,前者对于后者的激活起重要作用[12,13]。因此,肿瘤细胞中自噬和凋亡关系密切。阐明红景天甙诱导的自噬现象在其抑制胃癌细胞增殖、促进凋亡等众多细胞表型中的作用及机制,将为胃癌防治新药物开发提供参考。
本研究主要聚焦于自噬,探讨自噬在红景天甙促进胃癌细胞凋亡中的作用及相关机制。通过透射电镜和mRFP-GFP-LC3转染证实红景天甙诱导AGS细胞自噬,利用经典的自噬晚期抑制剂氯喹预处理细胞[19]。通过Hoechst染色、流式细胞术和Western blot多角度提示抑制自噬可明显促进红景天甙诱导的细胞凋亡,表明自噬是细胞在外界攻击因素作用下激发的自我保护性防御反射,与Wang等[9]研究结论相似。提示在后续研究中,可进一步联合应用红景天甙和自噬抑制剂协同杀伤胃癌细胞。为进一步阐明红景天甙诱导AGS细胞自噬的机制,课题组通过Western blot实验发现红景天甙抑制磷酸化PI3K、磷酸化AKT以及磷酸化mTOR蛋白表达,利用IGF-1预处理细胞,通过Western blot和荧光共聚焦显微镜观察发现,激活mTOR的上游调节通路PI3K/AKT可降低自噬蛋白表达,提示红景天甙可通过抑制PI3K/AKT/mTOR信号通路诱导人胃癌AGS细胞自噬,与Fan等[20]结论一致。
红景天甙作为植物类中药在肿瘤防治中具有诸多优势,肿瘤研究初步显示出其特有的抗癌效果,具备研究潜力。课题组后续将利用细胞、动物模型结合基因、蛋白组学并联合生物信息学技术等手段对红景天甙的抗癌作用进行深入研究,为阐明红景天甙防治肿瘤的机制奠定重要基础。
——题《圣山系-金巅》

