TRIM31过表达改善脂多糖诱导下神经细胞的炎症损伤①
王 涛 梁日初 周 佳 罗 炜
(南华大学附属第二医院神经外科,衡阳 421001)
阿尔兹海默症(Alzheimer′s disease,AD)和帕金森症(Parkinson′s disease,PD)等神经退行性疾病严重威胁人类健康,其发病原因复杂,机制尚未完全明确。炎症小体介导的炎症途径与中枢神经系统疾病的发生密切相关[1]。NOD样受体蛋白3(nod-like receptor pyrin domain 3,NLRP3)炎症小体是机体固有免疫应答的重要组成部分,其过度激活可通过活化caspase-1持续地将无活性的IL-1β前体剪切为成熟IL-1β,激活下游信号通路产生大量的炎症因子,引起神经炎症反应,促进细胞凋亡,导致大脑病变[2]。E3泛素连接酶31(TRIM31)是TRIM家族成员,可通过对特定靶分子进行泛素化修饰和降解,参与细胞增殖、分化、癌变、自噬、凋亡等多种细胞生物学过程[3]。目前关于TRIM31的研究较少且主要集中于癌症研究,如胰腺癌、大肠癌、胆囊癌和肝癌等,关于其与神经退行性疾病的研究鲜有报道[4-7]。研究报道,TRIM31可通过促进NLRP3蛋白酶体泛素化降解,抑制NLRP3炎症小体活化,推测TRIM31可能通过抑制NLRP3炎症小体活化改善神经细胞炎症损伤[8]。本研究拟采用LPS诱导PC12细胞建立体外神经细胞炎症损伤模型,探讨TRIM31对PC12细胞损伤的保护作用及机制,为神经退行性疾病治疗提供新思路。
1 材料与方法
1.1材料 大鼠肾上腺嗜铬细胞瘤PC12细胞株由上海中科院细胞库提供;LPS购自美国Sigma公司;DMEM培养基和胎牛血清购自美国Gibco公司;TRIM31过表达质粒pcDNA3.1-TRIM31及其阴性对照质粒pcDNA3.1-NC均由汉恒生物科技(上海)有限公司构建;LipofectamineTM2000购自美国Invitrogen公司;反转录试剂盒、实时定量PCR试剂盒购自美国Thermo Fisher公司;IL-6、TNF-α、IL-1β和IL-18 ELISA试剂盒购自上海卡努生物科技有限公司;MTT检测试剂盒、BCA试剂盒和Annexin V-FITC流式凋亡试剂盒购自上海碧云天生物技术有限公司;TRIM31、NLRP3、caspase-1、Cleaved-caspase-3、Bcl-2、Bax和GAPDH抗体均购自美国Abcam公司。酶标仪、电泳仪购自美国Bio-Rad公司;流式细胞仪购自美国Backman公司。
1.2方法
1.2.1MTT检测细胞增殖活性 取对数生长的PC12细胞以5×104个/ml接种于96孔板,每孔100 μl,培养过夜。分别采用0、50、125、250、500和1 000 μg/ml LPS处理细胞24 h,培养结束后每孔加入20 μl MTT溶液(5 mg/ml),37℃孵育4 h,酶标仪测定各组490 nm处吸光度值,并计算存活率,选择最佳细胞损伤浓度进行后续实验。
1.2.2细胞转染及分组处理 取对数生长期PC12细胞,胰酶消化制备单细胞悬液,2×105个/孔接种于6孔板,待细胞融合度达到80%时,按照LipofectamineTM2000转染试剂说明书,将pcDNA3.1-TRIM31和pcDNA3.1-NC分别转染至PC12细胞,另取不做任何质粒转染的PC12细胞作为空白对照组(blank),分别记为TRIM31组、NC组和blank组。转染48 h后,qRT-PCR和Western blot检测转染后PC12细胞中TRIM31表达水平以验证转染效果。将细胞分为4组:①对照组(Control):PC12细胞不经任何处理;②LPS组:PC12细胞经500 μg/ml LPS处理24 h;③LPS+NC组:转染阴性对照质粒后的PC12细胞,再经500 μg/ml LPS处理24 h;④ LPS+TRIM31组:转染TRIM31过表达质粒后的PC12细胞,再经500 μg/ml LPS处理24 h。
1.2.3ELISA检测细胞上清中炎症因子含量 收集各组细胞培养上清,5 000 r/min离心10 min,收集上清,按照试剂盒说明书操作,酶标仪检测450 nm处各孔OD值,根据标准曲线计算IL-6、TNF-α、IL-1β和IL-18含量。
1.2.4流式细胞术检测细胞凋亡 收集各组细胞,离心、洗涤后置于流式管,加入195 μl Annexin V结合液重悬细胞,再加入5 μl Annexin V 染液,振荡混匀后于室温下避光孵育15 min,加入10 μl PI染液,室温下避光孵育10 min,流式细胞仪检测细胞凋亡率。
1.2.5免疫荧光检测NLRP3蛋白表达 将转染的PC12细胞以1×105个/孔接种于含无菌载玻片的6孔板,待细胞融合度达到70%时,加入500 μg/ml LPS处理24 h。弃细胞培养液,加入4%多聚甲醛室温固定15 min,PBS洗3次后以2%BSA室温封闭1 h,再加入50 μl NLRP3抗体稀释液,4℃孵育过夜。次日,PBS洗涤并滴加Alexa Fluor®488标记的荧光二抗稀释液,避光室温孵育30 min,PBS洗涤加入DAPI室温下染核5 min,PBS洗涤,载玻片上滴加适量抗荧光淬灭封片剂,置于荧光显微镜下观察拍照。
1.2.6qRT-PCR检测基因表达 收集各组细胞,Trizol法提取细胞总RNA,逆转录为cDNA,以cDNA为模板,GAPDH为内参,荧光PCR扩增仪扩增各基因mRNA,95℃ 30 s,95℃ 5 s,60℃ 30 s,共40个循环。2-ΔΔCt法计算TRIM31、NLRP3和caspase-1 mRNA相对表达水平,引物序列见表1。
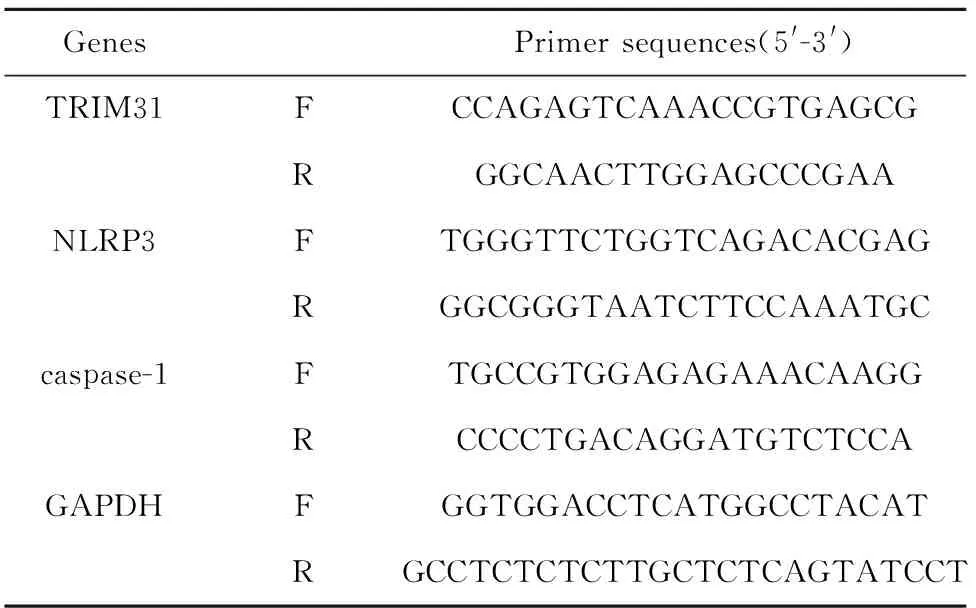
表1 引物序列Tab.1 Primer sequences
1.2.7Western blot检测蛋白表达 收集最佳浓度处理后的PC12细胞和未经任何处理的PC12细胞沉淀,收集1.2.2各组细胞沉淀,分别加入适量RIPA裂解液于冰上裂解,12 000 r/min于4℃离心20 min,取上清,BCA试剂盒检测蛋白浓度。取25 μg 蛋白经沸水浴变性后,10% SDS-PAGE分离蛋白并转移至PVDF膜,5%脱脂牛奶室温封闭1 h,加入一抗TRIM31、NLRP3、caspase-1、Cleaved-caspase-3、Bcl-2、Bax和GAPDH,4℃孵育过夜,TBST洗膜3次后加入辣根过氧化酶标记的山羊抗兔IgG二抗,室温孵育1 h,加入ECL发光液,暗室显影并拍照。Image J软件对蛋白电泳条带灰度值进行定量分析。

2 结果
2.1LPS对PC12细胞增殖活性的影响 MTT检测结果显示,随LPS干预浓度提高,PC12细胞增殖活性逐渐降低(F=62.820,P<0.001)。50 μg/ml和125 μg/mlLPS处理对PC12细胞增殖活性差异无统计学意义(P>0.05)。250、500、1 000 μg/ml LPS处理PC12细胞时细胞增殖活性分别为(80.67±4.92)%、(66.01±3.27)%和(43.66±3.30)%,见图1。根据MTT结果选择500 μg/ml LPS作为后续实验工作浓度。

图1 不同浓度LPS对PC12细胞存活率的影响Fig.1 Effect of different concentrations of LPS on survival rate of PC12 cells
2.2LPS对PC12细胞TRIM31蛋白表达的影响 500 μg/ml LPS处理PC12细胞24 h后,PC12细胞TRIM31蛋白表达水平显著降低(P<0.01),见图2。
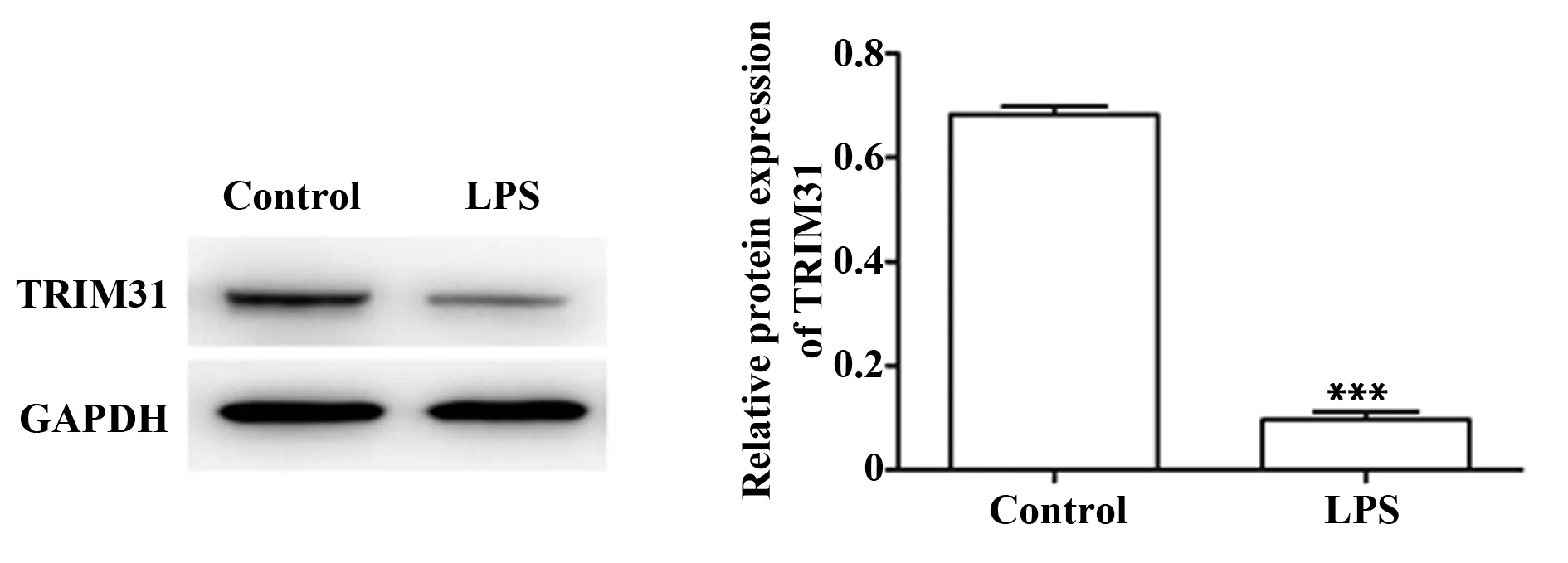
图2 LPS处理后PC12细胞TRIM31蛋白表达水平Fig.2 Protein expression levels of TRIM31 in PC12 cells after LPS treatment
2.3TRIM31过表达对PC12细胞TRIM31 mRNA和蛋白表达的影响 与blank组相比,NC组PC12细胞TRIM31 mRNA和蛋白表达水平差异无统计学意义(P>0.05);与NC组相比,TRIM31组PC12细胞TRIM31 mRNA和蛋白表达水平显著升高(P<0.01),见图3。
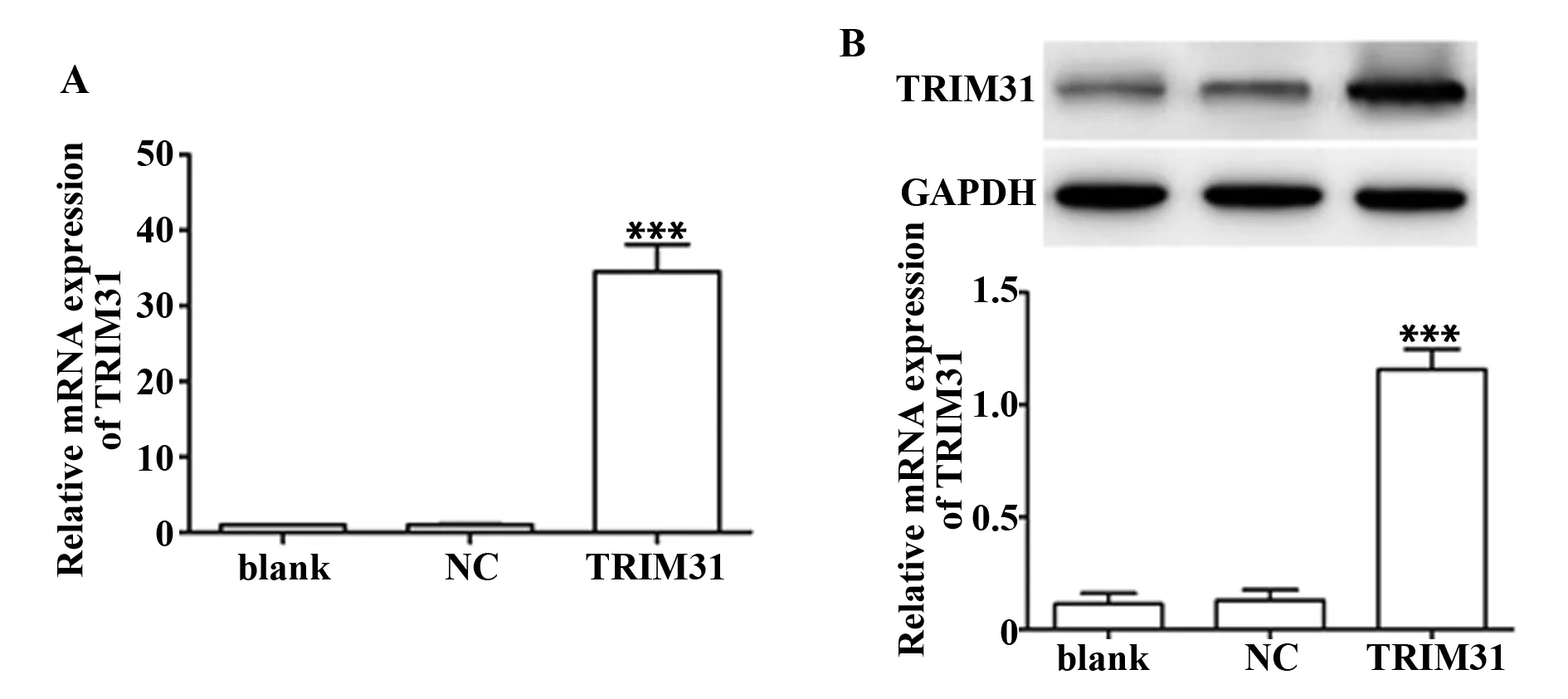
图3 转染后PC12细胞中TRIM31 mRNA和蛋白表达水平Fig.3 mRNA and protein expression levels of TRIM31 in infected PC12 cells
2.4TRIM31过表达对LPS诱导下PC12细胞炎症因子水平的影响 与Control组相比,LPS组细胞上清IL-6、TNF-α、IL-1β和IL-18表达水平均显著上升(P<0.01);与LPS组相比,LPS+TRIM31组细胞上清IL-6、TNF-α、IL-1β和IL-18表达水平均显著下降(P<0.01),与LPS+NC组差异无统计学意义(P>0.05)。见图4。
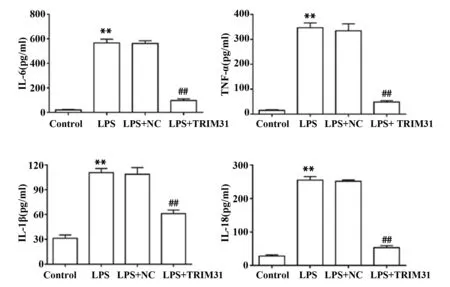
图4 各组细胞上清IL-6、TNF-α、IL-1β和IL-18含量Fig.4 Contents of IL-6,TNF-α,IL-1β and IL-18 in cell supernatant of each group
2.5TRIM31过表达对LPS诱导下PC12细胞凋亡的影响 与Control组相比,LPS组细胞凋亡率显著上升(P<0.01),细胞内Cleaved-caspase-3、Bax蛋白水平显著上调(P<0.01),Bcl-2蛋白水平显著下调(P<0.01);与LPS组相比,LPS+TRIM31组细胞凋亡率显著下降(P<0.01),细胞内Cleaved-caspase-3、Bax蛋白水平显著下调(P<0.01),Bcl-2蛋白水平显著上调(P<0.05),与LPS+NC组差异无统计学意义(P>0.05),见图5、6。
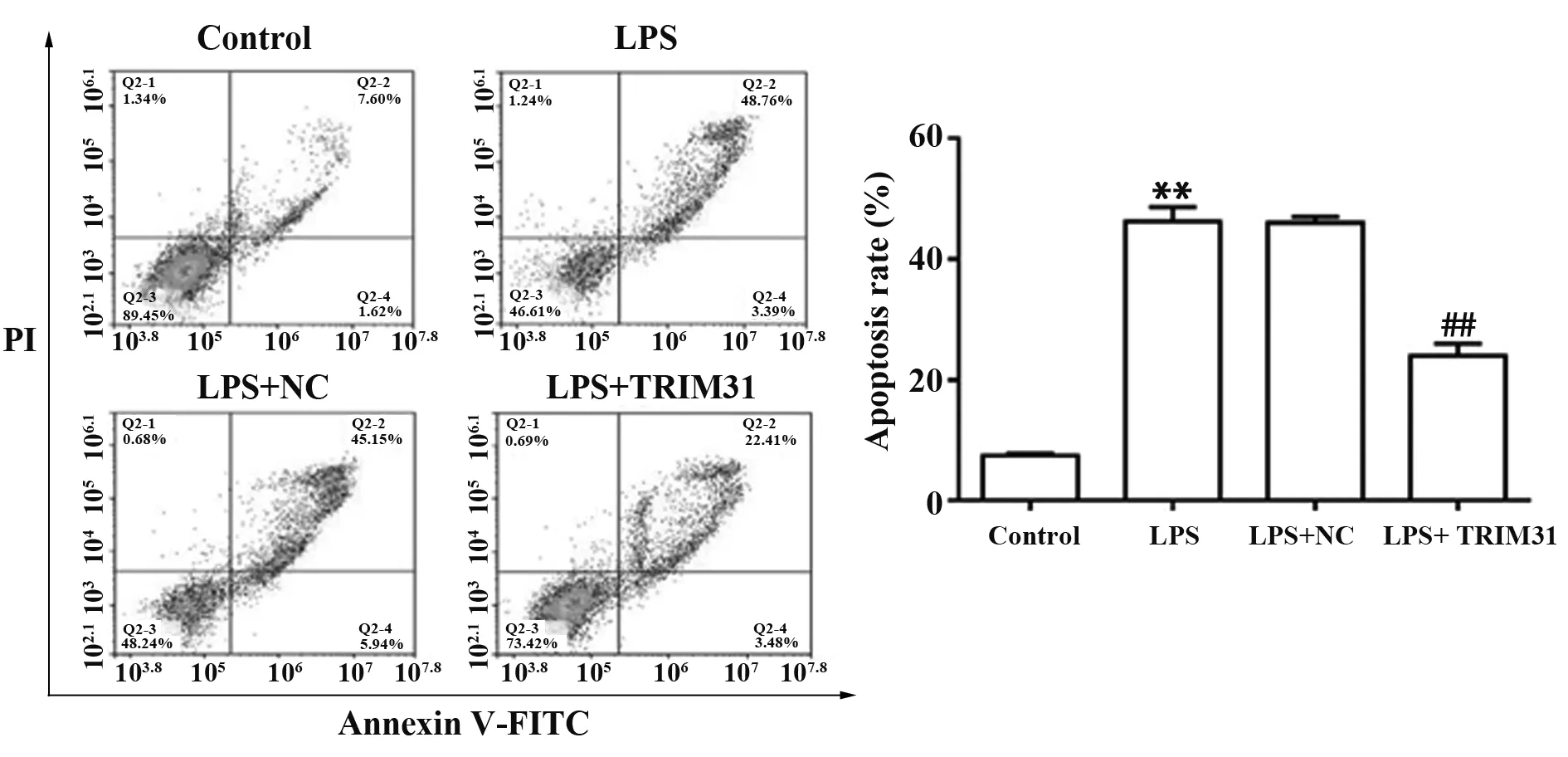
图5 各组细胞凋亡率Fig.5 Apoptosis rate of cells in each group
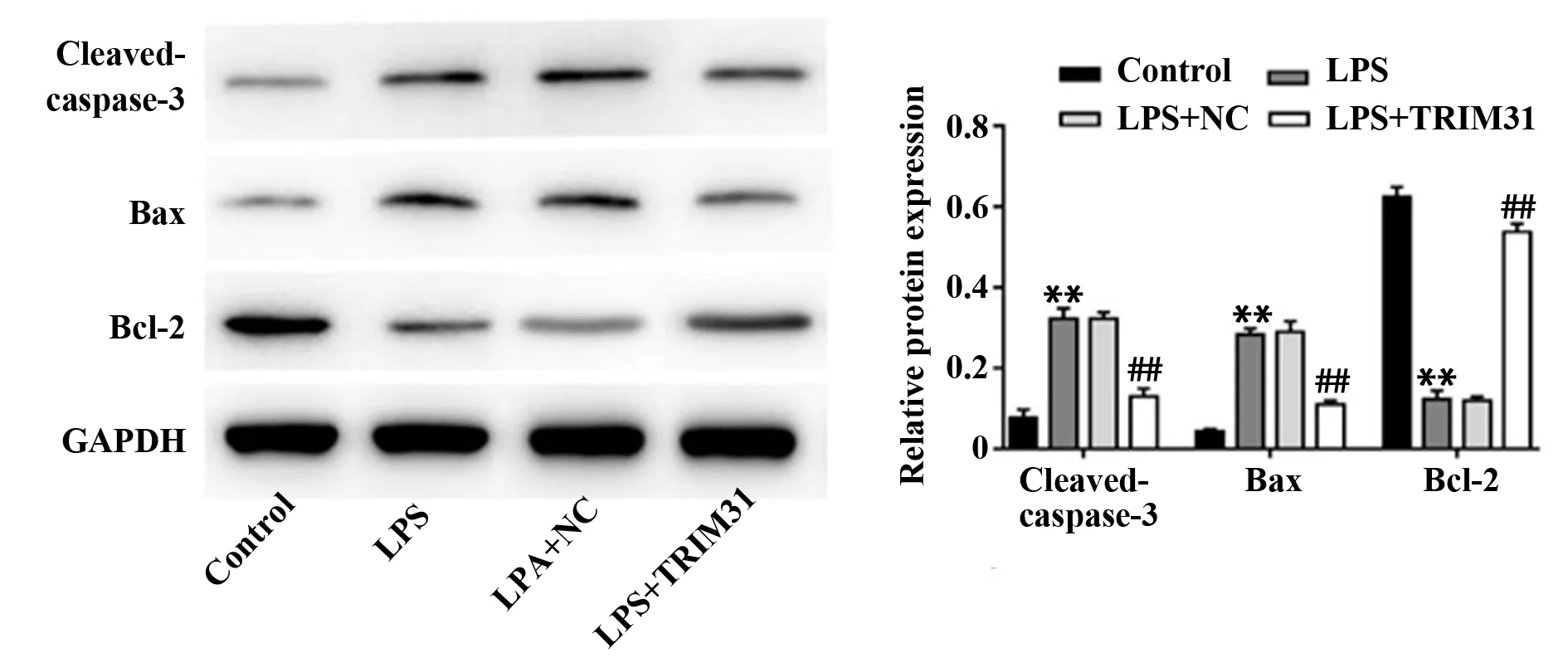
图6 各组细胞Cleaved-caspase-3、Bcl-2和Bax蛋白表达水平Fig.6 Expression levels of Cleaved-caspase-3,Bcl-2 and Bax proteins in each group
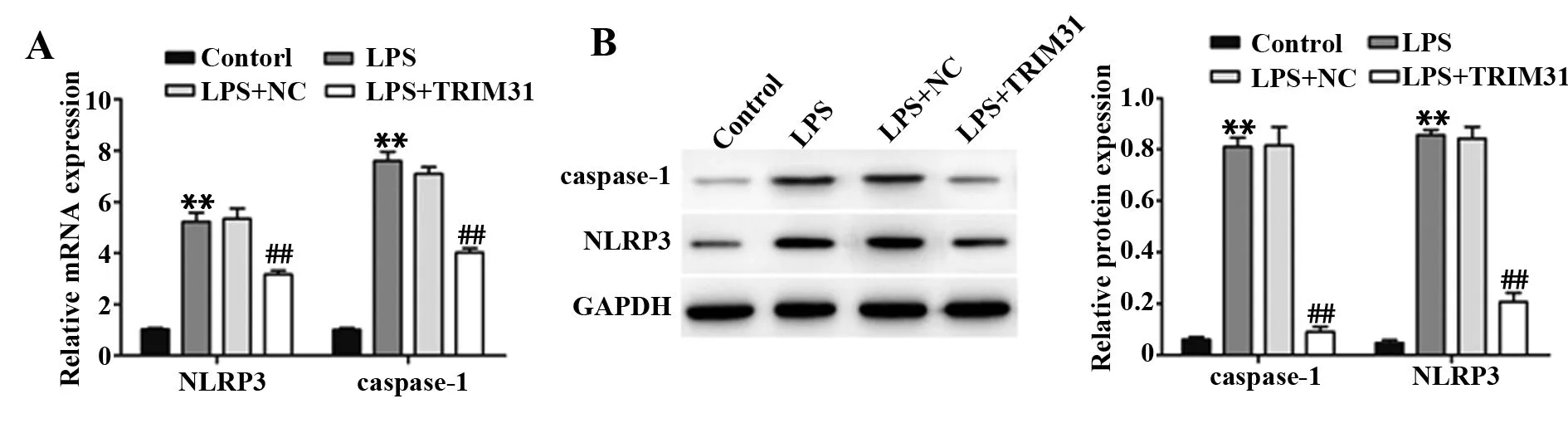
图8 各组细胞NLRP3和caspase-1表达水平Fig.8 Expression levels of NLRP3 and caspase-1 in each group
2.6TRIM31过表达对LPS诱导下PC12细胞NLRP3炎症小体活化的影响 与Control组相比,LPS组细胞NLRP3荧光强度显著增强,细胞内NLRP3、caspase-1 mRNA和蛋白表达水平均显著增加(P<0.01);与LPS组相比,LPS+TRIM31组细胞NLRP3荧光强度显著减弱,细胞内NLRP3、caspase-1 mRNA和蛋白表达水平均显著降低(P<0.01),与LPS+NC组差异无统计学意义(P>0.05),见图7、8。
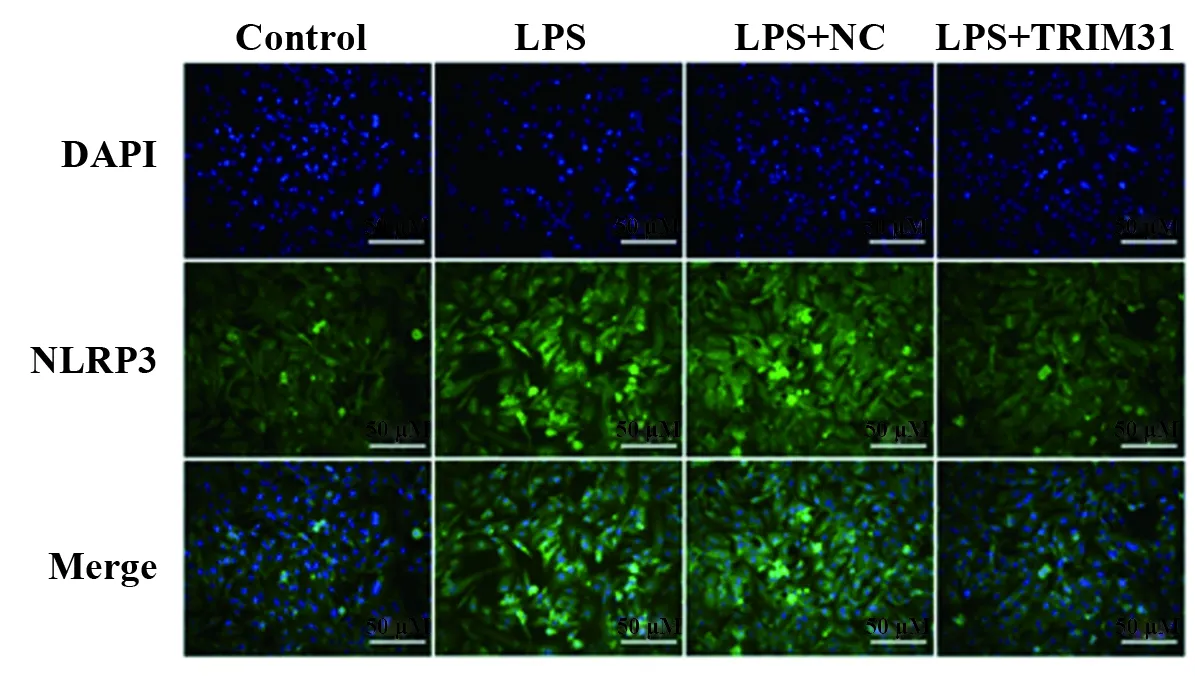
图7 免疫荧光检测各组细胞中NLRP3表达水平(×200)Fig.7 Expression level of NLRP3 of cells in each group detected by immunofluorescence (×200)
3 讨论
神经系统退行性疾病呈进行性发展,且发病机制不明确,治愈率较低。近年研究已明确NLRP3作用,且在AD、PD等患者中均发现NLRP3炎症小体的活化[9,10]。激活的NLRP3炎症小体可促进关键致炎因子IL-1β等成熟和分泌,参与内在免疫炎症反应,导致炎症细胞凋亡。神经免疫炎症是级联反应,事件启动后将产生大量神经免疫炎症因子,寻找神经免疫炎症的上游因子作为关键靶点,将为根源上遏制神经系统退行性疾病提供思路。TRIM31是TRIM家族Ⅴ亚族成员,但其相关研究报道较少,可能与炎症和肿瘤相关,但具体作用机制尚不明确,且其在神经系统退行性疾病中的作用鲜有报道。在静止和活化的巨噬细胞中,TRIM31可直接与NLRP3炎症小体结合,介导其蛋白酶降解维持其低表达,抑制炎症反应,提示TRIM31可能参与AD、PD等神经系统退行性疾病发展[8]。但TRIM31与NLRP3炎症小体在AD和PD中的关系如何、TRIM31是否可通过调控NLRP3炎症小体活化参与AD和PD病理进程等尚不明确。本研究结果显示,LPS处理可抑制PC12细胞TRIM31蛋白表达,而过表达TRIM31可减少PC12细胞炎症反应和细胞凋亡,其作用机制可能与抑制NLRP3炎症小体活化相关。
PC12细胞来源于大鼠嗜铬细胞瘤细胞,具备神经内分泌细胞的一般特征,广泛用于神经生理和神经药理学研究[11]。本研究采用LPS诱导PC12细胞建立体外神经细胞炎症损伤模型,结果表明LPS剂量依赖性抑制PC12细胞增殖活性,LPS作用浓度为500 μg/ml时,PC12细胞存活率约为65%,与陈艳杰等[12]研究结果相似。500 μg/ml LPS作用PC12细胞24 h,细胞活力虽有所下降,但活性仍为65%,仍可保持细胞持续增殖状态,符合细胞模型的一般要求,故本研究选取该浓度进行后续研究。
炎症因子作为神经细胞应激活化后释放的分子在AD和PD等神经炎症中起核心作用。研究证实,AD和PD患者大脑黑质和纹状体组织中存在异常表达的炎症因子,如TNF-α、IL-1β、IL-6等,与神经细胞的凋亡和神经损伤相关[13]。Miryam等[14]在AD和PD动物模型中发现,IL-1β、IL-6等炎症因子在模型动物海马组织中高表达。本研究结果显示,LPS诱导下的PC12细胞内IL-6、TNF-α、IL-1β和IL-18含量显著上升,细胞凋亡率和凋亡相关蛋白Cleaved-caspase-3、Bax蛋白水平显著上调,Bcl-2蛋白水平显著下调。转染TRIM31过表达质粒后,PC12细胞炎症因子、细胞凋亡率及Cleaved-caspase-3和Bax蛋白明显下调,Bcl-2蛋白上调,提示TRIM31可能减少炎症物质分泌,改善PC12细胞炎症损伤,减少细胞凋亡。
NLRP3炎症小体由NLRP3炎症小体受体蛋白、ASC衔接蛋白和caspase-1构成,是炎症因子成熟的重要途径,在IL-1β、IL-18等炎症因子释放过程中发挥重要作用。NLRP3炎症小体异常活化可导致包括神经退行性疾病在内的多种炎症性疾病[15]。Heneka等[16]发现NLRP3炎症小体激活可促进APP/PS1双转基因鼠脑内β-淀粉样蛋白沉积和AD病理进程,NLRP3基因敲除小鼠可显著缓解空间记忆障碍。Gordon等[17]发现PD模型小鼠大脑黑质IL-1β、caspase-1和NLRP3表达显著上调,但经NLRP3抑制剂MCC950治疗后,PD小鼠运动能力明显改善,提示NLRP3可能是AD、PD等神经退行性疾病的潜在靶点。TRIM31可促进NLRP3蛋白酶体泛素化降解[8]。为进一步明确TRIM31与NLRP3炎症小体在神经细胞炎症损伤中的调控作用,本研究检测各组细胞NLRP3和caspase-1表达水平,结果显示LPS诱导PC12细胞后,细胞NLRP3和caspase-1表达显著上调,说明NLRP3炎症小体被激活。转染TRIM31过表达质粒后,细胞NLRP3和caspase-1表达被显著抑制,说明过表达TRIM31可能促进NLRP3蛋白酶体泛素化降解,抑制NLRP3炎症小体活化,进而抑制LPS诱导的PC12细胞炎症损伤。
综上所述,过表达TRIM31可通过抑制NLRP3炎症小体活化,减轻LPS诱导下PC12细胞内炎症反应,减少细胞凋亡,缓解PC12细胞炎症损伤,为AD和PD等神经系统退行性疾病的防治提供全新的药物作用靶点。临床应用该类药物时可通过设计合成TRIM31小分子激动剂或寻找天然化合物作用于该靶点,并进行化学修饰、制剂改造、联合用药、超声波干预等,促使其进入血脑屏障。

