线粒体及其自噬与不同程度弱精子症的关系*
刘俊,张友旺,潘龙瑞,谭艳
(1.锦州医科大学 湖北医药学院研究生培养基地,湖北 十堰442000;2.湖北医药学院基础医学院,湖北 十堰 442000)
精子活动力是决定男性生育能力的关键因素,由于精子活动力下降导致的弱精子症是男性不育的常见病因之一[1]。精子活动力来源于细胞内线粒体的氧化磷酸化和线粒体外的糖酵解途径[2]。目前的研究表明,线粒体及其自噬在维持生精细胞的稳态及在成熟过程中发挥着重要作用[3-5],但是线粒体及其自噬在维持人类精子活动力方面的作用及调节自噬后对人类尤其是中国男性射精精子活动力影响的研究较少见。故本研究通过观察精子形态、检测自噬相关蛋白微管相关蛋白1轻链3 (microtubule associated protein 1 light chain 3,LC3),以及线粒体外膜转位酶 (translocase of outer mitochondrial membrane 20,TOM20) 的表达水平,探索线粒体及其自噬对精子活动力的影响,以期为男性不育症的诊断、治疗及预后提供实验依据。
1 资料与方法
1.1 研究对象
收集2017年12月—2018年12月在湖北医药学院附属人民医院男科及生殖中心就诊的男性精液样本。纳入标准:①精液浓度≥15×106个/ml;②年龄>22岁;③排除有泌尿生殖系统疾病家族遗传史及有手术外伤史等可能会影响精子质量的患者。通过手淫取精于无菌取精杯内,置37℃恒温培养箱内液化30 min。待精液完全液化后,按照WHO《人类精液检查与处理实验室手册》第5版检验标准对所有的实验对象进行精液常规检查[6],按照精子前向运动速率 (progressive motility,PR) 将其区分为4组:正常对照组 (PR ≥32%),轻度弱精子症组 (20%≤PR<32%),中度弱精子症组 (10%≤PR<20%),重度弱精子症组 (0%<PR<10%)。每组30例,合计120例。本研究经医院医学伦理委员会同意,患者家属签署知情同意书。
1.2 试剂及仪器
Percoll 液购自美国Pharmacia公司,BWW精子培养液 (由Biggers-Whitten-Whittingham 研究小组在1971年发表,又称为获能培养液) 购自生工生物工程 (上海) 股份有限公司,电镜固定液购自武汉谷歌生物科技公司,Mitotracker Deep Red (MTDR) 荧光染料购自北京中杉金桥生物科技有限公司,内参GAPDH、兔抗LC3、TOM20一抗、HRP-山羊抗兔IgG 二抗及FITC标记山羊抗兔IgG均购自上海碧云天生物技术有限公司。制冰机、超净工作台、4℃冰箱、-20℃冰箱及37℃恒温箱均购自青岛海尔集团,移液器及振荡器购自北京Dragon-Lab 实验仪器公司,计算机辅助精液分析系统 (computer-aided sperm analysis,CASA) 购自北京自然基因科技有限公司,高速冷冻离心机购自德国Eppendorf公司,激光共聚焦免疫荧光成像系统购自荷兰Olympus公司。
1.3 实验方法
1.3.1 精子的电镜检测取500 μl 精液标本,加入约10倍体积的电镜固定液室温固定2 h,再转移至4℃预冷1 h后,恒温4℃冰袋运输至武汉谷歌生物科技有限公司,由该公司对标本进行处理后采集图像,根据图像分析各组精子中线粒体数量、形态、分布等。
1.3.2 Percoll 法分离精液为避免精液中的生精细胞及精浆中的白细胞对结果产生影响,采用非连续梯度离心的方法对精子进行分离。具体操作如下:将40%Percoll 液2 ml+80% Percoll 液2 ml+精液2 ml 缓慢分层加入离心管中,1 200 r/min 离心15 min,弃上清,底层沉淀即为分离出的精子。底层精子加入2 ml PBS,然后1 200 r/min 离心15 min,洗涤3次。镜下确认纯化效果并计数,纯化后的精子可用于后续实验。
1.3.3 Western blotting检测LC3及TOM20的相对表达量将纯化精子重悬于细胞溶解液RIPA,同时按1∶100的比例加入蛋白酶抑制剂苯甲基磺酰氟 (100 mg/ml),超声裂解10 s×5次,全程置于冰上操作。4℃、15 000 r/min 离心15 min,上清即为精子总蛋白。用上海碧云天生物技术有限公司的BCA 蛋白检测试剂盒检测蛋白浓度,加入5×SDS Loading buffer,100℃煮5 min。配置12% SDS-PAGE胶,每孔上样30 μg蛋白,常规电泳和转膜,用含5%脱脂牛奶的PBST 室温封闭2 h,兔抗LC3、TOM20 一抗4℃孵育过夜。次日,PBST 洗膜8 min×3次。然后用HRP-羊抗兔IgG 二抗室温孵育2 h,PBST 洗膜8 min×3次,用化学发光法 (ECL) 显影。采用Image Lab 图像分析软件测定每条带的灰度值,用样本与相对应内参GAPDH的灰度值比值作为该样本蛋白的相对表达量。
1.3.4 免疫荧光检测LC3及线粒体数量将纯化的精子重悬于BWW精子培养液中,调整浓度为30×106个/ml,按照1∶100的比例加入兔抗LC3 一抗4℃孵育过夜,1 200 r/min 离心15 min,弃上清,PBS 1 200 r/min 离心15 min,洗涤3次,加入BWW精子培养液在显微镜下调整浓度为30×106个/ml,按照1∶100的比例加入FITC标记山羊抗兔IgG及MTDR荧光染料,避光孵育60 min,1 200 r/min 离心5 min,弃上清,PBS 1 200 r/min 离心5 min,洗涤3次,加入抗荧光淬灭封片剂重悬浮精子,取5 μl 混悬液置于载玻片上,使用盖玻片推片,激光共聚焦显微镜观察拍照。
1.4 统计学方法
数据分析采用SPSS 21.0 统计软件。符合正态分布的计量资料以均数±标准差 (±s)表示;不服从正态分布的计量资料,经转化处理后服从正态分布,多组间比较用单因素方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同活动力精子电镜检测结果
电镜结果显示,所有精液样本中的精子头部及鞭毛完整,未见畸形精子,但线粒体的形态、数量及分布存在差异。具体表现为:正常对照组可见线粒体位于精子尾部颈部至中段,线粒体与精子尾轴呈平行规则排列,以规则的圆形及卵圆形多见;线粒体数次50~70个不等,线粒体长径与横径比约为2∶1,相邻的线粒体分界清晰;线粒体双层膜结构清晰,嵴膜和嵴间隙结构较完整,内有或无颗粒。轻度弱精子症组可见精子线粒体数量较正常组减少,形态不规则,趋于圆形;双层膜结构尚存在,内部可出现空泡化,线粒体旁可见自噬小泡形成。中度弱精子组可见精子线粒体数量较前进一步减少,分布不均匀,主要集中在头颈部,可出现双重或3层重叠线粒体围绕于轴丝,部分脱鞘,形态明显不规则,线粒体嵴消失,肿胀明显,伴有内部明显空泡化,可形成微囊状结构;肿胀的线粒体周围可见大量自噬小泡形成。重度弱精子组可见线粒体排列紊乱、分布极不均匀,可沿尾部分散排列,伴有数量减少,体积缩小,膜间隙消失,局部可见形似凋亡小体的不规则高密度结晶状物聚集。见图1。
2.2 各组线粒体数量及LC3的表达
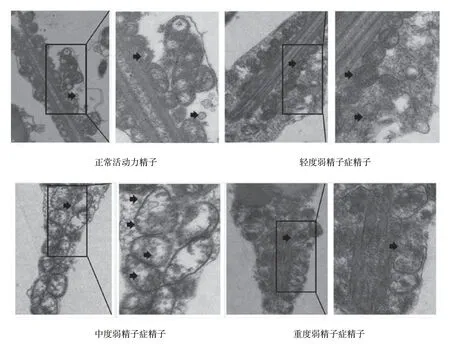
图1 不同弱精子症患者精子的线粒体结构 (电镜×10 000)
激光共聚焦显微镜可见,在正常对照组中,线粒体主要位于精子头部及尾部中段,被MTDR 染色后呈红色,而FITC标记的LC3荧光颗粒也同时位于此处,在荧光显微镜下呈绿色,红绿两者共定位,故呈黄色。随着弱精子症程度的加重,线粒体分布逐渐由头部及尾部中段向整个尾部移动,包括FITC标记的LC3荧光颗粒也随之向远处移动,并伴有分布不均匀及数量减少。在不同组的精子中,线粒体的分布以及自噬发生的程度均有不同的表现,两者存在共定位的现象。见图2。
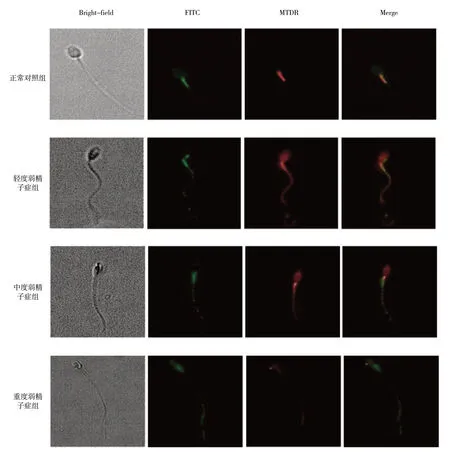
图2 不同程度弱精子症患者精子中线粒体及自噬颗粒分布情况 (激光共聚焦显微镜×63)
2.3 各组TOM20与LC3的表达
结果显示,各组TOM20与LC3的表达量比较,差异有统计学意义 (P<0.05)。在不同程度弱精子症组中LC3和TOM20表达随着精子活动力下降,呈现逐渐递减趋势 (P<0.05)。见表1和图3、4。
表1 4组LC3及TOM20 蛋白表达水平比较 (n=30,±s)
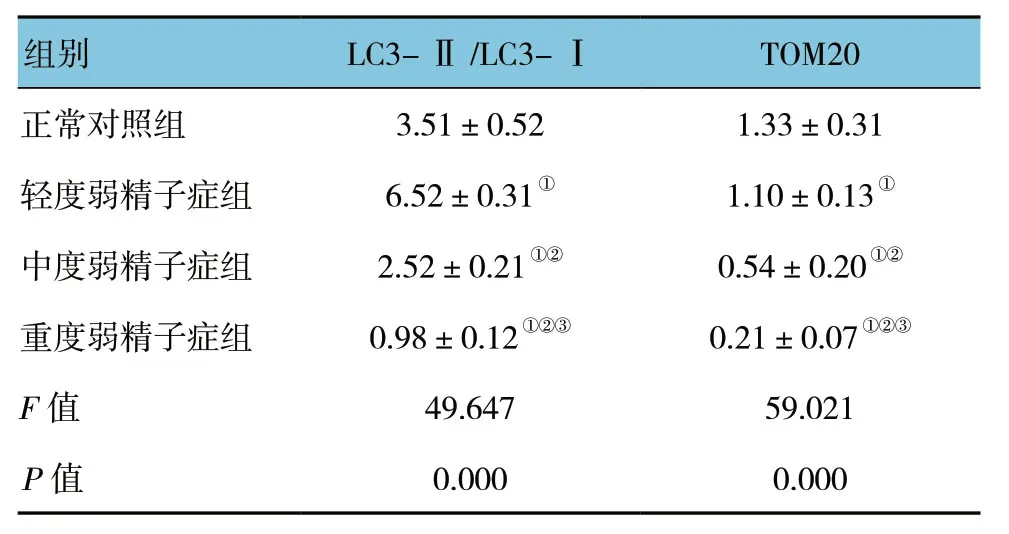
表1 4组LC3及TOM20 蛋白表达水平比较 (n=30,±s)
注:①与正常对照组比较,P<0.05;②与轻度弱精子症组比较,P<0.05;③与中度弱精子症组比较,P<0.05。
组别 LC3-Ⅱ/LC3-I TOM20正常对照组 3.51±0.52 1.33±0.31轻度弱精子症组 6.52±0.31① 1.10±0.13①中度弱精子症组 2.52±0.21①② 0.54±0.20①②重度弱精子症组 0.98±0.12①②③ 0.21±0.07①②③F值 49.647 59.021 P值 0.000 0.000
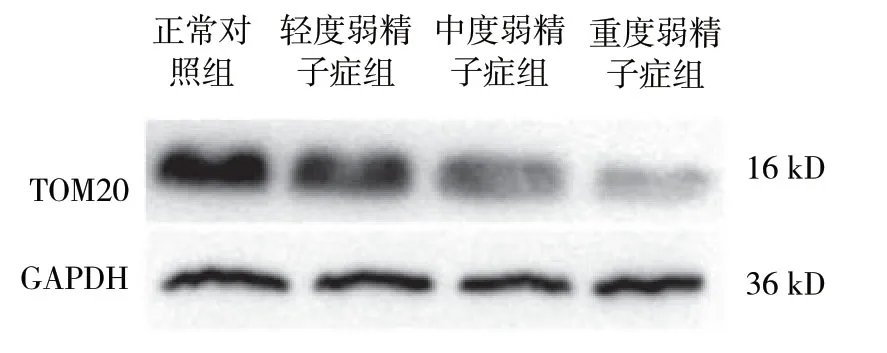
图3 各组TOM20 蛋白的表达
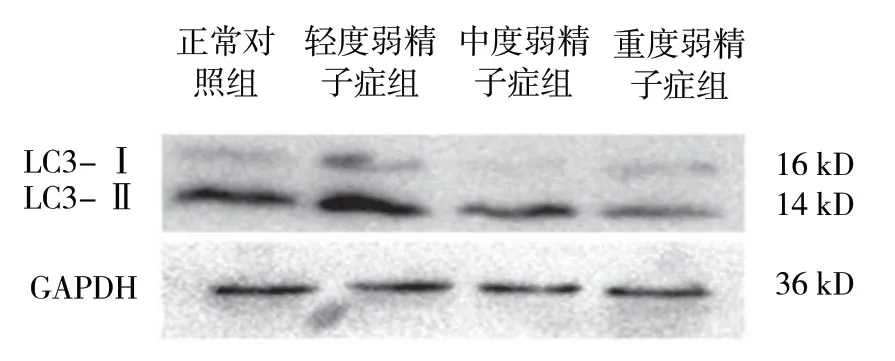
图4 各组LC3 蛋白的表达
3 讨论
良好的精子质量是成功受精和后代存活的重要因素,通常可由多个质量指标进行评估[7]。精子活动力是男性生育能力的关键因素。对人类而言,发育成熟的精子只有获得运动能力后才能穿透宫颈黏液,抵达输卵管壶腹部与卵子结合形成受精卵[8-9]。而外界环境污染、不良生活习惯、免疫因素或理化因素等均可导致人类精子活动力降低[10-12]。早在1955年已经证实,精子活动力的能量来源是三磷酸腺苷 (ATP)[13-14]。而精子内ATP的来源也与大多数真核生物一样来源于2条通路:细胞内的氧化磷酸化和糖酵解,但是关于能量代谢通路的主导作用一直备受争议[15]。
目前多数研究认为,由于糖酵解相关酶系存在于细胞质中,反应速度快,涉及的环节少,相对于复杂的三羧酸循环更加适用于精子的能量供应;同时由于精子尾部轴丝的“9+2”微管结构相互滑动过程导致精子活动的过程中所需的ATP数量巨大,需要ATP的快速供应,这时由于线粒体位于精子尾部中段,距离轴丝尾部较远,所产生的ATP无法快速转运至轴丝尾部,所以此时糖酵解反应的快速性就成为轴丝尾部运动所需ATP的主要“供给者”。结合国内外的研究,糖酵解可提供精子尾部运动所需能量的80%~90%,而线粒体仅提供约10%~20%[16-17]。线粒体作为成熟精子唯一保留的细胞器,在维持精子正常功能过程中尤其是精子的发育成熟过程中发挥重要的作用[18-19]。研究证实,精子线粒体与受精卵中父系线粒体DNA的清除有重要关联[20]。线粒体在发挥活性功能的同时产生的诸如活性氧类 (reactive oxygen species,ROS) 等代谢物需要特定的通路进行代谢。正常情况下,睾丸内ROS的产生及清除处于一种相对平衡的状态。生理浓度的ROS不仅对精子无害,而且还可以诱导其顶体反应,促进精子的获能;但是当ROS的浓度超过一定程度,男性生殖系统内的抗氧化系统难以将其清除时,ROS 可对精子的生存及活动力产生危害,称之为氧化应激[21]。而线粒体在此过程中正是通过自噬发挥一定的清道夫功能。本研究中,通过透射电镜发现,随着弱精子症程度的加重,线粒体形态逐渐发生水肿空泡化,同时伴有自噬小泡数量逐渐增多,但是随着弱精子症程度的进一步加重至重度弱精子症时,自噬减弱甚至消失,主要因为线粒体的大量破坏,使其无法发挥正常功能。
精子活动力与精子线粒体的损伤程度息息相关,随着弱精子症程度的加重,线粒体的形态、分布、功能等均发生改变,正常线粒体的数量逐渐减少,在此过程中线粒体自噬可能对精子活动力起到一个正向调节作用,但是当损伤线粒体达到一定程度和数量后,线粒体无法发挥正常功能,自噬减弱或消失从而导致精子活动力呈现塌方式下降。本研究仅仅通过对弱精子症分度后进行研究,发现线粒体膜蛋白及自噬标记蛋白表达呈现出一定趋势,尚未通过对线粒体功能及自噬过程的干扰观察到精子活动力改变,需要后期研究深入探讨。
综上所述,虽然目前尚未明确射精精子活动力调节就是线粒体自噬在发挥作用,但是线粒体自噬在精子活动力的调节中起到很大的作用,随着精子活动力的减弱,线粒体数量及自噬相关蛋白的表达均发生一定程度的改变,并且不同程度弱精子中线粒体的功能对于精子活动力有一定的调节作用。当然本研究未考虑到精浆中的成分对精子活动力的影响。因此,可以通过调节射精精子线粒体自噬的强度来调节精子的活动力,从而为弱精子症的治疗提供一个新的治疗靶点。

