合并线粒体基因突变及中枢神经系统损害的2型糖尿病1例家系报告及文献复习
于之瑶 李静
中国医科大学附属第一医院内分泌科 110001
2型糖尿病(T2DM)是一类常见代谢性疾病,以胰岛素抵抗(IR)和胰岛素分泌障碍为特征。线粒体氧化磷酸化在胰岛素介导的糖酵解过程中起重要作用,且部分T2DM患者呈明显母系遗传,推测线粒体脱氧核糖核酸(mtDNA)某些突变可能与T2DM的发生有关。现报道合并线粒体mtDNA16189T>C突变伴中枢神经系统损害的T2DM家系1例。
1 病例资料
1.1 先证者 先证者男性,17岁,因“口渴、多饮、多尿1年余”于2019年2月就诊于中国医科大学附属第一医院内分泌科。患者自2016年12月开始无明显诱因出现多饮、多食,半年内体重增加6 kg,未就医诊治,2017年5月于中国医科大学附属第一医院门诊初诊为T2DM并住院治疗,糖尿病并发症、合并症指标分析及相关检查见表1、2。2017年出院后予以地特胰岛素、二甲双胍治疗,空腹血糖控制在8~10 mmol/L,餐后2 h血糖控制在11~12 mmol/L,之后血糖控制不佳,餐后2 h血糖最高达20 mmol/L,遂于2019年2月再次住院治疗。
既往否认脑卒中等病史,2015年于中国医科大学附属第一医院心理门诊诊断为双相情感障碍(BPD),规律应用丙戊酸钠缓释片0.5 g、阿立哌唑2.5 mg/d,每日 1次,口服至今。
2019年体格检查:身高183 cm,体重90 kg,体重指数为26.9 kg/m2。无颜面潮红、满月脸及多血质貌,无齿龈色素沉着、口鼻增厚,甲状腺未触及,颈后无脂肪垫,双乳房Tanner 3期,无溢乳,腹部无紫纹,阴毛呈男性分布,眼科查体:眼底未见出血及渗出,左眼生理盲点扩大,双眼视神经纤维层象限性变薄,黄斑中心凹反射(+),眼压增高:右眼25 mmHg(1 mmHg=0.133 kPa),左眼24 mmHg。
2019年实验室检查:入院血浆乳酸测定为31.6 mg/dl,停二甲双胍1周后复查降至18.2 mg/dl(参考范围4.5~19.8 mg/dl);余相关指标检查结果见表1、2。
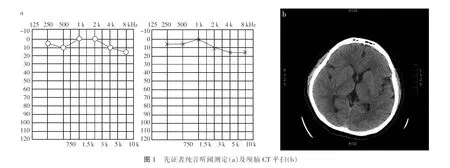
2019年辅助检查:纯音测听提示双耳无神经性耳聋,听力曲线呈高频略降,见图1a,颅脑CT平扫未见异常,见图1b。
询问病史发现先证者为独生子,母亲及外祖母患糖尿病,考虑其母系遗传方式,结合先证者血浆乳酸水平升高,对先证者行线粒体基因检测,发现其存在mtDNA16189T>C突变(变异比例约95.7%,变异分类属易感相关)。
诊断:合并线粒体基因突变的T2DM、糖尿病周围神经病变、高乳酸血症、BPD、重度脂肪肝、高尿酸血症、高甘油三酯血症、高总胆固醇血症、双眼高度近视、双眼开角型青光眼。

表1 2017年及2019年先证者糖代谢相关指标、检查结果比较

表2 2017年及2019年先证者口服葡萄糖耐量及胰岛素释放试验结果
治疗:阿卡波糖片100 mg每日3次餐中服用,格列美脲1 mg早餐及晚餐前口服,地特胰岛素28 U睡前1次皮下注射,辅酶Q10片20 mg每日3次口服,辅以多烯磷脂酰胆碱胶囊、碳酸氢钠片、依折麦布片、拉坦前列腺素滴眼液、丙戊酸钠缓释片、阿立哌唑治疗,4个月后电话随访,自述空腹血糖控制在8~9 mmol/L,餐后2 h血糖控制在10~12 mmol/L,较前好转。
1.2 先证者父母 进一步收集患者家系成员,先证者外祖母、外祖父已故,其父母接受相应调查,先证者母亲线粒体基因检测提示mtDNA16189T>C突变(变异比例100%);先证者父亲未检测到线粒体基因突变,该家系线粒体基因测序结果见表3、图2,基因检测由沈阳金域医学检验所检验完成。
1.2.1 先证者母亲 先证者母亲,49岁,2015年因急性脑梗死在中国医科大学附属第一医院神经内科住院时发现血糖升高,诊断为T2DM,予以阿卡波糖片、二甲双胍口服、门冬胰岛素注射液3餐前即刻皮下注射,地特胰岛素睡前皮下注射治疗,空腹血糖可控制在6 mmol/L,餐后2 h血糖可控制于10 mmol/L。2016年空腹血糖可达12~13 mmol/L,此后血糖控制不佳,又因近4年新发4次急性脑梗死反复就诊于中国医科大学附属第一医院神经内科及内分泌科,最后一次于2018年10月就诊于内分泌科。

表3 该家系2019年基因测序结果

既往高血压10余年,否认其他病史。3年前左眼视力减退、眼底出血,全视网膜激光光凝术后。
2015年12月2日因右侧顶叶急性脑梗死(ACI)于中国医科大学附属第一医院神经内科住院治疗;2015年12月30日因右半卵圆中心ACI于神经内科住院治疗;2016年3月16日患右顶叶ACI于神经内科住院治疗,2018年末次住院期间出现头晕走路不稳,诊断为右侧小脑ACI。
2018年体格检查:神清语明,身高164 cm,体重80 kg,体重指数31.25 kg/m2,血压146/86 mmHg。无颜面潮红、满月脸及多血质貌,甲状腺未触及,颈后无脂肪垫,四肢肌力V级,肌张力正常。眼科查体:双眼可见糖尿病视网膜病变,全视网膜激光光凝术后。
2018年实验室检查:HbA1c 7.40%;尿常规:蛋白(+),尿白蛋白/尿肌酐:347.83 mg/g;血脂分析:血清甘油三酯2.90 mmol/L,血清低密度脂蛋白-胆固醇3.86 mmol/L;稳态模型评估-胰岛素抵抗指数(HOMA-IR) 9.41,口服葡萄糖耐量试验及胰岛素释放试验结果见表4。
2018年辅助检查:肌电图:周围神经损害。颅脑核磁共振平扫+弥散成像见图3,提示右侧半卵圆中心、侧脑室周围、基底节区、左侧小脑半球多发斑点片状长T2信号影,脑内多发腔梗缺血灶及小软化灶,右侧小脑半球近期腔梗死、小缺血灶,诊断右侧小脑ACI。磁共振提示脑内最大缺血灶直径小于1.5 cm,符合缺血性脑卒中TOAST分型中的小动脉闭塞性卒中或腔隙性卒中(SAO)诊断标准[1]。
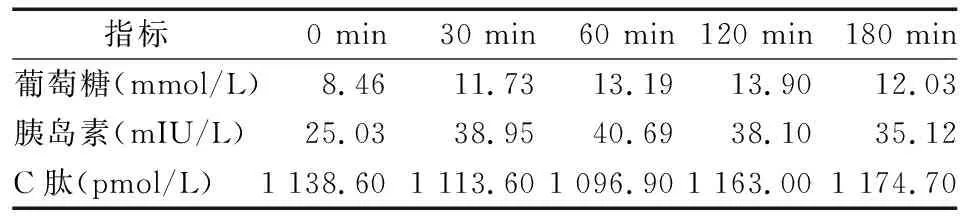
表4 先证者母亲2018年10月口服葡萄糖耐量试验及胰岛素释放试验

诊断:合并线粒体基因突变的T2DM、糖尿病周围神经病变、糖尿病视网膜病变(全视网膜激光光凝术后)、糖尿病肾病(临床蛋白尿期)、高甘油三酯血症、高血压3级(很高危)、多发腔隙性脑梗死。
治疗:达格列净10 mg早餐前口服,门冬胰岛素30注射液早晚各20 U餐前皮下注射,辅以甲钴胺分散片、木丹颗粒、阿司匹林肠溶片、阿托伐他汀钙片治疗。
1.2.2 先证者父亲 先证者父亲,49岁,因“发现血糖升高1年”于2017年2月就诊于中国医科大学附属第一医院内分泌科门诊,治疗之前完善实验室检验:葡萄糖测定:0 min:5.71 mmol/L,30 min:12.21 mmol/L,60 min:13.95 mmol/L,120 min:13.09 mmol/L;HbA1c 5.3%;血脂分析:血清甘油三酯2.03 mmol/L;余血清尿酸、肝肾功能、尿常规未见异常。诊断“T2DM、高甘油三酯血症”,维格列汀50 mg,2次/d,口服,二甲双胍0.5 g,3次/d,口服治疗,降糖治疗后空腹血糖控制在6 mmol/L,餐后2 h血糖控制在8 mmol/L。
2 讨论
mtDNA16189T>C突变致T2DM的发病机制至今未明,16189位点位于mtDNA的D环高变区,包含H链的复制起点,在线粒体基因转录复制过程中起调控作用。有报道称结合在16189位点的线粒体单链DNA结合蛋白(mtSSB)可维持D环及mtDNA稳定,维持mtDNA含量[2]。研究发现,mtDNA 16189 T>C突变降低了mtSSB的结合亲和力,减少线粒体DNA含量[2-4]。另有报道称,mtDNA16189T>C转变可能会形成多胞嘧啶链,造成mtDNA复制缺陷及DNA复制速度减慢,使基因调控区重复序列的长度改变,造成呼吸链功能受损[5-6]。一方面阻碍ATP产生,进而影响胰岛素敏感组织的血糖摄取以及糖代谢,导致外周组织胰岛素抵抗,从而增加T2DM发病风险;另一方面导致氧化应激反应增加,应对氧化应激损伤的能力下降[7-9]。
本例先证者及其母亲均诊断为携带mtDNA16189T>C突变的T2DM。1998年Poulton等[10]首次提出mtDNA16189位核苷酸为C者HOMA-IR显著高于T者,mtDNA 16189 T>C突变与胰岛素抵抗有关,认为mtDNA 16189 T>C突变是糖尿病易感基因,在其他因素共同作用下(如家族史、体重指数或其他的糖尿病易感基因相互作用)可加重IR或促进胰岛β细胞功能衰竭,进一步导致糖尿病。随后国内外进行了大量研究得出结论认为mtDNA 16189 T>C突变与IR及T2DM有关[3,11-12]。更有研究发现,mtDNA16189T>C突变是HOMA-IR的独立危险因素(P=0.037)[13]。此外,体重指数明显增加,可使氧化应激状态恶化,影响线粒体代偿功能,促使携带mtDNA16189T>C突变的T2DM患者疾病进展[9,11]。本例先证者及其母亲体重指数明显增加。虽然大量研究证明mtDNA16189T>C突变与T2DM有关,但仍有争议。Chinnery等[14]荟萃分析提示,在高加索人T2DM发病与mtDNA16189T>C突变未见确切相关,多个研究数据显示亚洲人mtDNA16189T>C突变率高于高加索人,可以推测mtDNA16189T>C突变可能存在种族异质性,还需进行更大样本量、更多元因素的分析。
本例家系报道中,先证者及其母亲携带mtDNA 16189 T>C突变均合并有中枢神经系统损害。本例先证者患有BPD,尚无神经系统确切定位性病理基础。有报道称其发病机制与钙离子调节异常导致5-羟色胺能神经元超兴奋性有关[15]。近年Cataldo等[16]发现BPD患者额叶前部皮质内线粒体体积明显缩小,推测BPD患者存在线粒体功能损伤。多种线粒体基因突变如mtDNA3243A>G突变、mtDNA3644T>C突变、mtDNA5178A>C突变及mtDNA10398A>G突变可能与BPD有关[17-20],但mtDNA16189T>C突变是否可引起BPD在本例报道前鲜有报道,因此mtDNA16189T>C突变与BPD直接相关机制有待进一步探究。
本例先证者母亲4年前急性脑梗死,于神经内科住院期间初诊为T2DM,此后4年内共发作4次急性脑梗死。Liou等[21]对307例脑梗死患者和294例健康对照组筛查mtDNA16189T>C突变,并将脑梗死患者按TOAST分型分为4个亚组,发现脑梗死患者mtDNA16189T>C突变率高于健康对照者(P<0.05),脑梗死患者中SAO亚组突变率最高(P<0.05),提示mtDNA16189T>C突变对小血管的影响最为显著。本例先证者母亲脑内多发腔梗缺血灶及小软化灶,最大缺血灶直径小于1.5 cm,符合急性缺血性脑卒中TOAST分型中SAO的诊断标准。
合并mtDNA16189T>C突变的T2DM早期无特异性临床表现,误诊、漏诊率较高。本病区别于普通T2DM及经典线粒体tRNALeu(UUR)3243A→G突变所致糖尿病的特点有:T2DM首选二甲双胍类药物治疗后无血浆乳酸水平升高,经典线粒体tRNALeu(UUR)3243A→G突变所致糖尿病以胰岛功能不足为主,需要胰岛素治疗,而合并mtDNA16189T>C突变的T2DM以IR伴胰岛素相对不足为特点,并不必须使用胰岛素治疗,且如误用二甲双胍类药物治疗后血糖可以得到控制,但是其血乳酸水平会升高,此类伴有mtDNA16189T>C突变的T2DM治疗方案上可根据胰岛功能,采用其他种类药物如钠依赖的葡萄糖转运体-2抑制剂、二肽基肽酶Ⅳ抑制剂、胰高血糖素样肽-1受体激动剂及磺脲类等药物进行治疗。
综上所述,mtDNA16189T>C突变与T2DM、SAO有关,与BPD的关系仍需进一步临床观察与探究。合并mtDNA16189T>C突变的T2DM临床特点可有母系遗传史、神经性耳聋或听力下降等。因此临床上已确诊的T2DM患者中,如有母系遗传史、患有神经性耳聋或听力下降、服用二甲双胍后血乳酸水平升高,可进一步进行线粒体基因检测,并积极防治、筛查心脑血管疾病。

