基于新技术的糖尿病及其并发症动物模型研究进展
李媛 刘明明 张坚
中国医学科学院&北京协和医学院,微循环研究所,北京 100005
糖尿病是以血糖升高为主要临床特征的内分泌系统综合征,其病因和发病机制尚未完全阐明。糖尿病动物模型是研究糖尿病病因机制及防治策略的重要基础。啮齿类动物中,大、小鼠因其体型较小、遗传学背景明确及对实验条件反应一致,是目前糖尿病研究中应用最广泛的模型来源动物。本综述拟对传统和基于基因编辑和遗传育种新技术的糖尿病大、小鼠模型建模方法进行比较,并探讨其在基础医学、临床医学和转化医学领域中的应用进展。
1 经典糖尿病及并发症动物模型
经典糖尿病模型常采用链脲佐菌素(STZ)、四氧嘧啶等胰岛β细胞毒性药物和特殊饮食诱导。STZ可通过β细胞表面葡萄糖转运蛋白2进入胞内,引起DNA烷基化,激活多聚ADP-核糖基化,导致胞内NAD+和ATP耗竭,抑制β细胞功能;STZ还可使ATP去磷酸化增强,为黄嘌呤氧化酶提供底物,形成超氧自由基、过量过氧化氢(H2O2)和羟自由基,损伤β细胞。四氧嘧啶同属β细胞毒剂,通过氧化还原反应与细胞内谷胱甘肽生成超氧阴离子、H2O2和羟自由基,直接损伤β细胞。特殊饮食法多采用高糖高脂饲料诱发模型动物胰岛素抵抗。在特殊饮食基础上联合β细胞毒性药物诱导,可使模型动物在胰岛素抵抗基础上出现β细胞损伤。
与糖尿病分型一致,用于糖尿病研究的动物模型主要分为1型糖尿病、2型糖尿病等。单次大剂量或多次小剂量腹腔注射β细胞毒剂可引起β细胞广泛破坏,激活胰岛免疫应答,与1型糖尿病发病机制相似,是目前应用最广泛的1型糖尿病模型构建方法。采用特殊饮食诱导辅以小剂量β细胞毒剂,可使模型动物表现出糖尿病典型表型及超重、高血脂、高胰岛素血症和胰岛素抵抗等特征,是较为常用的2型糖尿病模型建立方法。
此外,尚有学者通过其他方法制备糖尿病动物模型(如应用柯萨奇B病毒感染小鼠致胰岛细胞炎性反应及β细胞坏死,诱导1型糖尿病动物模型[1];采用高脂饮食联合低剂量地塞米松,抑制胰岛素与受体结合,影响葡萄糖摄取和利用,建立2型糖尿病模型[2])。因糖尿病发病机制的复杂性和β细胞毒性药物介导的多脏器非特异性受累,上述糖尿病及其并发症大、小鼠传统模型并不能完全复现人类疾病进程(表1、2),具有部分局限性[3-14]。
2 基因编辑技术建立的糖尿病动物模型
近年来,基于ZFN、TALEN、CRISPR-Cas9等遗传工程和基因编辑技术,对糖代谢相关基因的结构或组成进行修饰改造,并通过育种技术使编辑后的基因组传递给子代,引起子代动物出现糖尿病典型表现,为糖尿病研究提供了动物模型更优选择。
目前,用于基因编辑技术的靶基因主要包括胰岛素受体(IR)、胰岛素底物受体1(IRS-1)、胰岛素样生长因子1受体(IGF-1R)及葡萄糖转运蛋白-4(GLUT-4)等。IR基因缺失纯合子(IR-/-)小鼠出生后即出现轻度胰岛素抵抗伴β细胞增生,IR+/-/IRS-1+/-双基因敲除的杂合体小鼠可发生显性糖尿病,伴有高胰岛素血症和胰岛β细胞增生,存在明显胰岛素抵抗。GK-/-小鼠为非肥胖l型糖尿病模型动物,与具有胰岛素抵抗表型的IRS-1-/-小鼠杂交,其后代可表现为胰岛素分泌异常[15]。敲除IGF-1R基因的纯合子(IGF-1R-/-)小鼠短期内可出现胰岛素抵抗。MKR小鼠IGF-1R杂交型受体的形成导致其胰岛素受体功能异常,表现为显著胰岛素抵抗、高血糖、β细胞功能紊乱及脂代谢紊乱[16]。GLUT-4基因缺失的小鼠表现出明显胰岛素抵抗和高血糖。上述利用遗传育种和基因编辑新技术建立的糖尿病动物模型具有良好的遗传稳定性,同时在一定程度上弥补了经典糖尿病建模方法在模型诱导机制和糖尿病表型特异性方面的缺陷。
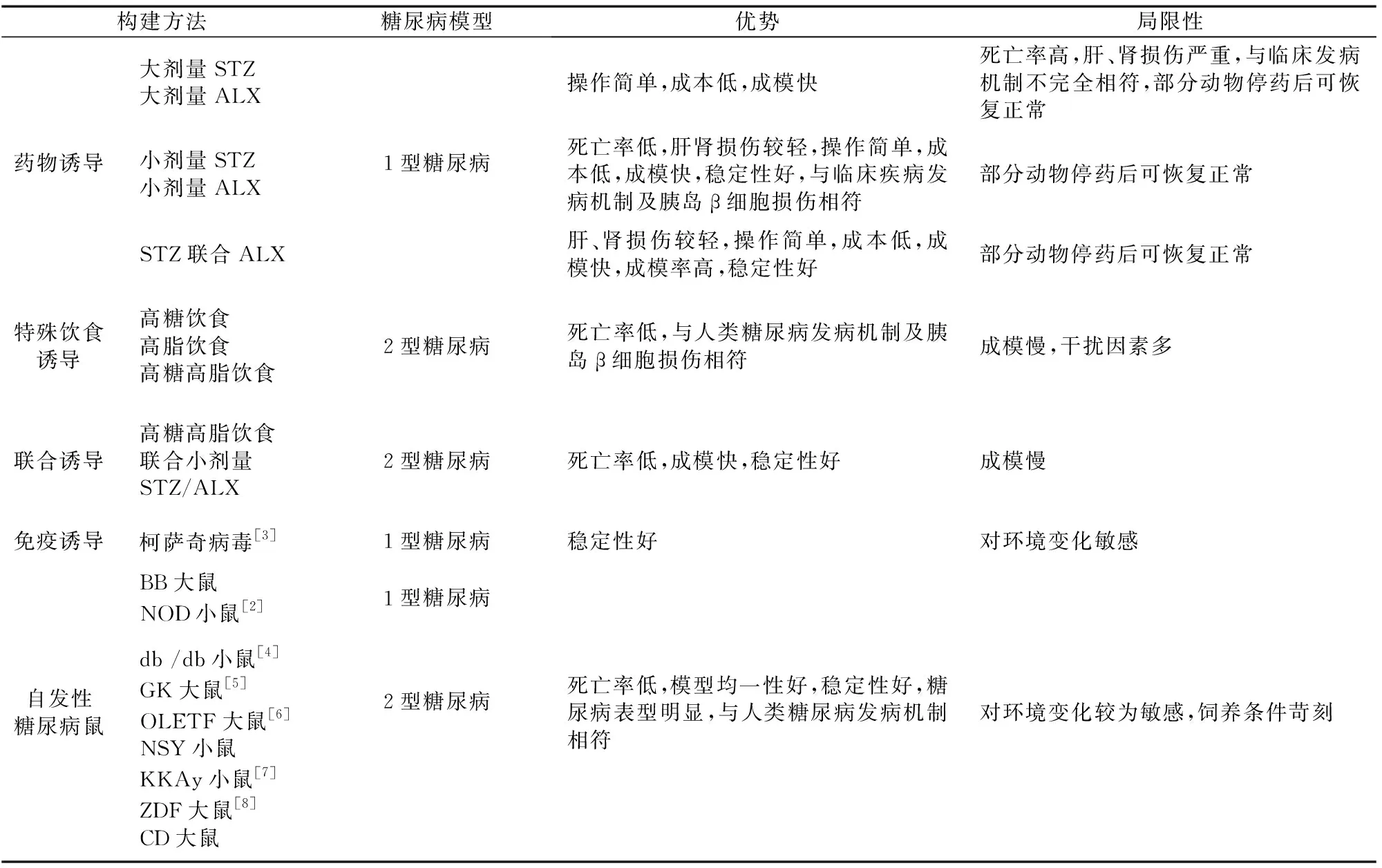
表1 糖尿病大、小鼠模型构建方法及特点

表2 糖尿病并发症模型构建方法及特点
3 基于新技术的糖尿病及并发症动物模型应用
早时项胰岛素分泌不足是人类2型糖尿病早期重要临床表现。在诱发型糖尿病动物模型中,现有2型糖尿病动物模型较少能复现早期胰岛β细胞功能受损的病理表型,有学者应用每3 d注射30 mg/kg STZ联合高脂饮食改良了经典2型糖尿病动物模型的诱导方法,使其更适合研究人类2型糖尿病的病因学和疾病进程[17]。此外,STZ诱导剂量具有周龄依赖性,选择周龄适配的STZ诱导剂量有助于提高糖尿病模型稳定性[18]。
在自发性糖尿病动物模型中,BTBR ob/ob糖尿病小鼠模型早期即可产生视网膜炎性反应和功能受损,随着疾病进展出现视网膜血管改变,故其较其他2型糖尿病动物模型更适合糖尿病视网膜病变的研究[9]。SDT(spontaneously diabetic Torii)肥胖大鼠经1/2肾切除术后,可出现残肾功能受损等慢性肾病表现,故适于作为糖尿病肾病早期发病研究的动物模型[12]。KK-Ay/Ta小鼠予20%酪蛋白饮食后,其尿酸、葡萄糖和甘油三酯水平显著升高,适合用于研究高尿酸血症与胰岛素抵抗间的内在联系[19]。胰岛素分泌过少(insulin hyposecretion,IHS)小鼠存在非炎性β细胞体积减小,表现为非肥胖自发性糖尿病,适用于探索胰岛素分泌缺陷未知基因[20]。此外,SDT肥胖大鼠存在脑萎缩和认知功能损害,并表现出抑郁样行为[21],同时存在周围神经病变[22]和中枢神经紊乱,可用于糖尿病与帕金森病、阿尔茨海默病或抑郁症等神经退行性疾病关系的研究[14]。
基因编辑技术弥补了传统建模方法的局限性。传统化学诱导1型糖尿病动物模型仅能复制血糖升高表型,未能复现自身免疫病因和疾病演变进程,而通过人HLA-A*02:01/HLA-DQ8双转基因和遗传育种技术获得的MHC Ⅰ类、MHC Ⅱ类和胰岛素基因缺乏的YES小鼠可复现人类1型糖尿病的自身免疫进程[23]。MKR小鼠因骨骼肌胰岛素信号通路受损,可同时出现骨骼肌、脂肪组织和肝组织胰岛素抵抗,伴高脂血症和脂质堆积,与人类2型糖尿病脂肪代谢障碍的病理机制相似[10]。GK/IRS-1双基因敲除小鼠可表现为糖耐量减退、肝细胞和β细胞葡萄糖敏感性下降,与人类2型糖尿病症状相似[15]。腺病毒DJ/8靶向敲除肝脏低密度脂蛋白受体(IDOL-AAV-DJ/8)的BTBR Lepob小鼠可同时表现糖尿病肾病和动脉粥样硬化的病理表型,适用于研究糖尿病肾病和动脉粥样硬化治疗策略[24]。10~14周龄Tally-Ho小鼠存在中度高胰岛素血症、高脂血症和肥胖,更适合迟发型2型糖尿病的研究[25]。FATZO小鼠予高脂饮食后可出现高血糖和高胆固醇血症,肝组织出现脂肪变性、小叶炎性反应、气球样变和纤维化等病理改变,适用于研究糖尿病合并非酒精性脂肪性肝病[26]。E3L.GK+/-小鼠予高脂饮食喂养后,空腹血糖、胆固醇和甘油三酯水平显著升高,发生严重动脉粥样硬化,故E3L.GK+/-小鼠是研究糖尿病合并动脉粥样硬化的理想动物模型[27]。TspocKO(Nr5a1-Cre+/-,Tspofl/fl)小鼠因肾上腺素升高导致肝葡萄糖生成增加,表现为持续高血糖,同时,该模型动物对促肾上腺皮质激素缺乏反应,可作为研究糖尿病与应激压力的模型选择[28]。
上述糖尿病传统动物模型改良、遗传育种技术和新的基因编辑建立的糖尿病动物模型为深入研究糖尿病及其并发症的发病机制,进一步阐明遗传、环境和免疫因素在糖尿病发病机制中的作用提供了较为理想的实验动物工具。同时,有助于糖尿病及其并发症的预防和早期干预研究及新的糖尿病治疗药物的研发。
4 结语和展望
糖尿病及其并发症动物模型作为人类代谢疾病的模拟工具广泛应用于相关基础研究。因种属差异性,目前仍缺乏可完全模拟和复现人类糖尿病及其并发症疾病进程的动物模型。传统模型构建方法存在诸多弊端,如缺乏统一模型建立和成模判断标准、仅能复现人类糖尿病及并发症部分表型等,故具有部分局限性。基于基因编辑和遗传育种新技术构建的糖尿病及其并发症动物模型,在一定程度上弥补了传统方法的缺陷,更符合糖尿病及其并发症的疾病进程机制。依据不同研究目的,选择适合的糖尿病及其并发症动物模型是研究结果可靠性和研究结论准确性的重要保障,是进一步阐明糖尿病及其并发症发病机制的重要基础,同时也是筛选新的糖尿病治疗药物的必要条件。

