急性Stanford A 型主动脉夹层术后新发脑梗死的危险因素分析
赵宏亮 徐子良 郑敏文
急性Stanford A 型主动脉夹层(acute type A aortic dissection,ATAAD)病情凶险,是严重危及生命的急性心血管疾病之一[1]。该疾病病死率高,目前最有效的治疗方案是外科手术[2]。术后脑梗死是ATAAD 常见并发症之一,其会导致患者住院时间延长,增加医疗费用,同时也是术后致残致死的危险因素之一[3]。
ATAAD 术前脑灌注不良通常预示着不良的结局[4],但在实际的工作中,无脑灌注不良的ATAAD患者术后也会频繁出现脑梗死。因此,本研究将回顾性分析经外科手术治疗且术前无脑灌注不良的ATAAD 患者的临床资料及术前CT 血管成像(computed tomography angiography,CTA)影像资料,并从中寻找出与术后新发脑梗死相关的危险因素,为临床早期诊断及干预提供依据。
资料与方法
1.一般资料
回顾性收集2015 年1 月~2019 年2 月,经临床确诊且无脑灌注不良的ATAAD 患者132 例,患者均行主动脉全弓置换术。以术后14 d 内有无新发脑梗死分将患者分为Stroke(+)组及Strkoe(-)组,记录所有患者与术后新发脑梗死相关的影响因素(病史资料、临床资料、影像资料及术中资料)。
ATAAD 的定义为任何累及主动脉近段至左锁骨下动脉的非外伤性夹层且症状出现时间小于2 周[2];脑灌注不良定义为CTA诊断夹层累及颈动脉且患者伴有新发的神经症状[5];术后新发脑梗死定义为主动脉外科术后患者出现新发的神经症状并颅脑CTA 显示低密度梗死灶[6]。术前低血压:动脉收缩压小于12.0 kPa(90 mmHg)或需要血管活性药物维持血压水平。
2.主动脉CTA 扫描方法
采用西门子双源CT(Definition Flash,Siemens Healthcare,Forchheim,Germany)进行扫描,扫描范围:从颅底平面~耻骨联合水平。增强扫描采用前瞻性心电门控大螺距扫描,以5.0 ml/s 的流率,肘前静脉注入60~70 ml 非离子对比剂碘普罗胺注射液370 mg I/ml(Ultravist 370,370 mg I/ml,Bayer Schering Pharma),之后追加20~50 ml 生理盐水。应用对比剂跟踪法(bolus-tracking),在左心房内选择兴趣区监测CT 值,当兴趣区内CT 值达到100 HU 时,延迟11 s 自动触发扫描。扫描和重组参数:100 kV,110 mAs,自动毫安控制技术(CARE Dose 4D,Siemens),螺距3.2,准直2×64×0.6 mm,重组层厚1.0 mm,重组间隔0.8 mm.
3.临床观察指标
记录患者的性别、年龄、体重、血压、心功能指数、吸烟史、高血压史、脑梗死史以及主动脉疾病手术史等相关病史信息。记录患者的左心室射血分数;心包积液记录术中体外循环时间、升主动脉阻断时间、深低温停循环时间以及手术方式等相关临床及手术信息。
4.可能与术后新发Stroke 相关的CTA 征象及定义
患者术前CTA 影响资料由两位高年资心血管CT 诊断医师详细分析。CTA 征象中可能与术后新发脑梗死相关的有:(1)升主动脉管径:升主动脉最大层面管腔直径(mm);(2)升主动脉真腔比:升主动脉真腔最窄平面直径与升主动脉管腔直径之比;(3)升主动脉假腔内血栓:肉眼可见的升主动脉假腔内密度低,CT 值小于200 HU;(4)升主动脉内膜片粥样斑块:升主动脉至主动脉弓内膜片可见粥样硬化斑块;(5)升主动脉逆行撕裂:主动脉弓或主动脉原发内膜片撕裂,并以逆行方式延伸向升主动脉;(6)破口大小:轴位或斜矢状位图像的最大直径;(7)颈动脉夹层或颈动脉起自假腔;(8)一侧颈内动脉血管密度减低:一侧颈内动脉或椎动脉密度肉眼观察低于对侧。
5.统计学方法
采用SPSS 17.0 统计学软件进行分析。计数资料采用例数(百分比)描述,组间比较采用卡方检验或Fisher 精确检验。计量资料采用均值±标准差或中位数(四分位数)描述,组间比较采用双样本t检验或秩和检验。将单因素分析中有统计学差异的因素引入Logistic 回归分析模型进行多因素分析,以多因素分析中有统计学差异的因素为术后新发脑梗死相关的危险因素。以P<0.05 为差异有统计学意义。
结 果
患者一般资料:132 例ATAAD 患者中,14.4%(19/174 例)的患者术后出现新发脑梗死。Stroke(+)组患者的低血压发生率高于对照组(26.3%比4.4%,P=0.004);总手术时间(256.8±55.2 比212.0±30.1,P=0.003)及升主动脉阻断时间(113.1±35.3比95.6±19.1,P=0.003)较对照组显著延长;其余临床因素两组比较无统计学意义(表1)。
患者术前CTA 征象:Stroke(+)组升主动脉逆行撕裂(26.3%比7.1%,P=0.022)、升主动脉及主动脉弓部均有破口(57.9%比27.4%,P=0.015)的发生率均高于Stroke(-)组。其余变量两组比较均无统计学差异(表2)。Logistic 回归多因素中:升主动脉逆行撕裂(OR=12.553,P=0.003)(图1)、升主动脉及主动脉弓部均有破口(OR=5.499,P=0.020)(图2)、总手术时间(OR=1.019,P=0.024)及低血压(OR=10.173,P=0.023)是无脑灌注不良的ATAAD患者术后新发脑梗死的独立危险因素(表3)。
讨 论
术后脑梗死是ATAAD 的一种非常严重并发症。术后脑梗死与院内死亡率、延长的住院时间及永久性的神经损伤有关[3]。为防止术前脑灌注不良患者干扰术后脑梗死结果,本研究仅纳入术前无脑灌注不良的ATAAD 患者作为研究对象,本研究的术后脑梗死发生率为14.4%,而GERAADA[7]多中心研究结果显示术前无神经系统并发症的ATAAD 患者术后出现神经系统并发症的发生率为7.7%。本研究结果高于文献,可能是与术后神经系统并发症的纳入标准不同有关。
在本研究中,术前低血压是ATAAD 术后Stroke(+)组独立危险因素。当ATAAD 患者出现低血压时,血流量的减少可能引起颈部动脉分支血管缺血,从而导致大脑半球缺血。而手术需要深低温停循环,ATAAD 患者的大脑半球缺血可能会雪上加霜。故建议,如果患者术前血压过低,术中应尽量采取选择性双侧脑保护措施。低血压患者的脑梗死灶多为双侧[8],且分布于分水岭区,也说明梗死的发生可能与低灌注缺血有关。本研究另一个独立危险因素是总手术时间延长,这个结果并不意外,因为早期有文献报道[7,9-12],较长的手术时间预示着较长的脑保护时间,将增加术中颅脑缺氧的机会[13]。
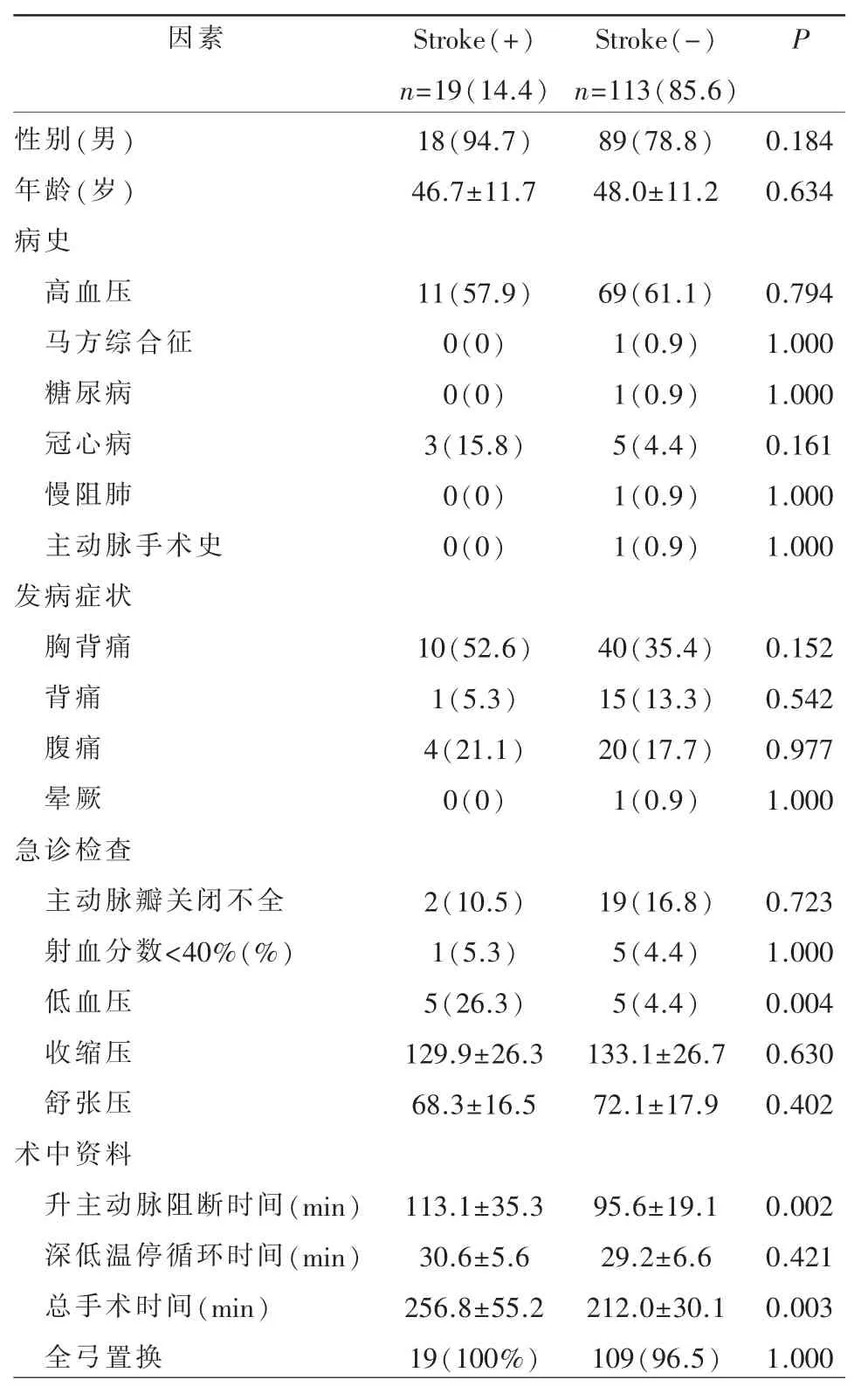
表1 Stroke(+)组和Stroke(-)组一般资料比较

表2 Stroke(+)组和Stroke(-)组CTA 影像资料对比

表3 多因素分析结果

图1 升主动脉及弓部均可见内膜片中断(破口,箭)图2 主动脉弓内膜片累及升主动脉,升主动脉假腔内血栓(箭)
升主动脉逆行撕裂及主动脉弓部破口是术后脑梗死的独立危险因素。逆行撕裂的升主动脉假腔内多存在血栓,而主动脉弓部破口可能增加栓子通过破口上行的机会,从而阻塞颅脑动脉,形成栓塞型脑梗死。CTA 影像显示,该类梗死灶多位于皮层或皮层下,梗死灶多发且面积较大。对于这类患者,术中操作中更应避免栓子脱落。ATAAD 术后脑梗死的发生与栓子脱落或缺血有关,如术前可以找到栓子高风险的证据,将有利于临床提前干预及预防。CTA 是主动脉夹层确诊的首选检查手段[14],适用于病变范围广且需要快速检查的急诊患者,CTA 对于主动脉夹层累及情况、血栓及粥样斑块的识别均有较高的敏感性[15]。
本研究是回顾性分析,存在选择性偏倚;数据来自单中心且术后新发中风样本量偏少。因此,下一步的研究将使用多中心大样本数据集来验证及确定ATAAD 术后新发脑梗死的危险因素。
综上所述,对于ATAAD 患者,术前使用CTA造影评估与术后新发脑梗死的相关特征,并在术中严格监护及控制手术时间,对避免不可逆脑损伤具有重要意义。