木犀草素对人舌鳞状细胞癌Tca8113细胞凋亡及自噬的影响*
龚永媚,房子倩,徐昊,黄建华,黄克强
(1.锦州医科大学附属第二医院 正畸科,辽宁 锦州 121004;2.锦州医科大学附属第一医院 外科学重点实验室,辽宁 锦州 121000)
据相关文献报道,尽管全球口腔癌的发病率呈下降趋势,但舌癌的发病率却在增加,其在口腔肿瘤中排名第1 位[1]。目前,手术为医治舌部肿瘤的关键方法,并辅助其他治疗手段。但是患者声带被手术破坏,可能使其遭受身体和心理双重的打击[2]。积极寻找安全、副作用小,乃至无副作用的天然药物,对舌癌的治疗显得十分必要。
木犀草素存于诸多类型的植物中,是一种很重要的天然药物,在体内外均有很有效的抗癌作用[3]。可作为抗各种类型人类恶性肿瘤的抗癌剂,如肺癌[4]、乳腺癌[5]及黑色素瘤[6]。已有实验表明,舌癌细胞系Tca8113 的凋亡可由木犀草素的作用而发生,但是如何发生凋亡,内在的机理尚未完全研究明确[7]。本文探索木犀草素对Tca8113 细胞凋亡和自噬的影响进行研究。
1 材料与方法
1.1 材料与仪器
木犀草素规格:1G(药物浓度≥98%),分子式:C15H10O6,摩尔质量:286.24,识别码:491-70-3。Tca8113 细胞株购于中国科学院上海细胞库,FBS(GIBCO)购于美国Invitrogen 公司,RPMI 1640细胞培养基购于北京索莱宝生物科技有限公司,MTT溶液购于美国Sigma 公司,兔抗人Bcl-2/Bax/Cleaved Caspase-3 及β-actin 单抗,以及P62、Beclin1 购于沈阳万类生物科技有限公司,LC3B 购于美国CST 公司,HRP-labeled Goat Anti-Rabbit IgG(H+L)抗体购于上海碧云天生物技术有限公司,Annexin V-FITC 凋亡试剂盒购于北京四正柏生物科技有限公司,木犀草素购于南京景竹生物科技有限公司。
美国BD 公司(Verse)流式细胞检测仪,美国Thermo 公司Multiskan FC 酶标仪和Proteinsimple 9自动凝胶成像仪,德国BIO-RAD 公司电泳仪,德国LEICA 公司DMILLED 倒置显微镜。
1.2 方法
1.2.1 舌癌细胞培养RPMI 1640 培养基培养Tca8113 细胞,置于37℃、5%二氧化碳环境中。每天查看细胞生长情况,培养基营养不足时及时更换,待培养皿内细胞生长约90%,并且细胞状态良好,即可传代。
1.2.2 MTT 法检测细胞增殖取Tca8113 细胞(8×104个/孔)接种于96 孔板中,过夜。分别加入12.5、25.0、50.0 及100.0μmol/L 木犀草素,并设空白对照组。24 h 后,现配20μl MTT 溶液加入孔中,4 h 后取针头抽上清,将150μl DMSO 加入其中,轻轻用手敲板四侧,使其混匀;用酶标仪测570 nm 波长处的光密度(optical density, OD)值。抑制率(%)=(1-加药细胞组OD 值/未加药细胞组OD 值)×100%。
1.2.3 Hoechst33342 检测药物对细胞凋亡的影响取Tca8113 细胞(5×105个/孔),接种于直径为20 mm的12 孔板中。细胞在培养皿底延伸开,晃动培养基细胞不动时,每孔加木犀草素47μmol/L,设2 个复孔,分别于6、12 及24 h 后,加入染色液作用30 min,PBS 轻轻清洗3 次,镜下观察实验的变化情况,记录实时实验数据。
1.2.4 流式细胞术检测细胞凋亡接种2×105个/孔Tca8113 细胞,然后均匀铺在3 个100 mm 大培养皿中,孵育48 h,每孔加入木犀草素47μmol/L,分别作用12、24 h 后,收集细胞在10 ml 离心管中。加入Annexin V/FITC 和PI,操作时按照说明书进行。为确保实验准确性,流式细胞仪检测需要在1 h 内进行。
1.2.5 Western blotting 检测凋亡相关蛋白配制浓度为47μmol/L 的药液,加入培养Tca8113 细胞的大培养皿中,按照1、3、6、12 及24 h 时间点收集细胞(同时设定不加药组作为对照组)。按照说明书中操作方法提取细胞总蛋白,并测定蛋白浓度后制样,然后按序进行电泳、转膜,2%封闭液封闭90 min;孵上相应一抗。4℃冰箱,摇床过夜。将制好的二抗完全覆盖住PVDF 膜,孵育1 h。用高敏ECL 化学发光试剂检测。
1.3 统计学方法
数据分析采用SPSS 22.00 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 木犀草素抑制Tca8113 细胞增殖
不同浓度木犀草素处理Tca8113 细胞。24 h 后细胞增殖抑制率分别为(4.76±0.46)%、(33.91±2.88)%、(48.61±2.81)%和(71.67±1.78)%,经方差分析,差异有统计学意义(F=6.412,P=0.000),进一步两两比较,差异有统计学意义(P<0.05)。细胞抑制率随着浓度的增大而增高。IC50 为47μmol/L。见图1。

图1 不同浓度的木犀草素对Tca8113 细胞增殖的影响
2.2 木犀草素对Tca8113 细胞凋亡的影响
Hoechst33342 染色后,在荧光显微镜下可见,未加药组对照组细胞生长形状规则,染色均匀,经47μmol/L 的木犀草素作用6、12 及24 h 后,随着时间的延长,细胞核的荧光亮度越高。见图2。
Annexin V/FITC 和PI 双染结果见图3。给药0、12 及24 h 后细胞凋亡率分别为(0.37±0.32)%、(9.51±0.56)%和(14.75±0.76)%,经方差分析,差异有统计学意义(F=478.915,P=0.005),与对照组比较,12 和24 h 细胞凋亡水平升高,24 h 细胞凋亡水平高于12 h(P<0.05)。
2.3 不同时间点Bax、Bcl-2 及Cleaved Caspase-3 蛋白相对表达量比较
Western bloting 结果显示,木犀草素作用Tca8113细胞1、3、6、12 及24 h 后,Bax、Bcl-2 及Cleaved Caspase-3 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),Bax、Cleaved Caspase-3 的表达量随时间的延长而增加;而Bcl-2 表达量随时间的延长而呈降低趋势。见表1和图4。

图2 不同时间点木犀草素对Tca8113 细胞凋亡的影响 (×200)

图3 流式细胞术检测木犀草素对Tca8113 细胞凋亡的影响
表1 不同时间点Bax、Bcl-2 及Cleaved Caspase-3 蛋白的相对表达量比较 (±s)

表1 不同时间点Bax、Bcl-2 及Cleaved Caspase-3 蛋白的相对表达量比较 (±s)
蛋白 对照组 1 h 3 h 6 h 12 h 24 h F 值 P 值Bax 0.84±0.08 1.02±0.07 1.09±0.05 1.35±0.09 1.73±0.02 2.06±0.03 146.414 0.000 Bcl-2 2.11±0.08 1.78±0.03 1.54±0.07 1.12±0.14 1.21±0.05 0.64±0.01 118.182 0.000 Cleaved Caspase-3 0.15±0.01 0.34±0.05 0.57±0.04 0.74±0.05 1.2±0.10 1.3±0.04 215.157 0.000
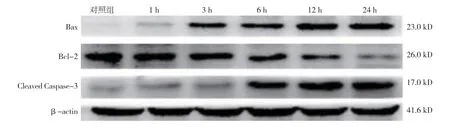
图4 木犀草素对Tca8113 细胞Bax、Bcl-2 及Cleaved Caspase-3 蛋白表达量的影响
2.4 自噬相关蛋白表达情况
Western bloting检测结果显示,木犀草素作用1、3、6、12 及24 h 后,Tca8113 细胞自噬P62、Beclin1 及LC3B 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),P62、Beclin1 及LC3B 蛋白水平随时间的延长而增加。见表2和图5。
表2 木犀草素作用1、3、6、12 及24 h 后Tca8113 细胞自噬P62、LC3B 及Beclin1 蛋白相对表达量比较 (±s)
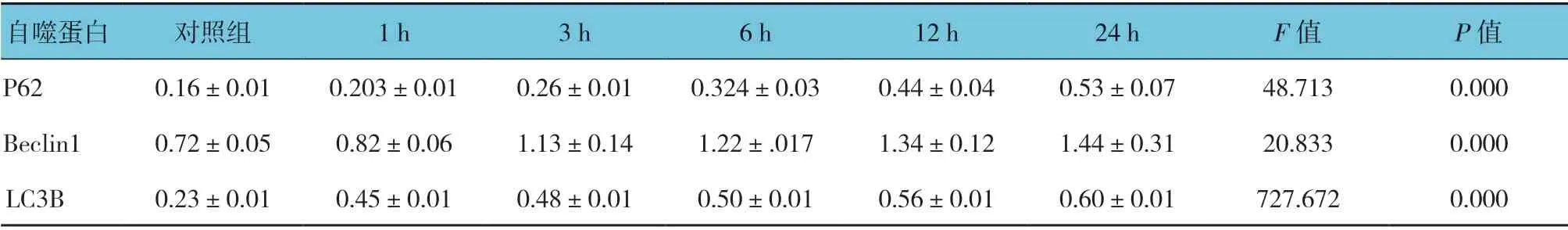
表2 木犀草素作用1、3、6、12 及24 h 后Tca8113 细胞自噬P62、LC3B 及Beclin1 蛋白相对表达量比较 (±s)
自噬蛋白 对照组 1 h 3 h 6 h 12 h 24 h F 值 P 值P62 0.16±0.01 0.203±0.01 0.26±0.01 0.324±0.03 0.44±0.04 0.53±0.07 48.713 0.000 Beclin1 0.72±0.05 0.82±0.06 1.13±0.14 1.22±.017 1.34±0.12 1.44±0.31 20.833 0.000 LC3B 0.23±0.01 0.45±0.01 0.48±0.01 0.50±0.01 0.56±0.01 0.60±0.01 727.672 0.000

图5 木犀草素对Tca8113 细胞自噬P62、LC3B 及Beclin1 蛋白表达量的影响
3 讨论
通过纯化工艺可以从多种植物中提取木犀草素。目前从植物中提纯的木犀草素应用于临床治疗各种疾病,例如炎性疾病、高血压及各种肿瘤疾病。木犀草素可抑制肿瘤细胞的增殖,通过不同的信号传导途径诱导细胞凋亡来阻断体外和体内的癌症发展[8-11]。有研究指出,木犀草素会影响舌癌细胞的活性,进而促进癌细胞的凋亡和转移等[7],但木犀草素抑制癌细胞的具体机制尚不清楚。
细胞凋亡和自噬是细胞程序性死亡的两种形式。癌症发生的标志正是凋亡细胞死亡机制的失控[12]。影响凋亡的关键蛋白酶家族为Caspase。调节并控制凋亡最主要癌基因之一是Bcl-2,这是一条内在调节途径,而Bcl-2基因正是门户开关,癌细胞凋亡受到限制是因为蛋白出现过多;内在途径程序开启后,也使Bax 蛋白启动,MOMP 受到破坏,细胞色素C 释放到细胞质中,下游的Caspase 被激活[13-14]。Caspase 对细胞凋亡机制有十分重要的影响,其包括启动子和终止子,其中最核心的是Caspase-3 蛋白。Caspase 作为启动子通过自身蛋白水分解自动启动,切断终止子Caspase,终止子Caspase 对特定细胞参与生物化学反应的物质进行临界裂解,最终导致凋亡细胞死亡激活Caspase-9[15]。本实验通过Image J 软件得出蛋白量值,结果显示木犀草素作用Tca8113 细胞后,Bcl-2蛋白水平下降,Cleaved Caspase-3 与Bax 蛋白水平提高,表明木犀草素对舌癌Tca8113 细胞的凋亡作用可以通过Bcl-2、Bax 及Cleaved Caspase-3 的途径实现。
自噬是一种机制,通过该机制将细胞物质递送至溶酶体进行降解,从而允许细胞组分的基础更新并提供能量和大分子前体。然而在癌症中,其作用相反,并且依赖于环境,与肿瘤的产生和恶化密切相关,其自噬水平会升高,当外界的情况发生变化时,细胞提高自噬程度以更好地适应环境;而细胞凋亡就是自噬水平过度变化导致[16-17]。本实验检测LC3B、P62 及Beclin1 蛋白的表达量,探究其在细胞中是否发生了自噬[18-20]。LC3B 和Beclin1 蛋白表达量随自噬水平的升高而升高[21]。自噬降解通路受损时,提高P62 蛋白水平[22]。本研究发现,木犀草素增加LC3B、Beclin1及P62 蛋白表达水平,表明木犀草素可能激活细胞的自噬。
综上所述,木犀草素作为自然界天然物质,能够有效抑制舌癌Tca8113 体外活性,可通过提高Bcl-2、Cleaved Caspase-3 蛋白水平,降低Bax 蛋白水平,促进细胞的凋亡;同时伴有细胞自噬性死亡,表明木犀草素对舌癌有治疗作用。本实验为更深层次探索木犀草素对舌癌Tca8113 细胞的影响打下很好的基础。

