小檗碱抑制HCT116细胞在小鼠体内增殖的分子机制研究
(武汉理工大学医院 外科,湖北 武汉 430070)
小檗碱又称为黄连素,是传统中药黄连的主要有效成分之一,有研究发现小檗碱在治疗肿瘤方面具有独特的药理学活性[1],其对多种肿瘤细胞具有不同程度的抑制作用[2]。本研究在BALB/C 小鼠皮下种植人结肠癌HCT116 细胞,复制人结肠癌模型,选择小檗碱作为治疗药物,与常规化疗药物氟尿嘧啶相对照,探索不同剂量的小檗碱治疗结直肠癌的效应及其作用机制。
1 材料与方法
1.1 细胞培养
人结肠癌HCT116 细胞(美国模式培养物研究所)培养于10% GIBCO 胎牛血清、RPMI 1640 完全培养基(上海博升生物科技有限公司)中,于5%二氧化碳、37℃环境下培养,3 d 传代1 次。使用胰蛋白酶消化传代细胞,选取第2 代状态好且处于对数生长期的细胞,以1 500 r/min 离心5 min,收集细胞沉淀,用磷酸盐缓冲液(phosphate buffer saline, PBS)(北京索莱宝科技有限公司)重悬细胞,重复3 次,最后一次重悬细胞后细胞计数,使用PBS 稀释成5.0×106个/ml 的细胞悬液,使用台盼蓝染色法在显微镜下检测活细胞比率>95%。
1.2 肿瘤细胞存活率检测
按试剂盒要求配制MTT 溶液(北京索莱宝科技有限公司),浓度为5 mg/ml,设6 个剂量,每个剂量设3 个平行孔。每孔加入新鲜配制的含0.5 mg/ml MTT的无血清培养基100μl,37℃环境培养4 h 后弃上清液,每孔加入100μl MTT 显色液,570 nm 处波长测定吸光度值。肿瘤细胞抑制率(%)=(空白对照组吸光度值-给药组吸光度值)/空白对照组吸光度值×100%,按照中效方程计算半数抑制浓度。
1.3 动物实验
1.3.1 分组于扬州大学比较医学中心购买60 只10 周龄的BALB/C 雄性小鼠[生产许可证号:SCXK(苏)2014-2017,使用许可证号:321000600002258],体重24~26 g,饲养于SPF 级动物房,严格控制昼夜节律,小鼠可自由摄取食物和无菌饮用水,待小鼠适应环境之后,随机分为空白组(未接受模型复制及任何治疗)、模型组(仅接受模型复制,而不接受任何治疗)、对照组(接受模型复制及氟尿嘧啶治疗)及小檗碱低剂量组、小檗碱中剂量组和小檗碱高剂量组(接受模型复制及小檗碱治疗),每组10 只。
1.3.2 动物模型复制及给药治疗用微量注射器吸取HCT116 细胞悬液100μl,空白组以外的小鼠右前肢皮下注射;空白组小鼠在右前肢皮下注射100μl PBS,所有小鼠注射完成后正常饲养。
皮下模型复制第7 天后开始给药,将小檗碱(纯度≥98%,生产批号:211-195-9,上海信域生物技术有限公司)溶于DMSO 中,配制浓度为1、2 和4 mg/ml,小檗碱低、中、高剂量组按10 ml/kg 予以腹腔注射,对照组小鼠按20 mg/kg 腹腔注射氟尿嘧啶。空白组和模型组腹腔注射10 ml/kg 的生理盐水,给药1 次/d。每天定时记录小鼠体重变化和小鼠状态,连续注射14 d。在第21 天处死所有小鼠,期间记录各组小鼠存活状态。
1.4 检测指标
1.4.1 体重和存活率每7 天测量1 次小鼠体重,观察各组小鼠体重变化,绘制小鼠体重变化趋势图。同时记录各组小鼠死亡时间,绘制各组小鼠存活率曲线。
1.4.2 肿瘤大小记录空白组外的小鼠移植肿瘤大小,长径为a,短径为b,计算小鼠肿瘤体积,肿瘤体积=ab2/2。
1.4.3 药物抑瘤率称取小鼠皮下移植肿瘤重量,计算药物抑瘤率,抑瘤率=(模型组肿瘤重量-给药组肿瘤重量/模型组肿瘤重量)×100%。
1.4.4 mRNA、蛋白表达水平提取小鼠移植肿瘤RNA,采用qRT-PCR 法检测细胞凋亡相关mRNA 表达,如Caspase-9、Caspase-3。使用Western blotting检测细胞凋亡相关蛋白Caspase-9、Caspase-3 和Cytochrome C 的表达水平。
1.5 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步的两两比较用LSD-t检验;计数资料以率(%)表示,比较用χ2检验,进一步的两两比较用Bonferroni 法校正检验水准,P<0.05 为差异有统计学意义。
2 结果
2.1 小檗碱对结肠癌HCT116 细胞有抑制作用
小檗碱对结肠癌HCT116 细胞有抑制作用,其半数抑制浓度为(0.24±0.02)μmol/L。
2.2 小鼠体重变化情况
各组小鼠注射后的第1、7、14和21天的体重比较,采用重复测量设计的方差分析,结果如下:①不同时间点的小鼠体重比较,差异有统计学意义(F=14.593,P=0.001);②各组小鼠体重比较,差异有统计学意义(F=16.012,P=0.000);③各组小鼠体重的变化趋势比较,差异有统计学意义(F=10.384,P=0.004)。见表1和图1。
表1 各组小鼠体重比较 (n=10,g,±s)
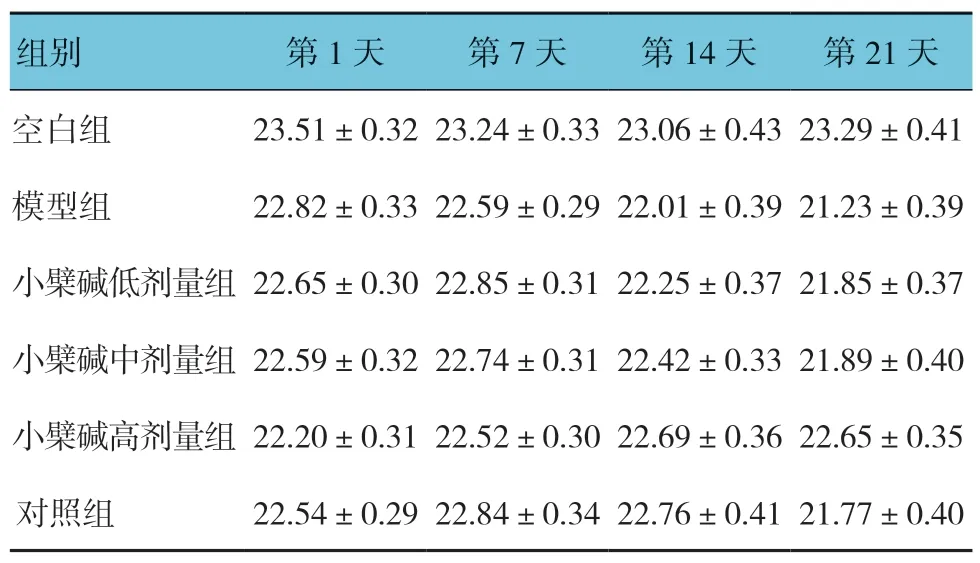
表1 各组小鼠体重比较 (n=10,g,±s)
组别 第1 天 第7 天 第14 天 第21 天空白组 23.51±0.32 23.24±0.33 23.06±0.43 23.29±0.41模型组 22.82±0.33 22.59±0.29 22.01±0.39 21.23±0.39小檗碱低剂量组22.65±0.30 22.85±0.31 22.25±0.37 21.85±0.37小檗碱中剂量组22.59±0.32 22.74±0.31 22.42±0.33 21.89±0.40小檗碱高剂量组22.20±0.31 22.52±0.30 22.69±0.36 22.65±0.35对照组 22.54±0.29 22.84±0.34 22.76±0.41 21.77±0.40

图1 各组小鼠体重变化趋势 (n=10,±s)
2.3 各组小鼠皮下肿瘤体积比较
各组小鼠肿瘤长径、短径和体积比较,差异有统计学意义(P<0.05),小檗碱低、中及高剂量组小鼠肿瘤长径、短径较模型组短,体积较模型组小。呈剂量依赖性改变,且剂量越大数值越小(P<0.05)。见表2。
表2 各组小鼠肿瘤长短径及体积比较(n=10,±s)
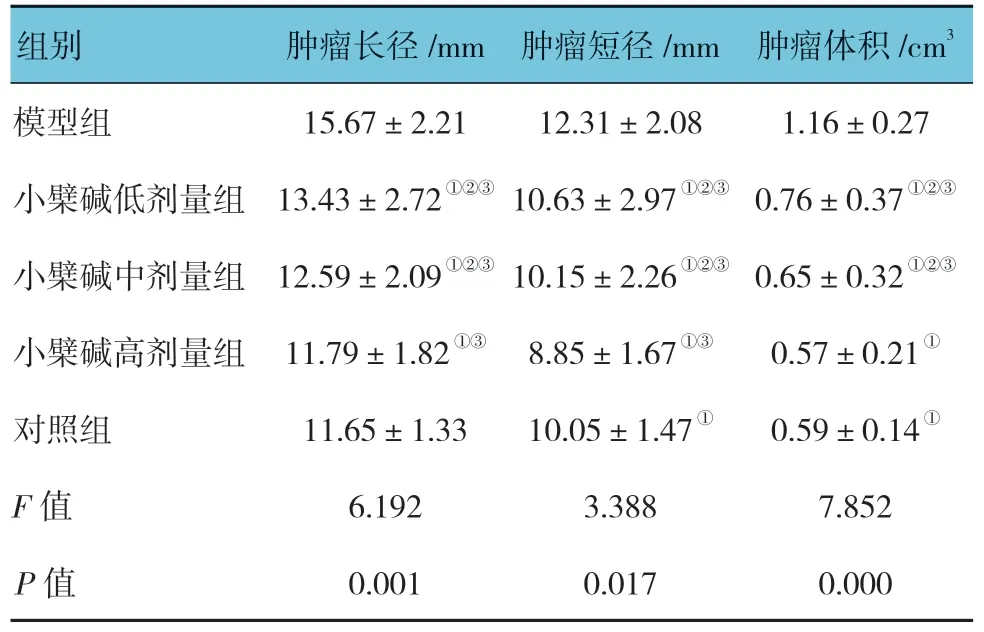
表2 各组小鼠肿瘤长短径及体积比较(n=10,±s)
注:①与模型组比较,P<0.05;②与小檗碱高剂量组比较,P<0.05;③与对照组比较,P<0.05。
组别 肿瘤长径/mm 肿瘤短径/mm 肿瘤体积/cm3模型组 15.67±2.21 12.31±2.08 1.16±0.27小檗碱低剂量组 13.43±2.72①②③10.63±2.97①②③ 0.76±0.37①②③小檗碱中剂量组 12.59±2.09①②③10.15±2.26①②③ 0.65±0.32①②③小檗碱高剂量组 11.79±1.82①③ 8.85±1.67①③ 0.57±0.21①对照组 11.65±1.33 10.05±1.47① 0.59±0.14①F 值 6.192 3.388 7.852 P 值 0.001 0.017 0.000
2.4 各组小鼠存活率比较
空白组小鼠存活率为100%,模型组小鼠为50%,小檗碱低剂量组小鼠为59%,小檗碱中剂量组小鼠为62%,小檗碱高剂量给药组小鼠为67%,对照组小鼠为66%,经χ2检验,差异有统计学意义(χ2=11.264,P=0.024)。进一步的两两比较,经Bonferroni 法校正检验水平,模型组低于空白组(P<0.05),小檗碱低、中和高剂量组、对照组较模型组高(P<0.05),且给药组小鼠存活率呈剂量依赖性改变。见图2。
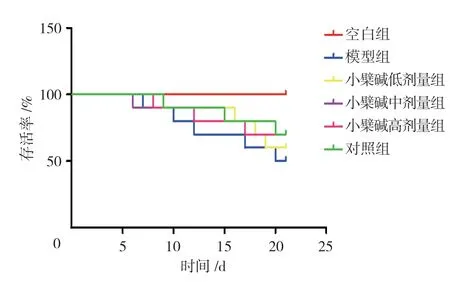
图2 各组小鼠存活率趋势 (n=10)
2.5 各组小鼠肿瘤重量和抑瘤率比较
各组小鼠肿瘤重量比较,差异有统计学意义(P<0.05),小檗碱低、中及高剂量组较模型组轻,且呈剂量依赖性。各组小鼠抑瘤率比较,差异有统计学意义(P<0.05),小檗碱低、中及高剂量组均具有较高的抑瘤率,小檗碱高剂量组较小檗碱低、中剂量剂量组高(P<0.05),对照组较小檗碱低、中剂量组高(P<0.05)。小檗碱高剂量组与对照组抑瘤率比较,差异无统计学意义(P>0.05),两组抑瘤率相近。见表3。
表3 各组小鼠肿瘤重量和抑瘤率比较 (n=10,±s)

表3 各组小鼠肿瘤重量和抑瘤率比较 (n=10,±s)
组别 肿瘤重量/g 抑瘤率/%模型组 3.24±1.04 -小檗碱低剂量组 2.93±1.67①②③ 34.26±3.67②③小檗碱中剂量组 2.32±1.39①②③ 43.83±4.29②③小檗碱高剂量组 1.45±1.42①③ 50.62±4.88对照组 1.75±1.37① 49.08±4.63 F 值 2.964 28.305 P 值 0.030 0.000
2.6 各组小鼠肿瘤组织Caspase-9、Caspase-3 mRNA 的相对表达量比较
各组小鼠肿瘤组织Caspase-9、Caspase-3 mRNA的相对表达量比较,差异有统计学意义(P<0.05),小檗碱低、中及高剂量组较模型组高。对照组与模型组肿瘤组织Caspase-9、Caspase-3 mRNA 的相对表达量比较,差异无统计学意义(P>0.05)。见表4和图3。
表4 各组小鼠肿瘤组织Caspase-9、Caspase-3 mRNA的相对表达量比较 (n=10,±s)

表4 各组小鼠肿瘤组织Caspase-9、Caspase-3 mRNA的相对表达量比较 (n=10,±s)
注:①与模型组比较,P<0.05;②与小檗碱高剂量组比较,P<0.05;③与对照组比较,P<0.05。
?
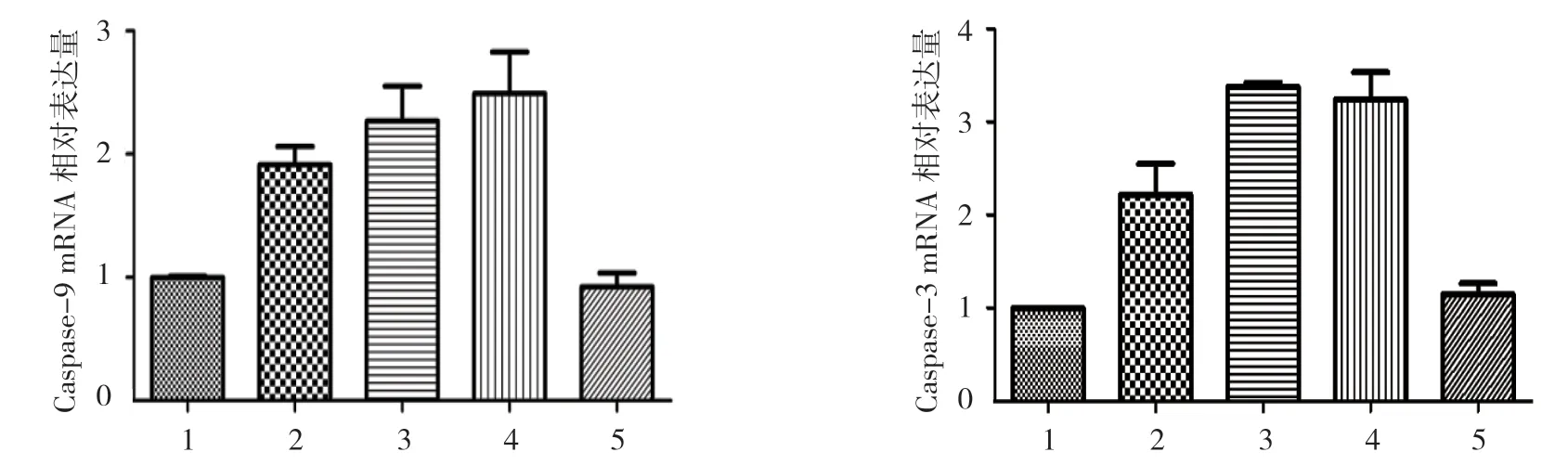
图3 各组小鼠肿瘤组织Caspase-9、Caspase-3 mRNA 的相对表达量比较 (n=10,±s)
2.7 各组小鼠肿瘤组织Cytochrome C、Caspase-9及Caspase-3 蛋白相对表达量比较
各组小鼠肿瘤组织Cytochrome C、Caspase-9 及Caspase-3 蛋白相对表达量比较,差异有统计学意义(P<0.05),小檗碱低、中及高剂量组较模型组高。对照组与模型组肿瘤组织Cytochrome C、Caspase-9 及Caspase-3 蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表5和图4、5。
表5 各组小鼠肿瘤组织Cytochrome C、Caspase-9 及Caspase-3 蛋白相对表达量比较 (n=10,±s)
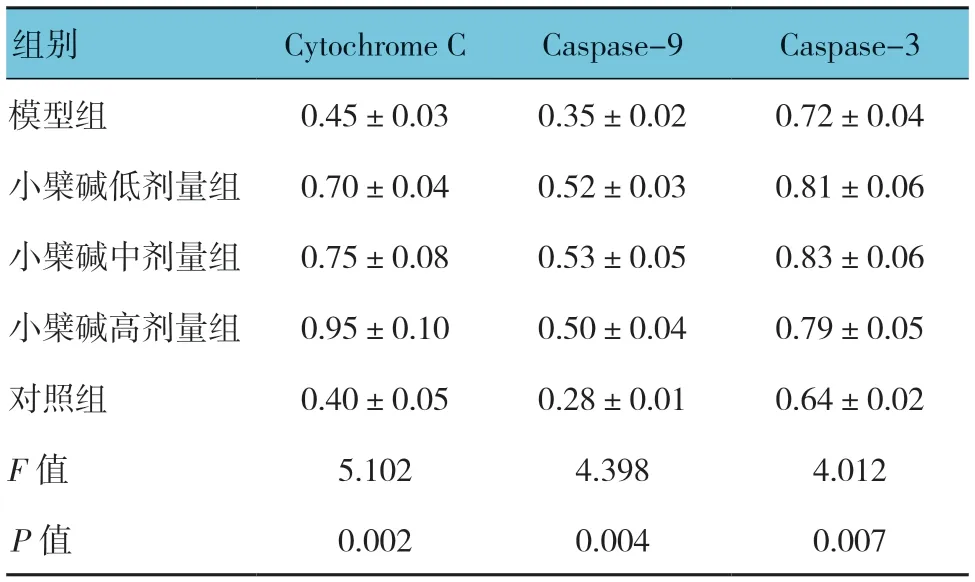
表5 各组小鼠肿瘤组织Cytochrome C、Caspase-9 及Caspase-3 蛋白相对表达量比较 (n=10,±s)
组别 Cytochrome C Caspase-9 Caspase-3模型组 0.45±0.03 0.35±0.02 0.72±0.04小檗碱低剂量组 0.70±0.04 0.52±0.03 0.81±0.06小檗碱中剂量组 0.75±0.08 0.53±0.05 0.83±0.06小檗碱高剂量组 0.95±0.10 0.50±0.04 0.79±0.05对照组 0.40±0.05 0.28±0.01 0.64±0.02 F 值 5.102 4.398 4.012 P 值 0.002 0.004 0.007
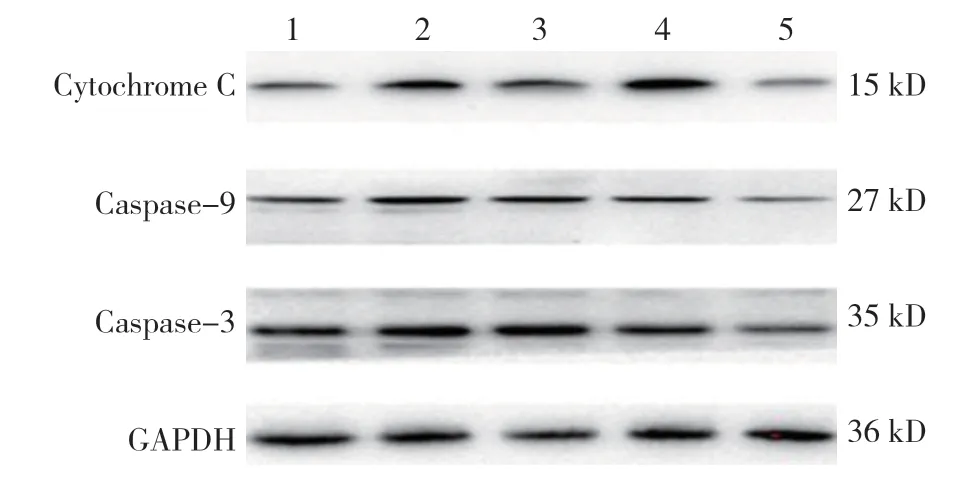
图4 各组小鼠肿瘤组织Cytochrome C、Caspase-9及Caspase-3 蛋白表达
图5 各组小鼠肿瘤组织中Cytochrome C、Caspase-9 及Caspase-3 蛋白相对表达量比较 (n=10,±s)
3 讨论
结直肠癌作为一种难治愈、易复发和转移的癌症,在全球致死性癌症高居前列,同时随着我国人口老龄化和生活水平的上升,结直肠癌发病率呈逐渐上升趋势[3-4]。目前临床上对于结直肠癌的治疗方案主要为手术治疗结合药物放化疗,5-氟尿嘧啶是目前临床首选的结直肠癌药物,可抑制胸腺嘧啶合成酶的活性,阻止脱氧尿苷酸转变为脱氧胸苷酸,干扰DNA 的合成,抑制肿瘤细胞的生长[5-8]。
本研究在小鼠皮下注射人结肠癌HCT116,复制了小鼠结肠癌移植模型,探究药物治疗作用机制。选择传统中药小檗碱,采用不同浓度小檗碱和常规化疗药物5-氟尿嘧啶给药。复制模型后小鼠体重呈逐渐下降趋势,同时对照组小鼠前2 周体重变化不大,在第3 周小鼠体重下降,这可能与化疗药物氟尿嘧啶的毒性有关,小鼠主要表现为蜷缩,毛发发灰,这与KUBICKA[9]的研究结果相似。小鼠造模后3 周,能够形成皮下肿瘤,在移植肿瘤的荷瘤压力下小鼠出现了不同程度的萎靡和死亡,模型组有50%的死亡率,同时小檗碱不同剂量给药组小鼠存活率呈依赖性。本研究发现对照组小鼠抑瘤率较高,这可能与氟尿嘧啶抑制细胞增殖肿瘤细胞生长有关。但笔者发现对照组小鼠存在副作用,主要表现为小鼠在治疗后期出现摄食量减少和体重下降,同时出现蜷缩和毛色不亮,同时小檗碱呈剂量依赖性地抑制小鼠皮下肿瘤组织生长,且高剂量小檗碱给药组的抑瘤率接近阳性对照组。
Caspase-3 是细胞凋亡过程中激活的关键激酶,也是细胞凋亡的效应因子。激活的Caspase-3 可作用于PARP 底物,使其发生水解,产物可促进细胞骨架降解DNA[10]。而Caspase-9 可直接激活Caspase-3,形成级联反应,促进癌细胞发生凋亡[11]。为了探究小檗碱抑制小鼠皮下移植肿瘤生长的机制,本研究提取小鼠移植肿瘤组织的mRNA,检测细胞凋亡相关蛋白、基因表达水平。结果发现,模型组Caspase-9 和Caspase-3 mRNA 处于低表达水平,小檗碱给药后能够促进Caspase-9 和Caspase-3 mRNA 的表达,但阳性药物氟尿嘧啶无法促其表达。检测细胞凋亡相关蛋 白Cytochrome C、Caspase-9 和Caspase-3 的 表 达水平,结果发现在小檗碱低、中、高剂量组中小鼠肿瘤组织Cytochrome C 蛋白水平较模型组上升,这说明肿瘤组织线粒体出现破损,导致Cytochrome C 蛋白外泄至胞浆,这可能进一步引起肿瘤细胞的凋亡,另外,小檗碱给药后能够诱导Caspase-9 和Caspase-3的表达水平上升,进一步加剧肿瘤细胞凋亡,而阳性药物5-尿氟嘧啶不具备破坏线粒体释放Cytochrome C 和诱导Caspase-9 和Caspase-3 表达的功能,这与MOGHIMIPOUR 等[12]的研究结果相似。可能的原因是5-氟尿嘧啶发挥抗肿瘤活性的主要机制是干扰肿瘤细胞DNA 的合成。
综上所述,本研究发现小檗碱通过破坏线粒体释放Cytochrome C,进而激活凋亡相关蛋白Caspase-9和Caspase-3 的表达,诱导肿瘤组织发生细胞凋亡,进而发挥抗肿瘤活性。

