寡聚态β淀粉样蛋白加剧小胶质细胞衰老
魏 振,崔晓丽,陈晓春,潘晓东
老化或衰老(aging)是阿尔茨海默病(Alzheimer’s disease,AD)最重要的危险因素[1,2]。细胞衰老(Cellular senescence,CS)是器官衰老的重要组成部分[3],CS在驱动衰老及其相关疾病如阿尔茨海默病、帕金森病等神经退行性疾病的发展中起重要作用[4]。小胶质细胞是中枢神经系统定居的免疫细胞,正常脑内静息状态的小胶质细胞对神经系统发挥积极的免疫监视、稳态维持、神经环路的重塑与修复[5]以及调节神经发生等作用,对维持神经元的和正常的学习记忆具有极其重要的功能[6]。近年来,小胶质细胞年龄相关性的激活和表型改变(衰老相关分泌表型)一直是AD衰老学说的主要研究内容[7,8]。研究表明,寡聚态Aβ(Oligomeric Amyloid beta,oAβ)刺激小胶质细胞导致炎症性级联反应最强,是加剧神经元的损伤进而导致AD患者认知障碍的普遍机制。尸检发现AD患者脑内小胶质细胞出现形态学异常[9],实验室既往研究显示oAβ预处理的小胶质细胞对纤丝支状Aβ的吞噬功能明显降低[10]。作为脑内重要的固有免疫细胞,功能障碍尤其是老化的小胶质细胞在AD发病机制中作用仍未阐明[7,8,11],小胶质细胞是否出现自发衰老现象以及oAβ是否直接诱导小胶质细胞衰老和DNA损伤反应(DNA damage response,DDR)国内外文献鲜有报道。本研究旨在观察小胶质细胞体内体外衰老现象,体外研究Aβ对其影响。
1 材料和方法
1.1 动物 本实验脑组织染色所用小鼠为C57BL/6J 背景的雄性鼠,成年鼠在福建医科大学实验动物中心无特定病原菌级(special pathogen free,SPF)环境繁殖饲养,原代培养用动物为出生1 d新生小鼠。
1.2 药物及试剂 冻干粉Aβ1-42购自Anaspec公司,Iba1一抗购自Wako公司,羊抗兔二抗、羊抗小鼠二抗均购自KPL公司。乙二醇和乙酸钠二甲基亚砜(DMSO)均购自Sigma公司,生物素标记羊抗兔二抗购自Vector公司; Alexa Fluor488标记羊抗鼠IgG、DAPI购自上海生工。胎牛血清、DMEM培养基、0.25%胰酶-EDTA、青霉素和链霉素购自Hyclone公司,Anti-γH2AX(ab2893)抗体购自Abcam公司。
1.3 oAβ1-42的制备 寡聚态Aβ1-42的制备参考本实验室前期方法[10]。简言之,冻干粉Aβ1-42经100%的HFIP溶解后风干至底部可见膜状物。用少量DMSO溶解(终浓度为5 mmol),重悬于无酚红Ham’s F-12培养基,配成浓度为100 μmol的母液,水浴超声10 min、涡旋,4 ℃孵育24 h后,分装保存于-80 ℃备用。
1.4 免疫组织化学染色 3 m龄和18 m龄小鼠麻醉后取脑,固定,冰冻切片机(CM1950,Leica,Germany)制作脑片,冠状位切成40 μm 厚度(参考小鼠脑立体定位图谱取额叶皮质)存于冻存液;用TBS 漂洗脑片上的冻存液,随后用3%过氧化氢处理10 min去除组织内源性的过氧化氢酶,再漂洗,室温封闭1 h,孵育一抗(Iba1 1∶2000稀释,4 ℃ 48 h),TBST漂洗后孵育生物素标记的抗鼠二抗(1∶600稀释),孵育ABC放大液,DAB(2 mg/ml)显色。 乙酸钠和TBS 漂洗后行组织SA-β-GAL染色,方法参考文献进行[12]。简言之,1 mg/ml的x-gal反应液37 ℃孵育16 h(避光),然后PBS液洗涤两遍,后固定4 min(后固定液70%乙醇:福尔马林:冰醋酸为20∶2∶1),冲洗,贴片于多聚赖氨酸包被的载玻片,封片,拍照。
1.5 原代小胶质细胞培养 采用新生24 h内C57BL/6J小鼠,喷洒酒精消毒、断头,取脑,分离大脑皮质,木瓜蛋白酶的盐溶液消化、吹打,收集细胞并计数,接种。培养至12~14 d取出,放入摇床振摇,260 rpm,1~2 h。离心去上清,收集沉淀即获得纯化的小胶质细胞,以1×105个/孔接种于含有细胞玻片的24孔板用于实验需要,从纯化接种后开始计算培养时间。
1.6 小胶质细胞SA-β-GAL染色步骤 SA-β-GAL细胞化学染色亦参考文献进行[12]。取出预先接种有小胶质细胞的玻片,4 ℃ 0.01 mol PBS冲洗后用2%甲醛-0.2%戊二醛固定10 min,PBS洗两遍,予1 mg/ml的x-gal反应液37 ℃孵育4 h(避光),PBS洗涤,后固定4 min(后固定液70%乙醇:福尔马林:冰醋酸为20∶2∶1),双蒸水冲洗。核固红复染5 min后烤干,中性树胶封片。每张片计200个细胞,确定SA-β-GAL阳性细胞数百分比(n=3)。
1.7 小胶质细胞免疫荧光单标 原代培养小胶质细胞Aβ处理后,PBS洗两次,经多聚甲醛固定后PBS漂洗。室温下封闭后孵育一抗Iba1,设置阴性对照。PBST漂洗后孵育二抗(Alex Fluor 488 Goat Anti-Mouse IgG,1∶1000 稀释),DAPI(1∶5000)复染细胞核。贴片于载玻片,封片。共聚焦显微镜LSM 780(Carl Zeiss,Germany)拍照、分析结果。
1.8 小胶质细胞免疫化学染色 小胶质细胞γH2AX细胞化学染色一抗步骤同细胞免疫荧光,孵育生物素标记兔抗IgG,随后室温孵育Vector Elite avidineperoxidase,DAB Ni显色,贴片封片同前。拍照、ImageJ软件分析图片。
2 结 果
2.1 老年鼠脑内出现小胶质细胞自发衰老表型 通过对3 m龄年轻鼠和18 m龄老年鼠脑组织行Iba1免疫组织化学染色,可以看到年轻鼠小胶质细胞呈高度分支或网态(ramified phenotype),胞体小,分支清晰明显,为静息状态,且细胞之间排列有序,无明显空白区域,监视范围大(圆圈所示),无SA-β-GAL阳性细胞(见图1A)。相反,老年鼠脑片(见图1B)染色看到小胶质细胞分支扭曲、断裂、细短,欠清晰,细胞之间排列紊乱,如蓝色圆圈所示,细胞监视范围小,细胞之间存在空白区域,部分呈阿米巴样形态(activated amoeboid shape),提示一定的衰老或营养不良状态(dystrophic senescent phenotype)。重要的是,如箭头所示,镜下可见一定数量的Iba1与SA-β-GAL共定位细胞,SA-β-GAL主要存在于胞体的胞浆,以上结果提示老化使小胶质细胞产生明显的衰老相关表型,即在体的小胶质细胞呈现自发衰老现象。
2.2 体外原代小胶质细胞的纯化鉴定 Iba-1几乎在所有的体内外小胶质细胞高表达,是小胶质细胞特异性标记物。原代培养的小胶质细胞(primary microglia,PM) 经过Iba1免疫荧光染色显示为绿色,细胞核通过DAPI 复染显示为蓝色,不同视野计数500个细胞,计算Iba-1阳性与DAPI阳性比率,结果显示本实验PM细胞纯度达94%以上,可满足实验需求(见图2)。
2.3 小胶质细胞在体外显示增龄性衰老变化 SA-β-GAL染色阳性是细胞衰老的重要标志物。为观察体外培养的原代小胶质细胞是否出现衰老特征,通过获取同一批新生鼠培养的原代小胶质细胞进行同条件小胶质细胞原代培养,分别于体外培养(Culture in vitro,DIV)至2 d(DIV2)、5 d(DIV5)、8 d(DIV8)以及11 d(DIV11)时取出立即行SA-β-GAL细胞染色。SA-β-gal染色阳性细胞,胞浆为青绿色,SA-β-GAL阴性的细胞,细胞核快红复染为红色。纯化的小胶质细胞在体外2 d时SA-β-GAL染色阳性率仅为25.04%(25.04%±6.523%),培养至5 d升至42.47%(42.47%±5.852%),同2 d相比差异有统计学意义(P<0.001);体外培养至8 d(87.42%±8.138%)和DIV11(94.20%±4.884%)明显大于培养至5 d(P<0.001),DIV8以及DIV11时绝大部分出现SA-β-GAL染色阳性,提示体外培养时间延长,小胶质细胞显示增龄性衰老变化(见图3)。
2.4 寡聚态Aβ加剧小胶质细胞体外衰老 首先,为了进一步观察体外Aβ诱导的小胶质细胞衰老是否出现经典的SA-β-gal阳性,不同剂量(含等剂量DMSO对照组,0.5 μm/L,1.0 μm/L)的寡聚态Aβ处理原代培养的小胶质细胞4 h和24 h后行SA-β-gal染色,明场拍照显示细胞轮廓计数。结果显示,与对照组相比,0.5 μmol和1.0 μmol处理24 h均明显增加小胶质细胞SA-β-gal染色阳性率(P<0.001),且1.0 μmol浓度组SA-β-gal阳性率较前者高,提示一定的浓度依赖性。相比对照组,0.5 μmol作用4 h组尽管存在增加趋势但无出统计学意义(P>0.05);与此同时,1.0 μmol作用4 h组较相应空白对照组SA-β-gal阳性率增加(P<0.05)。以上结果提示Aβ加快体外小胶质细胞衰老(见图4)。
2.5 小胶质细胞衰老可能与DNA损伤有关 γH2AX作为一种衰老生物标志物,可反映DNA损伤程度。为研究oAβ是否通过增加小胶质细胞DNA损伤反应。0.5 μmol oAβ分别处理小胶质细胞4 h(4 h)、24 h(24 h)后行γH2AX细胞化学染色,γH2AX阳性为细胞核内呈点状或斑片状黄色致密物(黑色箭头),胞浆无着色。与空表对照组相比,0.5 μmol oAβ处理24 h后小胶质细胞细胞核内γH2AX化学染色强度明显增加(P<0.05),点密度定量分析增加48%。对照组多为背景染色,仅个别细胞出现。尽管0.5 μmol 4 h组存在增加趋势,但无统计学意义。以上结果提示oAβ加速小胶质细胞衰老可能增加γH2AX表达诱发DNA损伤反应(见图5)。
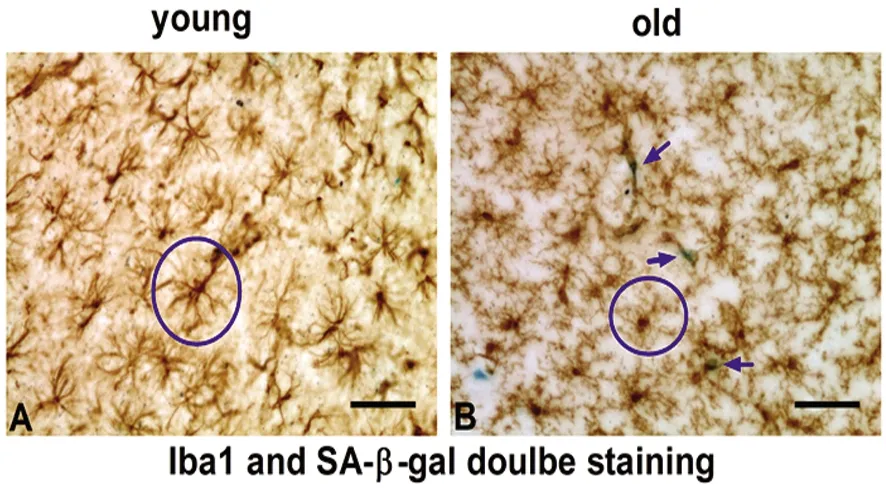
小胶质细胞Iba1及SA-β-GAL共染色(n=5)。A:3 m龄;B:18 m龄。bar=20 μm
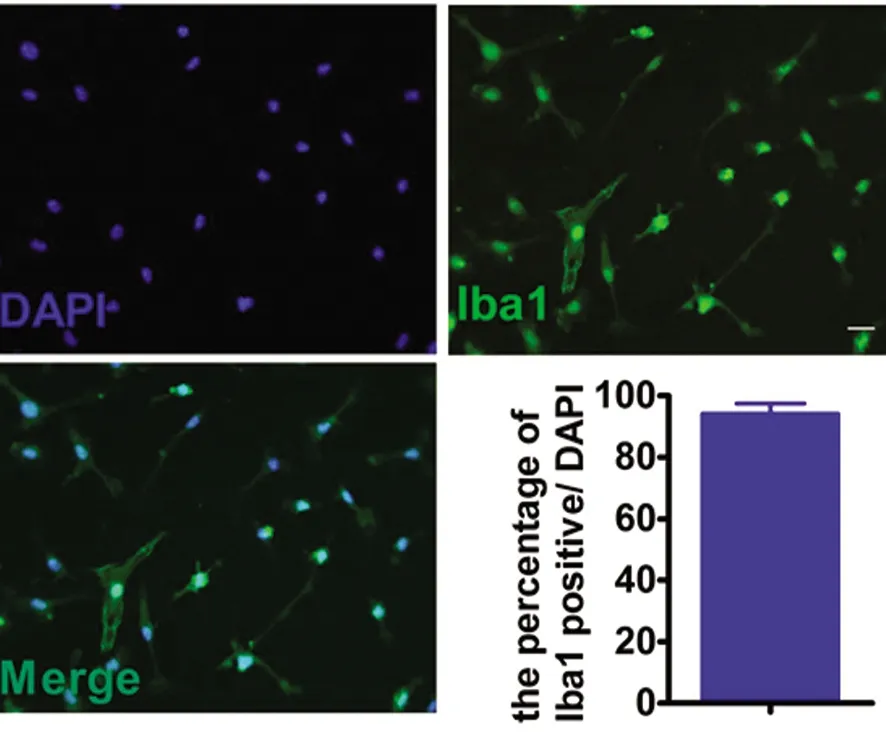
柱状图Iba1(绿色)阳性与DAPI(蓝色)阳性比值百分比n=3。bar=20 μm
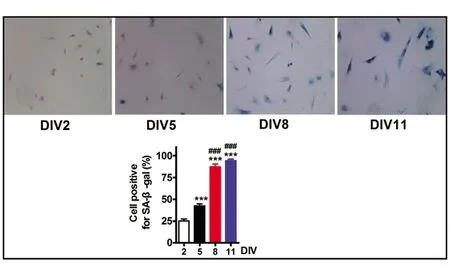
小胶质细胞体外不同时间(DIV2、DIV5、 DIV 8、DIV 11)SA-β-gal染色,n=3。柱状图统计分析结果,***P<0.001表示DIV5、DIV8、DIV11 vs.DIV2;###表示DIV8或DIV11 vs DIV5;bar=20 μm
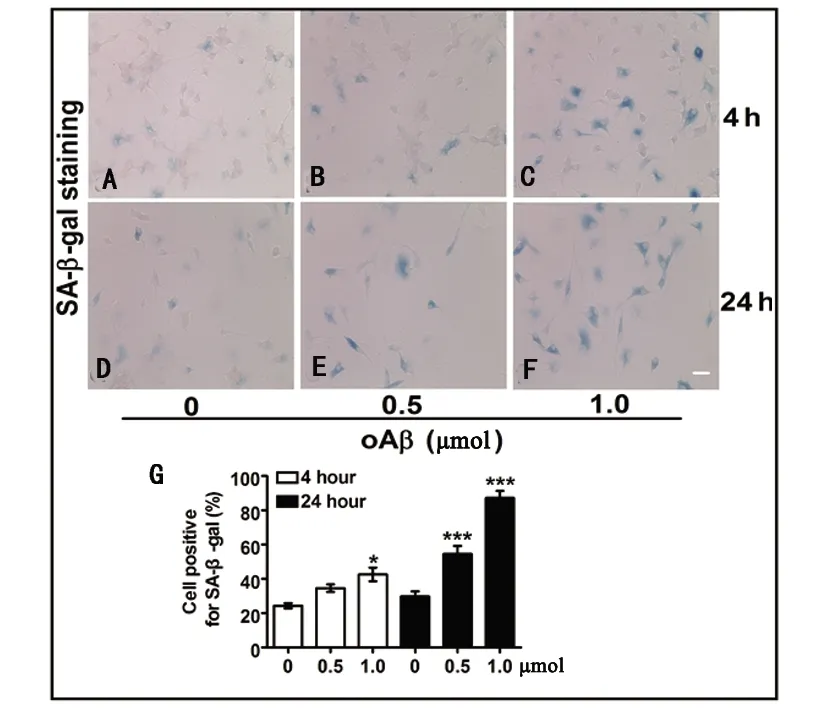
A~F:oAβ处理小胶质细胞后SA-β-gal染色,n=3。Bar=20 μm。G:SA-β-gal阳细胞性百分比。*P<0.05 :1 μmol干预4 h组与相应的对照组比。*** P<0.001:0.5 μmol和1 μmol干预24 h组与相应对照组比
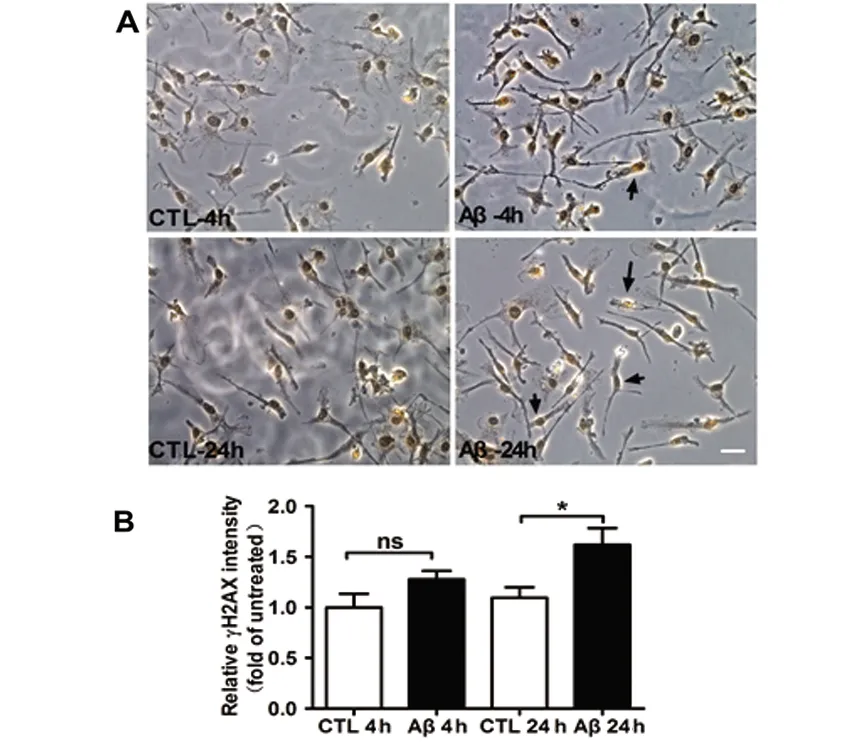
A:0.5 μmol oAβ处理小胶质细胞4 h、24 h后行γH2AX染色,n=4,bar=20 μm。B:相对γH2AX 点密度分析*P<0.05
3 讨 论
阿尔茨海默病(Alzheimer’s disease,AD)是一种发病机制未明的退行性病变,主要表现为进行性认知功能障碍、日常生活能力下降,常伴有行为和情感的异常[13]。近年以发现小胶质细胞功能相关基因SNP突变(ABCA7、TREM2、CD33等)为晚发型AD危险因子[14,15]支持AD发病的免疫衰老学说[16]。本研究在体发现老年鼠脑内小胶质细胞出现形态上的营养不良和SA-β-gal染色阳性,或许可以部分解释老年鼠认知障碍;这与前期AD脑内尸检结果一致[17]。
不同于永生化的小胶质细胞系如BV2、CHME-5,本实验使用原代培养小胶质细胞可以更好的模拟动物疾病研究。小胶质细胞在纯化之前与胶质细胞共培养,纯化后纯度高达94%以上,保证实验的准确性、可靠性。体外培养结果表明,一定时间范围内,小胶质细胞体外培养之间越长,SA-β-gal染色阳性率越高,这可能与老化的小胶质细胞代谢废物的蓄积,导致细胞内溶酶体半乳糖苷酶表达(GLB1基因的转录和翻译)的增加有关[18]。
过度沉积的Aβ刺激胶质细胞分泌大量的细胞因子和炎症介质,如TNF-α、IL-1β、IL6等,对神经元产生毒性作用导致AD发病的经典机制[19]。近年研究显示Aβ对胶质细胞老化产生重要影响。为了回答Aβ是否加速小胶质细胞的衰老这一核心问题。我们发现oAβ处理小胶质细胞后明显增加小胶质细胞SA-β-gal阳性率,与既往Aβ加速海马神经干细胞[20]和脑内血管内皮细胞衰老的研究结果一致[21]。此外,也有学者报道高浓度的Aβ1-42可导致体外星形胶质细胞SA-β-gal阳性增加[22],提示作为Aβ始作俑者在神经退行性疾病发病过程中诱发胶质细胞功能障存在一定的普遍性。
除端粒缩短导致复制衰老外[23],目前已知的触发细胞衰老的因素还包括异常癌基因(p16,p21,p53等)的激活、电离辐射、氧化应激、自噬功能障碍以及DNA损伤反应(DDR)等[2,23]。DDR直接体现于染色体结构改变和组蛋白H2AX的活化异常。在各种理化因素刺激下,细胞DNA双链发生断裂,染色体组蛋白H2A家族成员H2AX上的第139位丝氨酸发生磷酸化修饰,形成γH2AX是细胞衰老的直接体现和重要标记。动物实验显示,衰老的组织如肺泡、肝脏、脾脏、小肠等组织器官中激活的组蛋白H2AX明显活化,即γH2AX表达上调[24]。临床研究表明,与对照组相比,AD患者脑内γH2AX表达明显亦增加[25]。甚至有学者提出患者外周血淋巴细胞γH2AX表达上调可作为AD早期诊断分子标记物[26]。为此,本实验对Aβ处理后小胶质细胞γH2AX表达进行了研究,结果证实oAβ增加γH2AX表达。提示Aβ加速细胞衰老可能通过DNA损伤反应。
综上所述,本研究揭示小胶质细胞存在自发衰老现象,β淀粉样蛋白加快小胶质细胞衰老进一步支持免疫衰老在AD发病中的作用[16],为从小胶质细胞角度探索AD发病机制提供一定的理论依据。尽管小胶质细胞表达衰老相关标记物,但其衰老具体分子信号通路、衰老表型的功能改变以及体内体外的异质性需要未来进一步深入研究,尤其是如何找到干预小胶质细胞老化的药物靶点。未来抗衰老和调节免疫研究有望成为AD发病机制和治疗靶点新方向[27]。

