miR-132在氧糖剥夺诱导原代皮质神经元缺血损伤中的作用
杨利强,徐伟杰,关 欣
脑卒中是一种脑血管病变引起的神经功能丧失的神经系统疾病,分为出血性脑卒中和缺血性脑卒中,其中后者占60%~80%,具有死亡率高、发病率高、致残率高等特点[1,2]。我国现有1100万急性脑缺血患者,且每年新发病大约240万人,脑卒中已成为我国居民第一位致死原因[3]。脑缺血发生后会导致缺血核心区神经元发生不可逆的坏死性死亡,而缺血半影区和周边区域的神经元只是受到不同程度的缺血影响,这些神经元在血流恢复后即可幸存下来。研究表明,在缺血后24 h内,存活神经元会出现突触结构水肿、传导功能障碍,同时因损伤而丢失的突触多达38%[4,5]。这些结果表明神经突触对缺血性损伤十分敏感,因此,减少缺血周边区突触的丢失或促进这些突触重新形成,是减轻缺血后神经功能缺陷的关键。
MicroRNA(miRNA)是一类由20-24个核苷酸组成的内源性小RNA。miRNA通过完全互补或者部分互补靶向mRNA的3’UTR区,诱导mRNA降解或者抑制mRNA翻译,从而在转录后水平调控靶基因的表达[6~8]。目前,在人类基因组中已经证实约1500个基因由miRNAs编码,在不同的生理和生存环境下调节各种mRNA表达[9]。在这些miRNAs中,miR-132在许多文章中被证实在神经元的发育和功能中起作用[9,10]。miR-132具有组织特异性,在神经相关的组织中高表达,参与轴突生长、突触的增殖分化、神经迁移以及可塑性等过程[11,12]。因此阐明miR-132在调控突触再生中的潜在机制,是抵抗缺血性再灌注损伤、恢复神经功能的一个重要方法。本研究拟通过培养皮质原代神经元利用缺糖缺氧(Oxygen and glucose deprivation,OGD)模拟脑缺血再灌注损伤模型,探讨miR-132在脑缺血中的保护作用。
1 材料和方法
1.1 材料和试剂 SPF级健康雌性成年怀孕Sprague-Dawley大鼠16~18 d;DMEM高糖培养基(Gibco)、DMEM无糖培养基(Gibco)、胎牛血清(Gibco)、Neurobasal Plus Medium(Gibco)、B27(Gibco)、谷氨酰胺(Sigma)、多聚赖氨酸(Sigma)、胰酶(Sigma);携带相应miRNAs的重组慢病毒(Vector Builder);Trizol(Invitrogen); miRCURY LNATM Universal RT microRNA PCR(Exiqon公司);SYBR Green Master Mix(TaKaRa);CCK-8试剂盒(Sigma);PSD95(abcam)、Synapsin-1(Cell Signaling Technology)、β-actin(Santa Cruz)。
1.2 原代大鼠皮质神经细胞的培养 无菌条件下,处死16~18 d怀孕SD大鼠取出胚胎浸泡于DMEM高糖培养基中置于冰上,断头取脑组织分离出胎鼠皮质组织,在体式显微镜下用眼科镊剔除硬脑膜和血管等结缔组织并将其剪碎。将剪碎组织转移到0.125%胰酶中,37 ℃消化15 min,每5 min震荡一次。用含10%胎牛血清的DMEM高糖培养基终止消化,并用其清洗3次。用自制的4种不同口径的巴斯德管按照口径从大到小的梯度轻柔吹打组织,吹匀皮质神经细胞悬液,观察细胞存活率95%以上并计数接种,接种于事先多聚赖氨酸包被的6孔板中,接种适宜密度为7×105个。在37 ℃,5%CO2和饱和湿度的培养箱中培养4~6 h,此时神经元细胞已贴壁良好,弃去DEME完全培养基,换成nerubasal+B27+谷氨酰胺的培养基,在第3天加入阿糖胞苷抑制神经胶质细胞,以后每隔2 d进行一次半换液。
1.3 皮质神经细胞氧糖剥夺再灌注损伤模型的建立 在37 ℃、5%CO2、95%O2的培养箱中,用Nerubasal+B27+谷氨酰胺的培养基对皮质神经元细胞进行培养。本研究拟采用OGD细胞模型模拟缺血再灌注损伤,弃去原培养基更换为预温的无糖DMEM培养基,然后将其放入37 ℃、5%CO2、95%N2培养箱中培养2 h。2 h后,将无糖DMEM培养基更换为预温的Nerubasal+B27+谷氨酰胺培养基,在37 ℃、5%CO2、95%O2的培养箱中继续培养24 h。
1.4 实验分组和皮质神经细胞转染 实验分为假手术组(Sham)、氧糖剥夺再灌注损伤组(OGD)、慢病毒对照组(LV-control)、miR-132低表达组(LV-anti-miR-132)、miR-132过表达组(LV-miR-132)。除假手术组外,其余各组均进行氧糖剥夺再灌注损伤模型的建立。细胞接种后,在37 ℃、5%CO2、95%O2培养箱中培养。神经元培养至第7天将重组慢病毒LV-control、LV-anti-miR-132、LV-miR-132进行稀释转染,转染24 h后换液继续培养至第10天进行OGD处理。
1.5 皮质神经元存活率的检测 将细胞接种于96孔板,氧糖剥夺2 h再灌注24 h处理后,换液并依照实验要求每孔加入CCK-8试剂10 μl,37 ℃孵育4 h,用酶标仪在波长450 nm处读取吸光度,计算皮质神经元细胞存活率。
1.6 Real-time PCR检测各组miR-132的表达 将处理完后的细胞取出,用Trizol提取细胞总RNA,应用miRCURY LNATM Universal RT microRNA PCR进行逆转录反应,采用SYBR Green Master Mix法进行实时定量PCR扩增检测各组miR-132的表达水平,引物序列(见表1)。扩增条件为:95 ℃ 10 min,95 ℃ 10 s,58 ℃ 30 s,72 ℃ 20 s;40个循环。每个样品重复3次,获得各孔的CT值,用2ΔΔCT计算各组的miR-132相对表达水平。
1.7 Western blot检测蛋白表达 将按实验要求处理完后的细胞取出,加入细胞裂解液,4 ℃裂解30 min,制备蛋白样品,BCA法检测各组样本蛋白浓度。取20 μg蛋白样品上样进行SDS-PAGE电泳分离,然后转膜至PVDF膜上,室温下10%脱脂牛奶封闭孵育2 h,随后封闭一抗PSD95(1∶1000)、Synapsin1(1∶1000)、β-actin(1∶2000),4 ℃摇床孵育过夜。TBST洗膜3次,HRP标记的二抗(山羊抗兔、山羊抗鼠)稀释液(1∶10000)封膜,室温摇床孵育1 h,再次TBST洗膜3次。加ECL化学发光底物,将PVDF膜充分浸入发光底物后放入暗盒,在暗室内红外线灯下用X光片进行曝光。蛋白条带用Image J软件进行灰度值分析。


表1 Real-time PCR的引物序列
2 结 果
2.1 OGD处理后各组神经元细胞内miR-132表达水平的检测 实时定量PCR结果(见图1)。与Sham组神经元细胞中miR-132表达量相比,OGD诱导缺血损伤后miR-132表达水平明显减少(P<0.05,见图1)。与OGD组相比,过表达组(LV-miR-132)miR-132表达水平显著上升(P<0.01,见图1),而低表达组(LV-anti-miR-132)只有降低趋势无显著性差异(见图1)。
2.2 miR-132表达水平对OGD处理后神经元细胞活性的影响 如CCK-8结果所示,miR-132低表达明显增加OGD导致的神经元细胞的损伤作用(P<0.05,见图2),而miR-132表达上调对OGD导致的神经元损伤有一定的抵抗能力。与Sham组相比,OGD组细胞存活率为53.6%,出现显著减少(P<0.05,见图2);同OGD组相比较,低表达组(LV-anti-miR-132)细胞存活率呈现进一步减少(P<0.05,见图2),而过表达组(LV-miR-132)细胞活力出现一定程度的升高(P<0.01,见图2)。
2.3 miR-132表达水平对OGD处理后神经元细胞突触相关蛋白的影响 通过Western blot检测了OGD缺血损伤后miR-132不同表达水平对神经元突触相关蛋白的影响,结果(见图3):与Sham组比较,OGD组Synapsin-1和PSD95蛋白表达减少(P<0.05,见图3);同OGD组相比,过表达组(LV-miR-132)Synapsin-1和PSD95的蛋白表达水平明显上调(P<0.01,见图3),说明miR-132可能通过调控突触的可塑性,改变突触相关蛋白的表达水平抵抗OGD导致的缺血损伤。而低表达组(LV-anti-miR-132)相较与OGD组Synapsin-1和PSD95的蛋白表达水平有一定的下降趋势,但是无显著性差异。
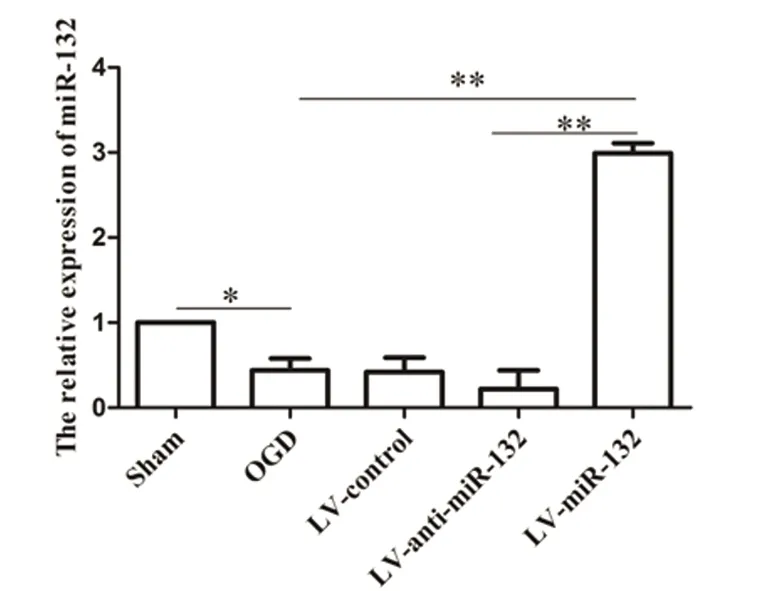
图1 Real-time PCR检测不同处理对皮质神经元中miR-132表达水平的影响

图2 CCK-8检测各组皮质神经元细胞的存活率
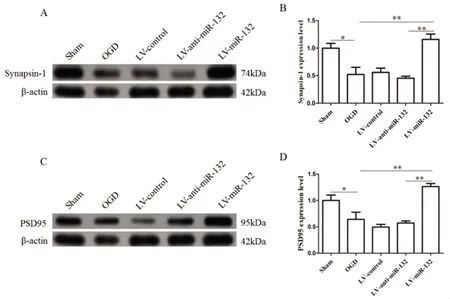
图3 Western blot检测miR-132表达水平对突触相关蛋白的影响
3 讨 论
本研究证实,OGD诱导原代皮质神经元细胞缺血损伤后miR-132表达水平下降;低表达miR-132可以加剧OGD诱导原代皮质神经元细胞死亡率,过表达miR-132表达水平则可以减轻OGD诱导的缺血损伤,增加原代皮质神经元细胞的活力,这其中的作用机制可能与miR-132调控突触的可塑性,改变突触相关蛋白的表达水平存在一定的联系。
MiRNA-132是一种富集于脑内的神经组织特异性表达的miRNA[13]。MiR-132在神经功能方面具有重要作用,参与了许多神经生理和病理过程而被称为“NeurimmiR”。体外研究证实miR-132过表达会增加GluR1、谷氨酸受体亚型NR2A、NR2B等突触相关蛋白的水平[14]。此外,体内研究发现,在嗅球、海马和纹状体等再生能力旺盛的脑区,高表达的miR-132会促进神经干细胞分化成的新生神经元整合到神经网络中,增加突触连接的形成和神经递质的传递[12,15]。还有研究证实,过表达的miR-132可以通过抑制靶基因p250GAP表达水平增加突触的分支和树突棘的数目来促进突触发生和维持突触结构的稳定[16,17]。在脑缺血模型中发现,miR-132低表达,不利于神经元存活和突触功能重塑;而miR-132过表达可以减少脑缺血后神经元死亡,促进神经再生,建立新的突触连接[18]。
我们的研究结果与其他研究基本一致,皮质神经元细胞经过OGD缺血损伤后会出现大量的神经元死亡,miR-132低表达会加剧损伤导致神经元死亡率进一步降低,而过表达miR-132可以减轻OGD造成的缺血损伤,提高神经元的存活率。Western blot结果显示:相较于OGD组,过表达miR-132可以上调Synapsin-1和PSD95的蛋白表达水平且具有显著差异,miR-132低表达会使Synapsin-1和PSD95的蛋白表达水平出现一定程度的下降但无显著差异。所以我们推测miR-132可能是通过影响突触相关蛋白的表达水平,调控突触的可塑性在OGD缺血损伤中起到保护作用,但是更具体的机制需要进一步研究。

