小麦高效转基因受体品系CB037的抗条锈性分析
郑燕燕 黄德华 李金龙 张会飞 鲍印广 倪 飞 吴佳洁
小麦高效转基因受体品系CB037的抗条锈性分析
郑燕燕 黄德华 李金龙 张会飞 鲍印广 倪 飞 吴佳洁*
山东农业大学农学院 / 作物生物学国家重点实验室, 山东泰安 271018
小麦遗传转化是开展小麦基因克隆、基因编辑及基因工程等研究的重要基础。获得易于转化及遗传背景纯合的受体材料是高效开展小麦遗传转化的关键。近年来, 小麦品系CB037作为受体材料被广泛利用, 并获得了较高的转化效率, 在小麦研究中发挥了重要作用。虽然野生型CB037农艺性状整齐一致, 但遗传背景并不纯合, 对小麦条锈菌(f. sp.)表现高感和高抗两种不同反应。本研究分离了抗病株系CB037-PstR及感病株系CB037-PstS, 并创建了F2分离群体。遗传分析表明, CB037-PstR携带单个显性抗病基因。利用BSR-Seq测序分析及分子标记检测, 将抗病位点定位于1B染色体短臂。进一步荧光原位杂交表明, CB037-PstR为1BL/1RS易位系, 可能携带抗条锈病基因。本研究明确了CB037的遗传背景及其抗条锈性, 并分离了抗病及感病株系, 为有效利用CB037作为受体材料开展小麦转基因研究奠定基础。
小麦遗传转化; 1BL/1RS易位系; 条锈病抗性; BSR-Seq;
小麦遗传转化是开展功能基因组学研究的重要方法, 可实现目标基因或功能元件的表达调控及序列编辑, 也是实现基因工程改良的重要手段[1]。不同植物的遗传转化效率相差很大, 其中小麦属于较难转化的作物之一[2], 其基因工程育种进程远落后于水稻、玉米、大豆等农作物[3]。近年来, 随着转基因技术的不断优化, 小麦转化效率取得了大幅度提高[4-6]。日本烟草公司的农杆菌介导转基因技术(Purewheat)可实现40%~90%的转化效率[7]。植物遗传转化效率也依赖受体基因型, 我国现已筛选出多个易于转化的小麦材料, 如小麦品系CB037及主推品种科农199、周麦18、内麦836等[8-9]。在不同实验目的的转基因研究中, 选择恰当的受体材料至关重要。深入了解受体品种的基因型及农艺性状, 对于有效开展小麦转基因研究具有重要意义。
CB037是由中国农业科学院作物科学研究所培育的高代品系: 农艺性状优良、对白粉病免疫、生长周期短[10-11], 而且具有良好的组织培养能力及再生性能。张伟等[8]对24个优良小麦品种及CB037进行花药培养、幼胚培养和成熟胚培养, 结果显示CB037的组织培养再生效率最高, 其中幼胚组织培养再生能力可达120%。董鲁浩等[12]利用添加TDZ (thidiazuron, 0.5 mg L–1)的培养基诱导CB037成熟胚,可获得大于90%的胚性愈伤组织诱导率和近50%的愈伤组织分化率。CB037作为理想的受体材料, 已频繁地应用于小麦遗传转化[9,13-14]。
小麦条锈病是全球范围内影响小麦生产的严重病害, 其致病菌条形柄锈菌小麦专化型(f. sp., Pst)为活体营养专性寄生真菌, 存在有性生殖、毒性变异快, 可导致抗病基因在生产上使用3~5年后便丧失抗性[15]。克隆新的抗条锈病基因以及开展小麦-锈菌互作机制研究, 对于培育抗条锈病小麦品种具有重要意义。为有效开展抗条锈病基因的功能验证[13]、感锈病基因的敲除[16]以及针对条锈菌的寄主诱导基因沉默(host-induced gene silencing, HIGS)等研究[17], 获得高感条锈病且易转化的受体小麦是一项重要条件。小麦品系CB037常作为感条锈病材料用于转基因研究, 但是我们注意到非转基因受体中常存在部分个体表现抗病, 对转基因后代的表型分析带来障碍。本研究通过表型鉴定分离了抗病及感病CB037株系, 并通过转录组测序及遗传分析对抗病位点进行了染色体定位, 为种质材料CB037的有效利用提供了重要参考。
1 材料与方法
1.1 供试材料
春性小麦材料CB037由中国农业科学院作物科学研究所陈孝研究员选育, 叶兴国研究员馈赠。材料在山东泰安山东农业大学试验田及室内种植。小麦条锈菌采用山东农业大学试验田繁殖的混合孢子。
1.2 试验方法
1.2.1 小麦条锈菌接种鉴定 苗期鉴定采用涂抹法。将新鲜条锈菌孢子与滑石粉按1∶10比例混合, 用小毛刷轻轻涂抹于一叶一心期小麦叶片。接菌后将植株置于10℃暗培养24 h, 保持相对湿度100%; 然后置于16 h光照/15℃、8 h黑暗/10℃条件下生长。2~3周后记录表型。田间材料接种采用孢子悬浮液注射法。于每年3月中旬小麦起身期, 使用注射器(针头0.6 mm × 25.0 mm)向小麦茎秆注射孢子悬浮液, 至心叶中有孢子水溢出。接种后田间浇水增加湿度。隔周重复接菌1~2次。以小麦品种辉县红作为感病对照, 4~6周后调查表型。表型鉴定标准采用国际常用九级抗病表型分类方法[18]。
1.2.2 转录组测序及数据分析 CB037-PstR、CB037-PstS及F2感病单株取苗期叶片, 使用TRIzol法提取总RNA。由北京贝瑞和康公司进行样品质检及建库测序, 测序平台为Illumina NovaSeq 6000, 测序读长为PE 150 bp, 每个样本不少于10 Gb测序量。测序数据经质控后, 利用STAR v2.7 (https:// github.com/alexdobin/STAR)进行mapping, 参考基因组为IWGSC RefSeq v1.0 (https://www.wheatgenome. org/), 并利用GATK v3.8 (https://gatk.broadinsti tute.org/)进行SNPs和InDels的挖掘。
1.2.3 分子标记开发 选择多态性位点两翼序列共400 bp, 比对小麦基因组(http://202.194.139.32/)并分析A/B/D基因组间差异, 设计基因组特异PCR引物, 根据酶切位点或InDel长度开发CAPS或InDel标记。另外, 还利用了基因已报道的分子标记,[19]、[20]和[21]。
1.2.4 分子标记PCR检测 PCR扩增总体系20 μL: 含1.0 μL模板DNA (100 ng μL–1)、10 μL 2×GreenMix (诺唯赞生物科技有限公司)、正向和反向引物(10 μmol L–1)各0.5 μL、ddH2O 8 μL。PCR仪使用GeneAmp 9700 (Life Technologies)。扩增程序: 94℃预变性5 min; 94℃变性30 s, 55~58℃退火30 s, 温度根据分子标记设定, 72℃延伸30 s, 35个循环; 72℃延伸5 min, 15℃保存。酶切体系(CAPS标记): PCR产物15 μL、ddH2O 1.8 μL、内切酶 0.3 μL、缓冲液1.9 μL; 酶切3 h。
1.2.5 原位杂交 染色体制片参照Han等[22]方法。基因组原位杂交(GISH)以黑麦基因组DNA为探针、中国春DNA为封阻。荧光原位杂交(FISH)参照Huang等[23]方法, 以TAMRA (6-carboxytetramethylrhodamine)标记的pAs1-1、pAs1-3、pAs1-4、pAs1-6、AFA-3、AFA-4和FAM (6-carboxyfluorescein)标记的pSc119.2-1、(GAA)10为探针。镜检使用Nikon (ECLIPSE Ni-U型)荧光显微镜, 用DS-Ril型CCD机(Nikon)进行图像采集。
2 结果与分析
2.1 小麦品系CB037抗小麦条锈病表型鉴定
在小麦品系CB037不同单株混收的种子中, 随机选择部分籽粒进行种植, 并在苗期接种条锈菌, 2~3周后进行表型鉴定。结果表明, 品系CB037对小麦条锈菌的抗性存在分离。其中多数个体高感条锈病, 接种部位出现大量孢子堆, 反应型ITs=7~8; 少数个体表现条锈病抗性, 接种部位出现明显褪绿及坏死斑, 无孢子堆痕迹, 反应型ITs = 2~3 (图1)。在田间种植材料中, CB037株行在成株期高感小麦条锈病; 但同时可观察到少量抗病单株(图1)。随机选择2个感病单株、5个抗病单株抽穗后进行套袋自交, 并进一步对其自交后代(各100粒)进行接种鉴定。结果表明, 两类株系的感病、抗病表型均稳定遗传, 株系内未出现分离。对鉴定获得的感条锈病、抗条锈病株系分别命名为CB037-PstS和CB037-PstR。

图1 CB037所分离出的两个株系对条锈菌的不同反应
1, 2: 苗期叶片; 3: 成株期叶片。
1, 2: seedlings leaf; 3: adult plant leaf.
2.2 抗小麦条锈病株系CB037-PstR的遗传分析
以感病株系CB037-PstS为父本、抗病株系CB037-PstR为母本, 创建F2分离群体。81个F2单株获得了苗期条锈菌接种鉴定表型。其中, 63株表现抗病(ITs=1~3), 18株表现感病(ITs=5~8), 抗、感呈现3﹕1分离比例, 符合单个显性抗病基因遗传(χ2= 0.33,= 1,= 0.5)。
为确定该抗病位点的染色体定位, 本研究首先开展了转录组测序。测序样品包括由13个感病F2单株构成的混合池, 及亲本CB037-PstR、CB037- PstS。利用NovaSeq 6000平台, 分别获得了36.0、74.7、60.5百万条paired-end reads。以中国春序列作为参考基因组, 比较抗病材料(CB037-PstR)、感病材料(CB037-PstS及F2混合池)之间的多态性位点, 结果共筛选到3767个纯合的SNP或InDel位点。其中2770 (73.5%)个位点分布于1B染色体, 尤其富集在1B染色体短臂及着丝粒附近(图2)。多态性位点较为富集的染色体包括2B (371, 9.8%)、3B (253, 6.7%)和1D (104, 2.8%); 而9条染色体(3D、4D、5A、5D、6A、6B、6D、7A、7B)上未发现多态性位点(图2)。
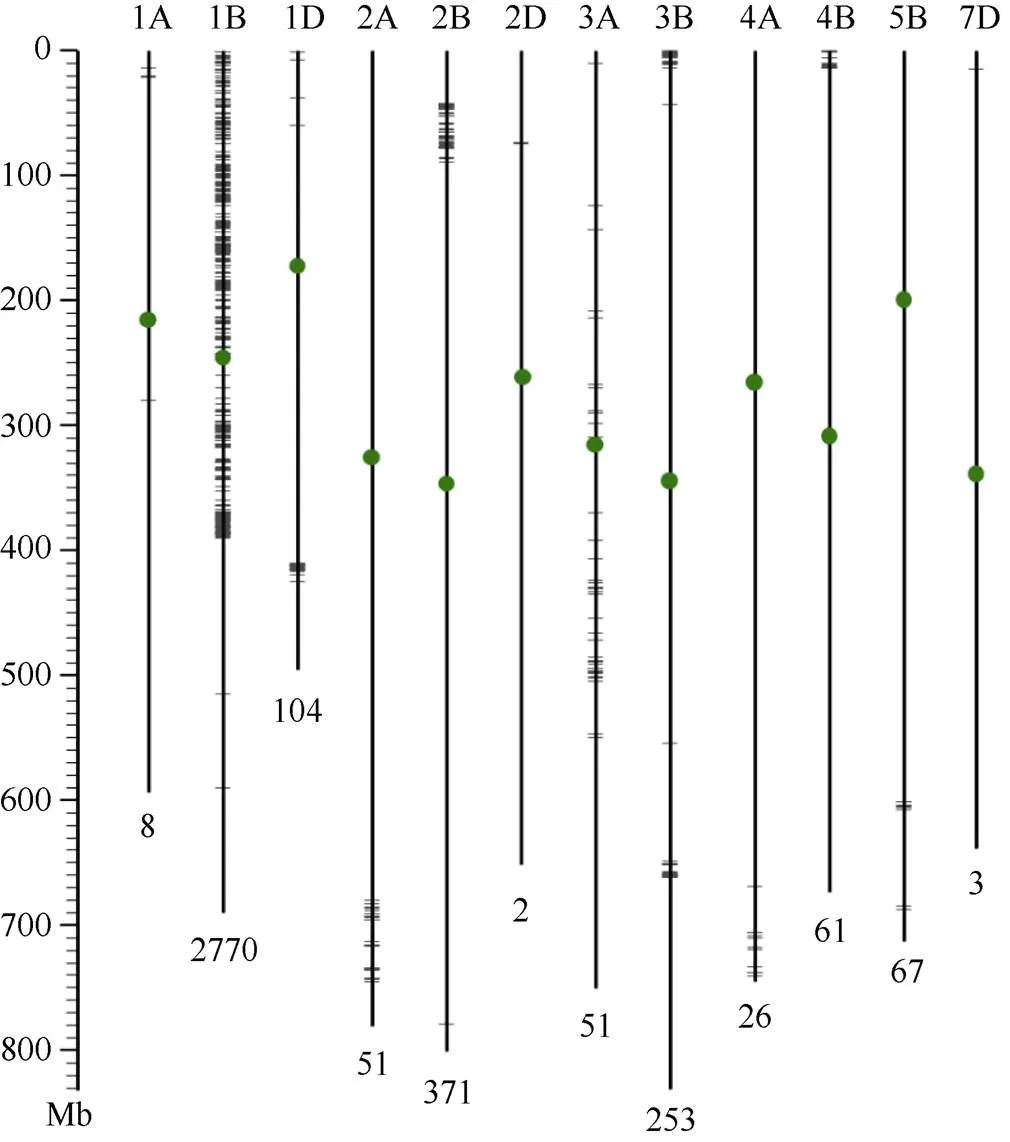
图2 抗病株系CB037-PstR与感病株系CB037-PstS及F2感病单株混合池间差异位点的染色体分布图
竖线及绿色圆点分别代表小麦染色体及着丝粒。上方数字及字母代表染色体编号, 下方数字为定位于该染色体的SNP及InDel数量, 短横线代表SNP及InDel所在位置。左侧标尺代表染色体长度, 单位Mb。
Vertical lines and green dots represent wheat chromosomes and centromeres, respectively. Numbers and letters on top identify each chromosome. Numbers below each chromosome mark the amount of the SNPs and InDels mapped on each chromosome. Short horizontal lines indicate positions of SNPs or InDels.
利用多态性位点开发了5个分子标记以区分CB037-PstS和CB037-PstR基因型, 其中4个位于1B染色体, 1个位于4A染色体(表1)。对81个F2个体进行检测, 发现CB037-PstR携带的抗条锈病位点与1B染色体的4个标记连锁, 与4A染色体上的标记无连锁关系。其中, 位于1B染色体短臂的3个标记(、、)与抗条锈病表型完全连锁; 1B染色体长臂的标记与抗条锈病位点有重组, 遗传距离3.7 cM。
为明确小麦品系CB037的遗传组成, 对实验室保存的CB037混收种子随机选取100粒, 利用和鉴定幼苗基因型, 发现80粒符合感病株系CB037-PstS的基因型, 20粒符合抗病株系CB037-PstR基因型。该结果与CB037混收籽粒的表型鉴定结果相一致, 多数个体对条锈菌感病, 少数个体表现抗病。
aCAPS分子标记;bInDel分子标记; CBS和CBR分别代表CB037-PstS、CB037-PstR。
aCAPS marker;bInDel marker; CBS and CBR represent CB037-PstS and CB037-PstR, respectively.
2.3 抗小麦条锈病株系CB037-PstR的染色体分析
鉴于CB037-PstR携带的抗病位点定位于1BS染色体臂, 我们在抗、感2个株系及其F2群体中对抗条锈病基因进行了分子标记检测。结果表明, 3个标记、、均与抗病性状共分离(图3), 表明CB037-pstR携带黑麦的1RS染色体易位。
以CB037-PstS、CB037-PstR为材料, 进一步开展了FISH及GISH杂交鉴定。以黑麦的总基因组DNA作探针、以中国春的DNA作封阻。如图4所示, CB037-PstR中可见一对染色体的短臂上具有明显的绿色杂交信号(图4-C), 而CB037-PstS未见任何杂交信号(图4-A)。根据GISH结果对染色体进行识别, 可见发生易位的染色体为1B染色体长臂(图4-B, D)。该结果表明, CB037-PstR株系为1BL/1RS易位系材料, 而CB037-PstS不携带1RS。
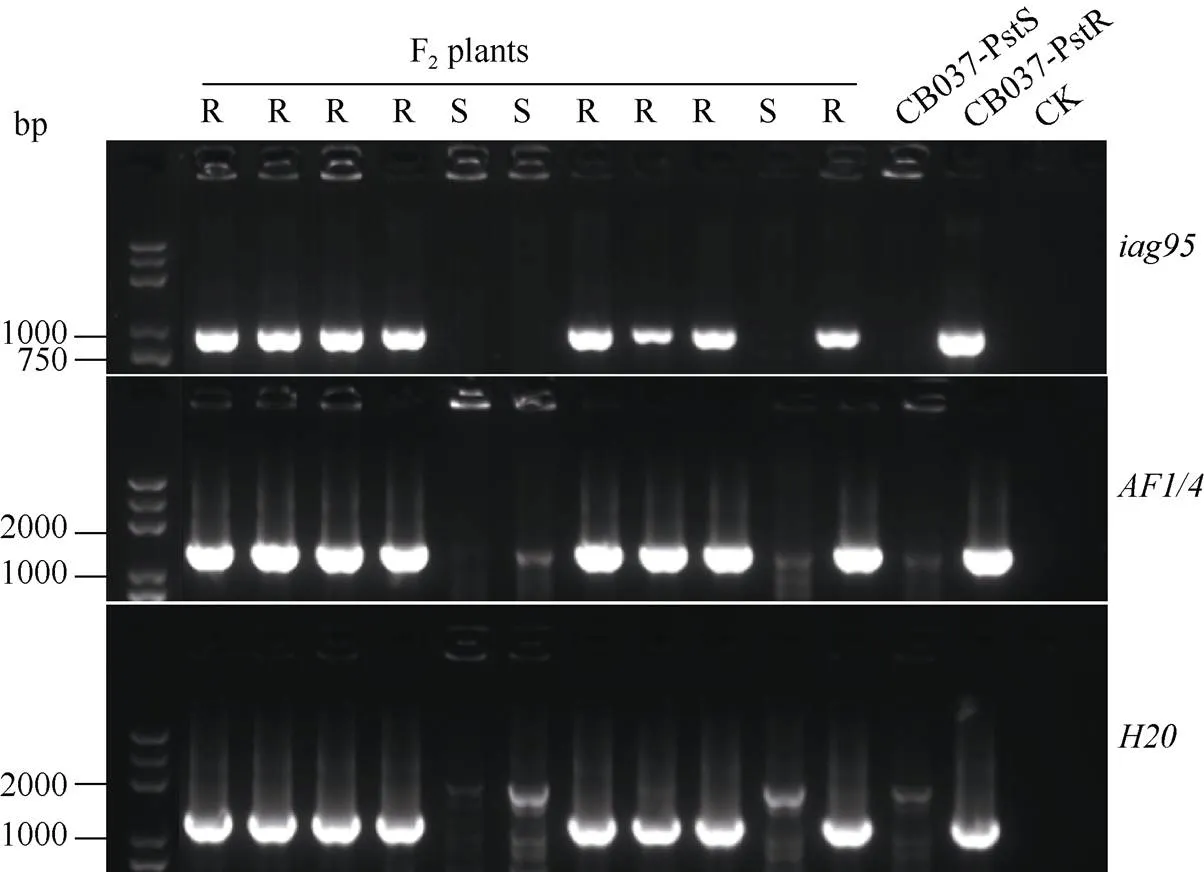
图3 抗条锈病基因Yr9分子标记(iag95, AF1/4, H20)的检测结果
S、R分别表示F2个体的感病及抗病表型; CK为空白对照。
Letters S and R indicate phenotypes of susceptible and resistant of F2individuals; CK is the blank control.
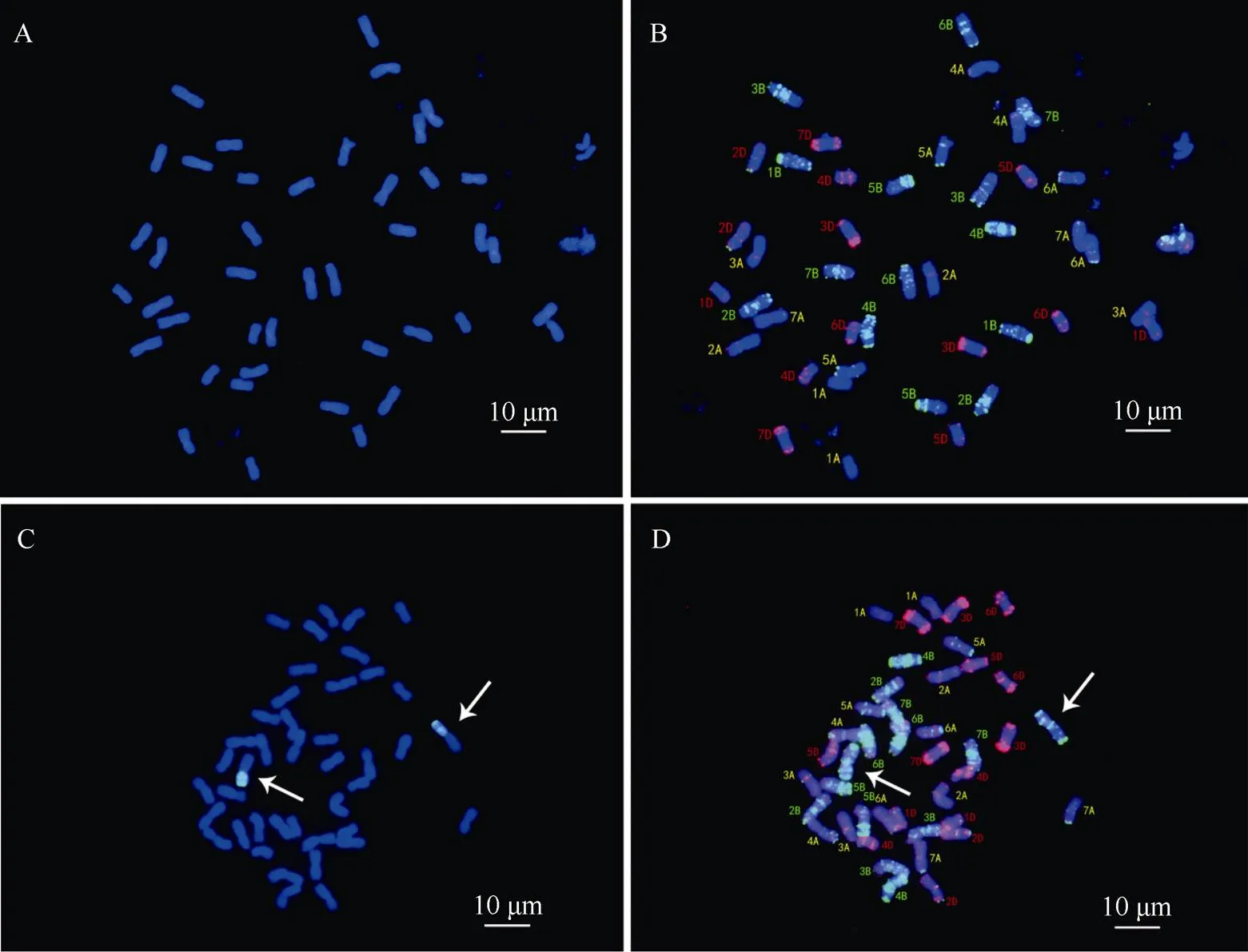
图4 CB037两个株系的染色体荧光原位杂交鉴定
A, B: CB037-PstS; C, D: CB037-PstR; A和C: GISH鉴定; B和D: FISH鉴定。标尺长度为10 μm。
A, B: CB037-PstS; C, D: CB037-PstR; A & C: GISH patterns; B & D: FISH patterns. Bar = 10 μm.
3 讨论
小麦品系CB037具有良好的组织培养再生能力及优良的农艺性状, 在小麦转基因研究中被广泛利用。本研究通过苗期、成株期的条锈菌接种鉴定, 及世代间材料的重复鉴定, 发现CB037为混合群体, 包含分别表现抗病或感病的不同个体。其后代株系的表型稳定遗传, 未出现分离。分子标记检测结果表明, 混收籽粒中抗病和感病基因型分别占20%和80%, 该比例与表型鉴定结果相一致。虽然CB037品系个体间的抗条锈性存在差异, 但是株高、穗型等农艺性状未见明显差别。在CB037-PstS、CB037-PstR的转录组测序中, 以中国春序列作为参考共鉴定到70,021个多态性位点, 其中二者相同的位点有63,837个, 占91.2%。如果扣除抗病材料在1B染色体上特异的多态性位点(2770个), CB037- PstS与CB037-PstR的相似性为94.9%。该结果表明, CB037品系中的抗条锈病个体并非来自小比例的种子污染或花粉污染, 而是来自育种剩余变异[24]。
本研究进一步发现CB037-PstR的条锈病抗性受单基因控制, 并通过BSR-seq (bulked segregant RNA-sequencing)分析, 将其定位于1B染色体短臂。对1BS染色体的2个已知基因和进行了检测, 发现二者均不存在于CB037-PstR(未发表数据); 而黑麦1RS染色体上的分子标记与CB037-PstR的抗锈性完全连锁。细胞学证据进一步表明CB037-pstR为1BL/1RS易位系, 因此可能携带基因。虽然对我国条锈病主要流行小种已丧失抗性, 但本研究中利用的混合孢子对CB037-PstR没有毒性, 而且对典型的携带基因的小麦品种鲁麦15也没有毒性(未发表数据)。该混合孢子的菌系组成还有待明确。另外, 虽然早已被克服, 但在我国仍被广泛利用, 而且小麦育种中不断引入了新型的1B/1R易位系[15,25]。因此, 不能排除CB037-PstR可能携带等位基因或其它抗病基因。
本研究自小麦品系CB037分离了抗锈性不同的2个株系, 为有效利用CB037作为受体材料开展小麦转基因研究提供了重要参考。CB037-PstS 高感小麦条锈病, 可便于开展小麦-条锈菌互作相关基因的功能研究。抗病株系CB037-PstR不但具有簇毛麦来源的抗白粉病基因[10], 还可能具有黑麦来源的抗条锈病基因及抗叶锈病基因、抗秆锈病基因、抗白粉病基因[19]。虽然对我国主要条锈病流行小种已丧失抗性, 但是与、等基因聚合仍然可以增强品种抗病性[15]。因此, CB037-PstR可以作为优良的抗病种质材料开展基因工程育种。1BL/1RS易位系品种虽然具有良好的抗病性、抗逆性和丰产性, 但是在品质性状上却存在明显不足[26]。位点位于1RS远着丝粒端, 编码多拷贝ω-黑麦碱基因; 通过遗传工程降低或去除ω-黑麦碱基因表达量, 是解决1BL/1RS 易位系小麦面团加工品质差的重要途径[27-28]。CB037-PstR作为易于转化的1BL/1RS易位系材料, 在ω-黑麦碱基因的基因工程研究中将具有显著优势。
转基因研究中, 不同受体的遗传转化效率相差很大, 基因型是主要影响因素。体细胞胚胎发生相关类受体蛋白激酶等多类基因都可能影响植物组织培养再生效率[29]。实践表明, 借助某些关键基因的表达可显著提高小麦遗传转化效率(发明专利201710422896.6)。定位及分离影响小麦组织培养再生相关基因, 对于提高基因工程研究水平具有重要意义, 也是目前的研究热点之一[29]。CB037-PstS和CB037-PstR除了抗锈性具有明显差别外, 转化效率也存在较大差异(数据未发表)。鉴于二者具有很高的遗传相似性, 可作为近等基因系开展小麦组织培养再生相关基因的遗传分析及定位研究。
4 结论
小麦品系CB037为混系材料, 包含对小麦条锈菌表现高感及高抗的个体, 并以高感个体为主。抗病株系CB037-PstR为1BL/1RS易位系, 其抗病位点受单基因控制, 定位于1B染色体短臂。
[1] Hensel G. Genetic transformation ofcereals—summary of almost three-decade’s development., 2020, 40: 107484. doi: 10.1016/j.biotechadv.2019.107484.
[2] Harwood W A. Advances and remaining challenges in the transformation of barley and wheat., 2012, 63: 1791–1798.
[3] 叶兴国, 徐惠君, 杜丽璞, 何光源, 王轲, 林志珊. 小麦规模化转基因技术体系构建及其应用. 中国农业科学, 2014, 47: 4155–4171. Ye X G, Xu H J, Du L P, He G Y, Wang K, Lin Z S. Establishment and application of large-scale transformation systems in wheat., 2014, 47: 4155–4171 (in Chinese with English abstract).
[4] Wang K, Riaz B, Ye X G. Wheat genome editing expedited by efficient transformation techniques: progress and perspectives., 2018, 6: 22–31.
[5] Hayta S, Smedley M A, Demir S U, Blundell R, Hinchliffe A, Atkinson N, Harwood W A. An efficient and reproducible-mediated transformation method for hexaploid wheat (L.)., 2019, 15: 121.
[6] Demirer G S, Zhang H, Matos J L, Goh N S, Cunningham F J, Sung Y, Chang R, Aditham A J, Chio L, Cho M J. High aspect ratio nanomaterials enable delivery of functional genetic material without DNA integration in mature plants., 2019, 14: 456–464.
[7] Ishida Y, Tsunashima M, Hiei Y, Komari T. Wheat (L.) transformation using immature embryos., 2015, 1223: 189–198.
[8] 张伟, 尹米琦, 赵佩, 王轲, 杜丽璞, 叶兴国. 我国部分主推小麦品种组织培养再生能力评价. 作物学报, 2018, 44: 208–217. Zhang W, Yin M Q, Zhao P, Wang K, Du L P, Ye X G. Regeneration capacity evaluation of some largely popularized wheat varieties in China., 2018, 44: 208–217 (in Chinese with English abstract).
[9] Wang K, Liu H Y, Du L P, Ye X G. Generation of marker-free transgenic hexaploid wheat via an-mediated co-transformation strategy in commercial Chinese wheat varieties., 2017, 15: 614–623.
[10] 张云龙, 王美蛟, 张悦, 褚翠萍, 林志珊, 徐琼芳, 叶兴国, 陈孝, 张宪省. 不同簇毛麦6VS染色体臂的白粉病抗性特异功能标记的开发及应用. 作物学报, 2012, 38: 1827–1832. Zhang Y L, Wang M J, Zhang Y, Chu C P, Lin Z S, Xu Q F, Ye X G, Chen X, Zhang X S. Development and application of functional markers specific to powdery mildew resistance on chromosome arm 6VS from different origins of., 2012, 38: 1827–1832 (in Chinese with English abstract).
[11] 陈龙飞, 严以苹, 汪信东, 刘艳, 张怀渝, 张增艳. 兼抗白粉病和黄矮病小麦育种材料的创造与鉴定. 植物遗传资源学报, 2013, 14: 925–929. Chen L F, Yan Y P, Wang X D, Liu Y, Zhang H Y, Zhang Z Y. Development and detection of wheat breeding materials resistant to both powdery mildew and barley yellow dwarf virus., 2013, 14: 925–929 (in Chinese with English abstract).
[12] 董鲁浩, 姚富泉, 詹悠, 李兴国, 别晓敏. 春小麦成熟胚愈伤组织诱导及再生体系的优化. 分子植物育种, 2019, 18: 1244–1249. Dong L H, Yao F Q, Zhan Y, Li X G, Bie X M. Optimization of callus induction and regeneration system of mature embryo in spring wheats., 2019, 18: 1244–1249 (in Chinese with English abstract).
[13] Zhang C Z, Huang L, Zhang H F, Hao Q Q, Lyu B, Wang M N, Lynn E, Liu M, Kou C L, Qi J, Chen F J, Li M K, Gao G, Ni F, Zhang L Q, Hao M, Wang J R, Chen X M, Luo M C, Zheng Y L, Wu J J, Liu D C, Fu D L. An ancestral NB-LRR with duplicated 3'UTRs confers stripe rust resistance in wheat and barley., 2019, 10: 4023.
[14] Liu K Y, Cao J, Yu K H, Liu X Y, Gao Y J, Chen Q, Zhang W J, Peng H R, Du J, Xin M M, Hu Z R, Guo W L, Vincenzo R, Ni Z F, Sun Q X, Yao Y Y. Wheatmodulates leaf angle through auxin and brassinosteroid signaling., 2019, 181: 179–194.
[15] 韩德俊, 康振生. 中国小麦品种抗条锈病现状及存在问题与对策. 植物保护, 2018, 44: 1–12. Han D J, Kang Z S. Current status and future strategy in breeding wheat for resistance to stripe rust in China., 2008, 44: 1–12 (in Chinese with English abstract).
[16] Engelhardt S, Stam R, Hückelhoven R. Good riddance? Breaking disease susceptibility in the era of new breeding technologies., 2018, 8: 114.
[17] Zhu X, Qi T, Yang Q, He F, Tan C, Ma W, Voegele R T, Kang Z, Guo J. Host-induced gene silencing of the MAPKK geneconfers stable resistance to wheat stripe rust., 2017, 175: 1853–1863.
[18] Line R F, Qayoum A. Virulence, aggressiveness, evolution, and distribution of races of(the cause of stripe rust of wheat) in North America, 1968–87. Technical Bulletin No. 1788, U.S. Department of Agriculture, National Technical Information Service, Springfield, VA, USA, 1992.
[19] Mago R, Miah H, Lawrence G J, Wellings C R, Spielmeyer W, Bariana H S, McIntosh R A, Pryor A J, Ellis J G. High-resolution mapping and mutation analysis separate the rust resistance genes,andon the short arm of rye chromosome 1., 2005, 112: 41–50.
[20] Francis H A, Leitch A R, Koebner R. Conversion of a RAPD-generated PCR product, containing a novel dispersed repetitive element, into a fast and robust assay for the presence of rye chromatin in wheat., 1995, 90: 636–642.
[21] Liu C, Yang Z J, Li G R, Zeng Z X, Zhang Y, Zhou J P, Liu Z H, Ren Z L. Isolation of a new repetitive DNA sequence fromenables targeting ofchromatin in wheat background., 2007, 159: 249–258.
[22] Han F P, Liu B, Fedak G, Liu Z H. Genomic constitution and variation in five partial amphiploids of wheat–intermedium as revealed by GISH, multicolor GISH and seed storage protein analysis., 2004, 109: 1070–1076.
[23] Huang X, Zhu M, Zhuang L, Zhang S, Wang J, Chen X, Wang D, Chen J, Bao Y, Guo J, Zhang J, Feng Y, Chu C, Du P, Qi Z, Wang H, Chen P. Structural chromosome rearrangements and polymorphisms identified in Chinese wheat cultivars by high-resolution multiplex oligonucleotide FISH., 2018, 131: 1967–1986.
[24] 高德荣, 张勇, 吴宏亚, 陆成彬, 张伯桥, 程顺和. 系统选择在现代小麦品种改良中的应用. 江苏农业科学, 2000, (1): 21–23.Gao D R, Zhang Y, Wu H Y, Lu C B, Zhang B Q, Cheng S H. Application of systematic selection to improvement of modern wheat varieties., 2000, (1): 21–23 (in Chinese).
[25] 曹廷杰, 陈永兴, 李丹, 张艳, 王西成, 赵虹, 刘志勇. 河南小麦新育成品种(系)白粉病抗性鉴定与分子标记检测. 作物学报, 2015, 41: 1172–1182. Cao T J, Chen Y X, Li D, Zhang Y, Wang X C, Zhao H, Liu Z Y. Identification and molecular detection of powdery mildew resistance of new bred wheat varieties (lines) in Henan province, China., 2015, 41: 1172–1182 (in Chinese with English abstract).
[26] 刘建军, 何中虎, Pena R J, 赵振东. 1BL/1RS易位对小麦加工品质的影响. 作物学报, 2004, 30: 149–153.Liu J J, He Z H, Pena R J, Zhao Z D. Effect of 1BL/1RS translocation on grain quality and noodle quality in bread wheat., 2004, 30: 149–153 (in Chinese with English abstract).
[27] 李亚青, 张楠, 张士昌, 何明琦, 李孟军. 黑麦1RS染色体臂位点的研究进展. 河北农业科学, 2018, 22: 37–40. Li Y Q, Zhang N, Zhang S C, He M Q, Li M J. Advances oflocus on rye 1RS chromosome arm., 2018, 22: 37–40 (in Chinese with English abstract).
[28] 柴建芳, 王海波, 马秀英, 张翠绵, 董福双. ω-黑麦碱基因沉默对小麦1B/1R易位系加工品质的影响. 作物学报, 2016, 42: 627–632. Chai J F, Wang H B, Ma X Y, Zhang C M, Dong F S. Effect of ω-Secalin gene silencing on processing quality of wheat 1B/1R translocation line., 2016, 42: 627–632 (in Chinese with English abstract).
[29] 叶兴国, 佘茂云, 王轲, 杜丽璞, 徐惠君. 植物组织培养再生相关基因鉴定、克隆和应用研究进展. 作物学报, 2012, 38: 191–201.Ye X G, She M Y, Wang K, Du L P, Xu H J. Identification, cloning, and potential application of genes related to somatic embryogenesis in plant tissue culture., 2012, 38: 191–201 (in Chinese with English abstract).
Analysis of the stripe rust resistance in a wheat line CB037 with high regeneration and transformation efficiency
ZHENG Yan-Yan, HUANG De-Hua, LI Ji-Long, ZHANG Hui-Fei, BAO Yin-Guang, NI Fei, and WU Jia-Jie*
State Key Laboratory of Crop Biology / College of Agronomy, Shandong Agricultural University, Tai’an 271018, Shandong, China
Genetic transformation is used for efficient gene cloning, gene editing and gene engineering, etc. Obtaining recipient lines amenable to transformation and with pure genetic background is critical for high efficiency transformations. For recent years, the wheat inbreed line CB037 had been widely used as a recipient for transgenes and obtain its high transformation potential. Despite having stable agronomic traits, the CB037 is genetically heterogeneous for resistance to wheat stripe rust (f. sp., Pst). In this study, the-resistant line CB037-PstR and-susceptible line CB037-PstS were isolated, and their F2population was created. Genetic analysis showed that the CB037-PstR carried a single dominant resistance gene. The identified resistance gene was mapped on the short arm of chromosome 1B using BSR-seq and molecular marker analysis. GISH results further revealed that CB037-PstR is a 1BL/1RS translocation line and likely carried. This study segregated genetic heterogeneity in CB037 for stripe rust resistance and isolated its-susceptible and resistant lines. These results will facilitate trait-oriented use of CB037 in genetic engineering of wheat.
wheat transformation; 1BL/1RS translocation line; stripe rust resistance; BSR-Seq;
10.3724/SP.J.1006.2020.01016
本研究由国家转基因生物新品种培育重大专项(2016ZX08009003001)和山东省高等学校“青创科技计划”项目(2019KJF026)资助。
This study was supported by the National Major Project for Developing New GM Crops (2016ZX08009003001) and the Youth Innovation and Scientific Program of Higher Education of Shandong (2019KJF026).
吴佳洁, E-mail: jiajiewu@sdau.edu.cn, Tel: 0538-8242213
E-mail:zyy18854889722@163.com, Tel: 0538-8242279
2020-02-24;
2020-06-02;
2020-06-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200615.1520.004.html

