百合抗尖孢镰刀菌细胞突变系的防御酶活性变化
张艺萍,杨秀梅,许 凤,王丽花,苏 艳,唐艺蓉,瞿素萍*,吴学尉
(1.云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心/云南省花卉育种重点实验室/云南省花卉工程技术研究中心/云南省昆明市花卉遗传改良重点实验室,云南 昆明 650205;2.云南云科花卉有限公司,云南 昆明 650200;3.云南大学 农学院,云南 昆明 650200)
寄主植物在受到病原菌侵染以后会发生一系列的生理生化变化,其中POD (peroxidase) (过氧化物酶)、PPO (polyphenol oxidase) (多酚氧化酶)、PAL (phenylalanine ammonia-lyase) (苯丙氨酸解氨酶)、β-1,3-葡聚糖酶、几丁质酶是跟寄主植物抗病性紧密相关的酶类。寄主植物在抵抗病原菌的侵染过程中,抗病性相关酶起到十分重要的作用,这主要包括酚类代谢系统中的一些酶和病原相关蛋白家族。POD在寄主植物抗病反应中所起的关键作用主要表现在以下几个方面:(1)POD参与木质素的合成[1];有学者研究发现水稻在遭受黄单胞病菌侵染后,阳离子过氧化物酶可以在水稻叶肉细胞壁、细胞间隙及木质部导管腔内累积,致使水稻黄单胞病菌无法侵染到寄主细胞内,因此认为这种阳离子POD参与木质素的合成与寄主植物的抗病性相关[2]。(2) POD可将寄主植物细胞内的酚类物质氧化成醌类物质,从而增强寄主植物的抗病性;有学者研究了洋葱与葱腐葡萄孢的互作后发现,在葱腐葡萄孢侵入洋葱表皮细胞的部位,酚类物质含量明显增多并形成颗粒沉积物,颗粒沉积物的形成与过氧化物酶的活性增强紧密相关[3]。(3) POD参与木栓质的合成,从而可以加快寄主植物伤口愈合的速度;有研究发现在番茄组织和马铃薯块茎的过敏性反应中阴离子过氧化物酶催化合成木栓质[4]。(4) POD参与富含羟脯氨酸糖蛋白的合成,从而增强寄主细胞表面的强度[5]。
PAL参与苯丙烷类代谢通路上的第一步反应,它参与植保素、黄酮、酚类物质及木质素等抗菌物质的合成, PAL与寄主植物的抗病性紧密相关[6]。有学者研究了枯萎病尖孢镰刀菌侵入西瓜幼苗后其叶片和根茎部组织中POD和PAL的活性变化,发现随着病原菌的侵入,抗病西瓜品种和感病西瓜品种体内POD和PAL两种酶的活性都有不同程度的增强,但抗病西瓜品种的增强幅度比感病西瓜品种显著提高[7,8]。李捷等[9]研究发现接种枸杞根腐病菌尖孢镰刀菌后,抗病的枸杞品种中PAL活性明显比感病品种的强。周瑜等[10]研究发现接种糜子黑穗病菌后,感病品种糜子叶片中PAL活性变化幅度明显大于抗病品种。王绍敏等[11]研究发现接种立枯丝核菌(Rhizoctoniasolani)后72 h内,玉米体内的PAL活性呈现出逐渐升高的趋势,并在72 h时出现第一个峰值;随后PAL活性降低,在144 h时又呈现逐渐升高的趋势。
高等植物体内PPO是由核编码的含铜的金属蛋白酶,位于植物细胞质体内囊体,PPO的底物位于细胞液泡内,当病原菌侵入寄主植物时,PPO与底物结合,氧化底物合成醌类物质,多酚及醌类物质能使病原菌生长所必需的磷酸化酶和转氨酶的合成受到阻碍,从而限制病原菌的进一步扩展。PPO不但可以参与酚类物质的氧化,还可以参与木质素的合成,木质素除了可以增强寄主植物细胞壁对抗病原菌的压力外,还能抑制真菌酶和病原菌所分泌的毒素的进一步扩散,进而可以限制病原菌的侵入。PPO氧化酶活性与抗病性相关[12]。研究发现PPO活性与玉米抗感病害的研究结果吻合[13]。
本研究主要测定了百合抗病无性系和感病无性系在接种尖孢镰刀菌和尖孢镰刀菌毒素后POD、PAL、PPO、β-1,3-葡聚糖酶、几丁质酶的活性变化,这将有利于揭示毒素筛选无性系的生化抗性机制,从而为该方法提供一定的生化理论依据。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 采用正常生长的感病百合品种‘卡萨布兰卡’(‘Casa Blanca’)无性系(以下简称感病无性系),以及经尖孢镰刀菌百合专化型毒素筛选后获得的‘卡萨布兰卡’抗病无性系(以下简称抗病无性系)作为实验材料。
1.1.2 病原菌 从感病组织中分离纯化后获得的尖孢镰刀菌百合专化型(F.oxysporumf. sp.lilii),已经经过菌丝、孢子形态及分子鉴定。其菌株一直保存在PDA培养基上。
1.2 实验方法
1.2.1 尖孢镰刀菌孢子悬浮液及其粗毒素的制备 将马铃薯蔗糖琼胶(PSA)培养基上的尖孢镰刀菌扩大培养后配制成孢子悬浮液(含孢子1×106个/mL)。无菌尖孢镰刀菌毒素粗提液的制备参照台莲梅等[14]的方法进行。
1.2.2 样品处理及制备方法 将感病无性系和抗病无性系的生根组培苗置于含无菌水的试管中,切根后接种尖孢镰刀菌百合专化型的孢子悬浮液(孢子1×106个/mL);同时取切根后的植株浸于粗毒素中。分别于接种后0、6、12、24、48、72 h取样,在紫外分光光度计上测定POD、PAL、PPO、β-1,3-葡聚糖酶、几丁质酶的活性。
1.2.3 防御酶活性的测定方法 POD、PAL活性的测定按李合生[15]的方法进行。PPO活性的测定按梁小红[16]的方法进行。β-1,3-葡聚糖酶的提取和活性测定参照余永廷等[17]的方法进行。几丁质酶的提取和活性测定参照史益敏[18]的方法进行。酶活性是以实验材料的干重DW(g)为单位进行计算的。
1.2.4 数据处理与统计分析 采用Excel 2007软件统计与整理实验数据,并用插图功能生成图形。
2 结果与分析
2.1 抗病无性系和感病无性系POD活性的变化
如图1所示,经百合尖孢镰刀菌及其毒素诱导后,抗病无性系和感病无性系的POD活性均呈现先升高后降低的变化趋势,但抗病无性系的POD活性高于感病无性系,抗病无性系的POD活性在48 h达最高;抗病无性系经百合尖孢镰刀菌诱导后,POD活性峰值比感病无性系提高了322.03 U/(g·min);抗病无性系经毒素诱导后,POD活性峰值比感病无性系提高了244.33 U/(g·min)。
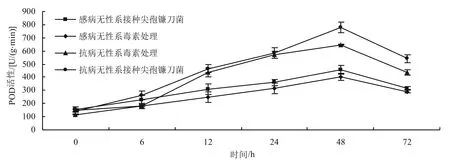
图1 抗病无性系和感病无性系POD活性的变化
2.2 抗病无性系和感病无性系PAL活性的变化
如图2所示,经百合尖孢镰刀菌及其毒素诱导后,百合抗病无性系和感病无性系的PAL活性均呈现出先升高后降低的变化趋势。抗病无性系的PAL活性均较感病无性系有所提高,抗病无性系的PAL活性在48 h达最高;抗病无性系经尖孢镰刀菌处理后,PAL活性峰值比感病无性系提高了93.34 U/(g·min);抗病无性系经毒素诱导后,PAL活性峰值比感病无性系提高了203.33 U/(g·min)。

图2 抗病无性系和感病无性系PAL活性的变化
2.3 抗病无性系和感病无性系PPO活性的变化
如图3所示,经百合尖孢镰刀菌及其毒素诱导后,抗病无性系和感病无性系的PPO活性均呈现先升高后降低的变化趋势。抗病无性系的PPO活性均比感病无性系的高,抗病无性系的PPO活性在48 h达最高;抗病无性系经百合尖孢镰刀菌诱导后,PPO活性峰值比感病无性系提高了64.00 U/(g·min);抗病无性系经毒素诱导后,PPO活性峰值比感病无性系提高了53.20 U/(g·min)。
2.4 抗病无性系和感病无性系β-1,3-葡聚糖酶活性的变化
如图4所示,经百合尖孢镰刀菌及其毒素诱导后,抗病无性系和感病无性系的β-1,3-葡聚糖酶活性均呈现逐渐升高的变化趋势。抗病无性系的β-1,3-葡聚糖酶活性急剧上升,在72 h时达最高;抗病无性系经百合尖孢镰刀菌诱导后,其β-1,3-葡聚糖酶活性峰值比感病无性系提高了142.00 U/(g·min);抗病无性系经毒素诱导后,其β-1,3-葡聚糖酶活性峰值比感病无性系提高了107.00 U/(g·min)。
2.5 抗病无性系和感病无性系几丁质酶活性的变化
如图5所示,经百合尖孢镰刀菌及其毒素诱导后,抗病无性系和感病无性系的几丁质酶活性均呈现先升高后降低的变化趋势。抗病无性系的几丁质酶活性比感病无性系有所提高,但峰值提高不明显。
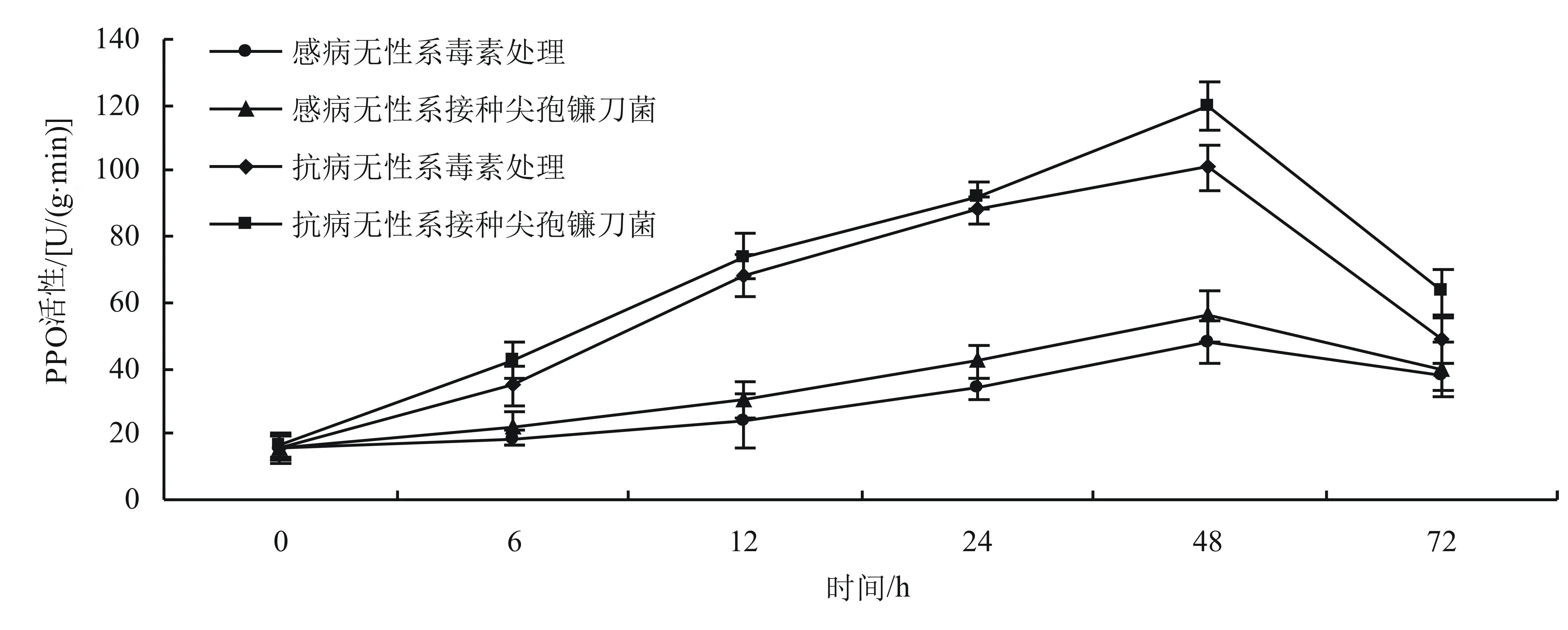
图3 抗病无性系和感病无性系PPO活性的变化
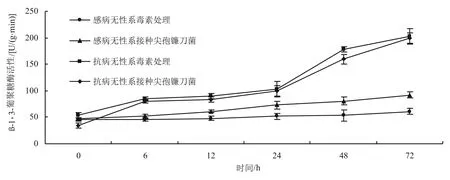
图4 抗病无性系和感病无性系β-1,3-葡聚糖酶活性的变化

图5 抗病无性系和感病无性系几丁质酶活性的变化
3 结论与讨论
寄主植物的抗病性是建立在一系列物质代谢的基础之上的,其中催化这些物质代谢反应的酶是关键。PAL是植物莽草酸通路的关键酶和限速酶,在木质素的积累、植保素和酚类物质的合成中起十分关键的作用。POD是木质素合成的关键酶之一,在阻止活性氧的形成、清除活性氧等方面起着十分重要的作用,POD活性可间接反映寄主植物体内的活性氧代谢情况[19]。PPO能将寄主植物体内的酚类物质氧化成对病原菌有毒害作用的醌类物质[20]。本实验结果表明,在接种尖孢镰刀菌和用尖孢镰刀菌毒素诱导后,百合抗病无性系的POD、PAL和PPO活性均呈先上升后降低的趋势。
病程相关蛋白(PR蛋白)的累积是寄主植物获得系统抗病性的重要因子,β-1,3-葡聚糖酶和几丁质酶是寄主植物中重要的病程相关蛋白(PR蛋白)。寄主植物中的几丁质酶是其体内与抗病性紧密相关的一种酶,它能将病原真菌的菌丝细胞壁中的几丁质进行酶解,导致原生质膜破裂,从而破坏病原菌菌丝,抑制病原菌的菌丝生长,破坏细胞内新物质的累积,最终导致病原真菌死亡。此外,酶解后产生的病原真菌细胞壁降解物还能发挥诱导物的作用,激活寄主植物的抗病性反应。本实验结果表明,在接种尖孢镰刀菌和用尖孢镰刀菌毒素诱导后,百合抗病无性系的几丁质酶活性呈现出先上升后降低的趋势。
β-1,3-葡聚糖酶参与代谢合成的产物可以作为诱导物诱导与其他抗病反应有关的酶系,这些酶类可以促进木质素、植保素等抗病物质的合成与累积,从而加强寄主植物的抗病性[21]。本实验中百合抗病无性系在接种尖孢镰刀菌和经尖孢镰刀菌毒素诱导后,其体内β-1,3-葡聚糖酶的活性增强,表明尖孢镰刀菌毒素可能诱导了寄主植物的抗病性,且可能与植物的系统获得抗病性有关系。但在本研究中β-1,3-葡聚糖酶的活性呈现一直上升的状态并未形成山峰状,这可能是因为诱导处理时间短。
——谷物β-葡聚糖的最新研究进展

