小麦Dof转录因子家族全基因组鉴定和表达分析
任永康,牛瑜琦,逯成芳,唐朝晖
(山西农业大学 农学院,山西 太原 030031)
Dof(DNA binding with one finger)转录因子是植物中特有的转录因子,其N端有一个保守的Dof结构域,该结构域由50~52个氨基酸残基(C-X2-C-X21-C-X2-C)组成,其中的4个Cys残基与Zn2+共价结合形成C2-C2型单锌指结构[1];该结构域能够特异识别靶基因启动子中的AAAG/CTTT顺式作用元件[1]。Dof结构域作为一个双功能结构域,能够介导DNA与蛋白质结合或者蛋白质与蛋白质相互作用[2]。与其他单锌指类转录因子不同的是,Dof转录因子C端的转录调控结构域氨基酸数量和种类变化较大[1]。
研究发现,Dof转录因子可以调控植物的生长发育,例如植株表型的变化[3]、开花时间的变化[3]、叶片的衰老[4]、种皮形成[5]、胚乳发育[6-7]等。过表达水稻OsDof12基因可使转基因水稻植株变矮,叶片短小直立,在长日照条件下提前开花[3];水稻OsDof24基因参与茉莉酸介导的延缓叶片衰老[4];拟南芥AtDOF4.2基因调控种皮形成[5];水稻Dof基因OsPBF(Prolamin-box binding factor)是水稻种子存储蛋白基因的激活剂,参与胚乳特异性基因表达的调控[6];玉米ZmDof3基因能够调节玉米胚乳中的淀粉积累[7]。此外,Dof转录因子在抵抗生物和非生物胁迫方面同样发挥重要作用[8-13]。毛竹Dof基因广泛参与冷、盐、干旱胁迫响应[8];杨树Dof基因参与ABA响应[9];过表达番茄Dof基因SlCDF1(Cycling dof factors 1)能提高植物抗旱、耐盐能力[10];过表达水稻OsDof15基因能够降低转基因水稻植株根对盐胁迫的敏感性[11];过表达番茄Dof基因TDDF1(Tomato dof daily fluctuations 1)能够提高转基因番茄植株的抗旱和耐盐能力[12];超表达3个烟草Dof基因BBF1(RolB domain B Factor 1)、BBF2和BBF3能够提高病毒抗性基因和多个防御相关基因的表达水平[13]。上述表明Dof基因在植物生长发育、生物和非生物胁迫响应方面发挥了重要作用。
自从第一个Dof转录因子在玉米中被分离出来之后[14],研究人员陆续从其他物种中分离出植物Dof基因,如水稻、拟南芥等[1]。截至目前,在水稻基因组中共鉴定了30个Dof基因[1],拟南芥中36个[1-2],二穗短柄草中27个[15],谷子中35个[16],胡萝卜中46个[17]。小麦是重要的粮食作物,其重要性不言而喻。小麦基因组测序已完成,但在全基因组水平上鉴定小麦Dof转录因子家族的研究尚未见报道,这极大地限制了小麦Dof转录因子的生物学功能研究。为此,利用最新的小麦基因组信息,通过生物信息学方法对小麦Dof转录因子家族成员在全基因组水平上进行鉴定,并进一步对其理化性质、保守结构域、染色体分布、共线性、表达模式进行系统分析,旨在为小麦Dof转录因子的功能研究奠定基础。
1 材料和方法
1.1 小麦Dof转录因子家族的全基因组鉴定及理化性质分析
小麦、拟南芥、水稻全基因组数据和蛋白质数据从Ensembl Plant(http://plants.ensembl.org/index.html)中下载。为了获得小麦Dof基因,利用前人的方法略做了改进[18-19]。首先利用HMMER 3.0的HMMbuild程序对所有的拟南芥和水稻Dof基因构建HMM模型,并利用该模型在小麦蛋白质数据库中进行BLASTP比对,获得假定的小麦Dof基因。然后,从Pfam数据库(http://pfam.xfam.org/)中获得Dof基因特有的保守结构域模型PF02701,利用HMMsearch程序在小麦蛋白质数据库中进行BLASTP比对,获得假定的小麦Dof基因。对于两次获得的假定Dof基因,去除重复基因和可变剪接基因之后,即为小麦Dof基因。最后,利用NCBI CDD和SMART对得到的Dof基因进行结构域确定,去除没有Dof结构域的基因,最终得到小麦Dof基因。
利用ExPASy(https://www.expasy.org/)对小麦Dof蛋白进行理化性质预测,包括氨基酸数目、理论等电点、分子质量、总平均疏水指数等;同时利用CELLO 2.5 (http://cello.life.nctu.edu.tw/)进行亚细胞定位预测。
1.2 多序列比对和系统进化分析
利用Bioedit软件中的ClustalX程序对小麦、水稻、拟南芥Dof转录因子进行多序列比对和结果的可视化。利用MEGA 7的邻接法(Neighbor-joining)进行系统进化树构建,bootstrap值设置为1 000,其他参数默认。
1.3 染色体定位和共线性分析
根据小麦基因组注释信息(http://plants.ensembl.org/index.html)及BLASTN比对结果,获得小麦Dof基因的染色体定位信息。采用MCScanX软件进行小麦Dof基因序列的比对、同源基因获取、共线性整合,参数设置为默认。利用Circos 0.67软件展示Dof基因在染色体上的物理分布和共线性结果。
1.4 表达模式分析
在EMBL-EBI(http://www.ebi.ac.uk/)数据库中下载小麦15个组织(15个不同时期的根、茎、叶、花、果实)编号为E-MTAB-4484的高通量数据;从NCBI SRA数据库中下载编号为SRP045409的转录组数据,进行高温、干旱、旱热共胁迫后的表达分析,下载编号为SRP068156的转录组数据进行禾谷镰刀菌侵染后的表达分析。利用Tophat和Cufflinks软件进行转录组数据reads的全基因组映射,计算各个Dof基因的FPKM值,利用HemI 1.0进行表达谱热图的绘制。
2 结果与分析
2.1 小麦Dof转录因子家族的全基因组鉴定和理化性质分析
在小麦基因组水平上共鉴定到86个Dof基因,根据其在染色体上的位置分布(表1),将它们命名为TaDof1A—TaDof28D。小麦Dof基因编码氨基酸数目介于152(TaDof14D)~539(TaDof17A和TaDof17B)个,分子质量为15.77(TaDof14D)~58.13 ku(TaDof17B),理论等电点为4.66(TaDof18B)~10.46(TaDof14A/B/D),所有的小麦Dof转录因子的总平均疏水指数均小于1,说明它们都是亲水性蛋白。亚细胞定位预测发现,所有的Dof转录因子均定位在细胞核中。

表1 小麦Dof转录因子家族的全基因组鉴定及理化性质Tab.1 Genome-wide identification and physicochemical properties of Dof transcription factors in wheat

续表1 小麦Dof转录因子家族的全基因组鉴定及理化性质Tab.1(Continued) Genome-wide identification and physicochemical properties of Dof transcription factors in wheat
2.2 小麦Dof转录因子多序列比对分析
由图1可知,所有小麦Dof转录因子结构域均含有C-X2-C-X21-CX2-C保守基序,其构成一个C2-C2型的单锌指结构,这与在水稻和拟南芥中的研究结果一致[1],进一步证明所鉴定的蛋白质为Dof家族成员。

图1 小麦Dof转录因子保守结构域多序列比对Fig.1 Multiple sequences alignment of conserved domain in wheat Dof transcription factors
2.3 小麦Dof转录因子进化分析
将前人研究得到的水稻、拟南芥Dof转录因子及本研究的86个小麦Dof转录因子进行进化分析(图2),发现Dof转录因子可分为A、B、C1、C2、C3、D1、D2共7个亚组。其中,D1是最大的亚组,包含29个小麦Dof转录因子;C3是最小的亚组,包含3个小麦Dof转录因子。Dof基因广泛参与植物的生长发育。例如,在A亚组基因中,过表达拟南芥AtDOF4.7(At4g38000.1)会使花器官脱落[20];SCAP1(Stomatal carpenter 1)(At5g65590.1)调控拟南芥气孔发育[21];而小麦TaDof1(TaDof27A)在小麦叶片和叶鞘中具有较高的表达量,暗示它在小麦叶片发育过程中发挥重要作用[22]。C1亚组基因中,拟南芥DOF6(At3g45610.1)基因负向调控种子的萌发[21]。C3亚组中,水稻RPBF(Rice prolamin-box binding factor)(LOC_Os02g15350.1)基因通过激活种子贮藏蛋白基因的表达来促进种子发育[23]。而D1亚组中,过表达拟南芥CDF3(Cycling Dof factor 3)(At3g47500.1)基因促使植物开花延迟,并提高植物对干旱、低温的抗性[24];拟南芥CDF2(At5g39660.1)基因可抑制CO(CONSTANS)的表达,使拟南芥开花延迟[25];过表达水稻OsDof4(LOC_Os01g17000.1)能够促使植物提前开花[26];过表达水稻OsDof12(LOC_Os03g07360.1)基因会导致水稻植株变矮、叶片直立和叶片缩短[3];而OsDOF24(LOC_Os08g38220.1)基因通过调控茉莉酸途径中基因的表达量来延迟叶片衰老[4]。由上可知,A和D1亚组基因调控植物开花和叶片发育,而C1和C3亚组基因主要调控种子的发育。目前,对小麦Dof基因的研究很少,这些结果暗示小麦A和D1亚组Dof基因可能调控植物开花和叶片发育,同时C亚组基因在种子发育方面发挥重要作用。尽管B亚组基因尚未有研究报道,但该亚组和其他亚组同源关系较近,暗示B亚组在植物生长发育中也可能发挥重要作用。
2.4 小麦Dof基因染色体定位和共线性分析
由图3可知,所有的小麦Dof基因不均等分布在不同染色体上。在小麦的A、B、D染色体组中,分别包含有30、29、27个Dof转录因子,暗示小麦Dof转录因子的数量在A、B、D染色体组中发生了变化,在小麦两次进化加倍过程中,同源基因的保留和丢失同时发生。
由图3可知,23个小麦Dof基因组成了29对共线性基因对。一些基因至少与3个同源基因组成不同的共线性基因对,如3A染色体上的TaDof18A基因与TaDof3A、TaDof3B、TaDof3D分别组成3对共线性基因对;3D染色体上的TaDof15D基因与TaDof4A、TaDof4B、TaDof4D分别组成3对共线性基因对。这些结果表明,小麦Dof基因在进化过程中发生了复制,且发生在不同染色体上,这可能是小麦Dof基因数目多于其他物种的原因。

图2 小麦Dof转录因子与水稻、拟南芥Dof转录因子的进化分析
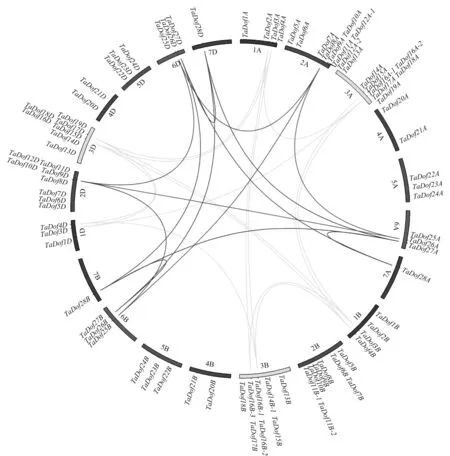
图3 小麦Dof基因的染色体定位和共线性分析
2.5 小麦Dof基因表达模式分析
为探究小麦Dof基因在小麦生长发育中的生物学功能,利用RNA-seq数据对小麦Dof基因在15个不同组织(多个不同时期的根、茎、叶、花、籽粒)中的表达情况进行分析发现(图4),小麦Dof基因在不同组织中的表达模式有明显差异,大部分基因在这15个组织中表达量都较低。相同基因在同一组织的不同时期表达模式有较大差异,例如TaDof1基因的A、B、D 3个拷贝在拔节期的花中均有较高表达量,而在抽穗期和扬花期的花中表达量均较低。说明小麦Dof基因广泛参与各个时期的植物生长发育,在植物生长发育过程中具有重要作用。
本研究进一步利用转录组数据分析了小麦Dof基因在高温、干旱、旱热共胁迫以及禾谷镰刀菌侵染条件下喷施ABA(脱落酸)和GA(赤霉素)的表达模式。结果发现(图5A),大部分小麦Dof基因在受到高温和干旱胁迫后表达模式发生较明显变化,且相同处理不同时间点的表达模式也存在明显差异。例如,TaDof3的A、B、D 3个拷贝,在遭受干旱胁迫6 h后(DS6h)表达量明显上调,相同处理1 h(DS1h)条件下相对于对照而言未发生明显变化。由此说明小麦Dof基因在响应非生物逆境过程中可能发挥重要作用。图5B显示,所有的Dof基因在禾谷镰刀菌侵染条件下喷施ABA后表达量相对于只受到禾谷镰刀菌侵染处理发生了较明显的相反趋势变化;而大部分Dof基因表达量在喷施GA后也发生了明显变化。说明Dof基因广泛参与植物的生物和非生物胁迫响应。

a:子叶出现期的根;b:三叶期的根;c:成熟期的根;d:三叶期的茎;e:拔节期的茎;f:抽穗期的茎;g:三叶期的叶;h:分蘖期的叶;i:灌浆期的叶;j:拔节期的花;k:抽穗期的花;l:扬花期的花;m:籽粒形成期的籽粒;n:灌浆期的籽粒;o:蜡熟期的籽粒

A:CK、HS1h、HS6h、DS1h、DS6h、HD1h、HD6h分别代表对照,高温处理1、6 h,干旱处理1、6 h,旱热共胁迫1、6 h。B:fhb、ABA、GA分别代表禾谷镰刀菌侵染后、侵染后ABA处理、侵染后GA处理
3 结论与讨论
Dof转录因子是植物中特有的一类转录因子,其在植物生长发育过程中具有重要作用。本研究在小麦基因组中共鉴定到86个Dof转录因子,其在数量上远多于水稻(30)[1]、拟南芥(36)[1-2]、二穗短柄草(27)[15]、谷子(35)[16]和粗山羊草(10)[27],可能是因为小麦在进化过程中经历了自然加倍,使得基因组得到扩张,从而造成Dof基因数量加倍。多序列比对结果发现,一共有24个氨基酸残基存在于Dof结构域中,占Dof结构域氨基酸数量的1/2以上,它们共同组成了一个保守的C-X2-C-X21-CX2-C基序,构成一个C2-C2型的单锌指结构。
系统进化分析将86个小麦Dof转录因子分成了7个不同的亚组,每个亚组含有不同数量的Dof转录因子。其中,亚组D1是最大的一个亚组,包含29个Dof转录因子,约占所鉴定Dof转录因子总数的1/3。此外,小麦21条染色体分布着数量不等的Dof转录因子,他们在A、B、D 3个不同染色体组中数量同样不均等,说明小麦Dof同源基因的保留和丢失在染色体组中同时发生。共线性结果证明了小麦Dof基因在进化过程中发生了基因复制事件,且发生在不同染色体上。这些结果均进一步说明了小麦Dof基因数量多于其他物种的原因。
有研究发现,小麦TaZNF(Zinc finger protein,即TaDof6D)基因能够显著提高转基因拟南芥的耐盐性[28];TaDof1(即TaDof27A)基因在小麦叶片和叶鞘中具有较高的表达量,而在根中表达量较低[22]。本研究发现,大部分小麦Dof基因在不同组织中均有表达,相同基因在同一组织的不同发育时期表达模式也存在较大差异。此外,不同胁迫条件下的表达模式分析发现,小麦Dof基因广泛参与非生物和生物胁迫,在高温、干旱、旱热共胁迫条件下以及禾谷镰刀菌侵染条件下均会不同程度地被诱导表达。说明Dof基因广泛参与小麦生长发育,且在响应生物和非生物胁迫中可能发挥重要作用。

