传染性法氏囊病毒VP2蛋白的原核表达及其免疫效果评价
李甜甜,蒋大伟,姬鹏超,王银铃,张改平,3
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009)
传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的雏鸡的一种急性、高度传染性的免疫抑制性疾病[1]。自该病被发现以来,在世界各地广泛流行,随后变异毒株、强毒株及超强毒株的不断出现,使得传统疫苗不能为宿主提供有效的免疫保护,从而对养禽业造成了巨大的危害[2]。
IBDV属于双RNA病毒科、禽双RNA病毒属,其基因组由A和B 2个片段组成,共编码5种蛋白质,分别为VP1、VP2、VP3、VP4和VP5[3]。其中VP2是IBDV的主要结构蛋白和主要宿主保护性抗原,包含了诱导病毒中和抗体的抗原区域,其诱导的中和抗体能保护宿主不受IBDV感染[4-5]。此外,VP2与抗原变异和病毒毒力密切相关[6]。因此,VP2一直是研究IBD亚单位疫苗的目标蛋白。
目前,VP2蛋白已在多种表达系统中成功表达,如大肠杆菌[7]、昆虫细胞[8]、酵母[9]和植物[10]等。其中,利用杆状病毒表达系统表达的VP2蛋白具有良好的免疫原性,但生产成本高、产量低、纯化方法复杂,不易于工业生产[11-12]。相比之下,大肠杆菌表达系统具有生长速度快、操作简便、成本低、可用于发酵等优点,被广泛应用于工业生产中[13]。研究者常选择亲和层析[14]、凝胶过滤、蔗糖梯度离心[15]和氯化铯梯度离心[16]等方法纯化目的蛋白,其中亲和层析纯化的蛋白质需要经透析去除咪唑,此过程蛋白质容易发生聚集析出,不适用疫苗的制备,其他方法由于操作复杂、耗时长或需要特殊设备等问题不能应用于工业生产。而盐沉淀法[17]、离子交换层析[18]、疏水相互作用层析等具有低成本、易操作、可用于大量蛋白质纯化的特点,对于工业纯化蛋白质是很好的选择。为了获得可用于工业生产的高通量及大规模纯化VP2蛋白的方法,利用大肠杆菌表达VP2蛋白,并经饱和硫酸铵沉淀和离子交换层析等方法进行纯化以获得纯度较高的目的蛋白,并检测其免疫原性,以期为进一步研究IBD亚单位疫苗和建立IBDV检测方法提供参考。
1 材料和方法
1.1 菌株、质粒
pET28a-VP2重组质粒由河南省农业科学院动物免疫学重点室验室构建并保存,JM109感受态细胞和BL21( DE3 )感受态细胞购自上海唯地生物技术有限公司。
1.2 主要试剂
限制性内切酶BamHⅠ和XhoⅠ、DL2000 DNA Marker、λHind Ⅲ DNA Marker等均购自大连宝生物公司;IPTG、彩虹180广谱蛋白质Marker和BCA蛋白质定量试剂盒等均购自北京索莱宝科技有限公司;His-Tag单克隆抗体购自Proteintech公司;羊抗鼠IgG-HRP二抗购自Abbkine公司;超敏ECL化学发光试剂盒购自新赛美生物技术有限公司;Q SepharoseTMFast Flow和DEAE SepharoseTMFast Flow均购自GE Healthcare公司; IBDV标准阳性抗原、IBDV标准阳性抗体和IBDV标准强毒株BC6/85等均购自中国兽医药品监察所;IBDV ELISA试剂盒购自北京天之泰生物科技有限公司;其余试剂均为国产分析纯试剂。
1.3 供试动物
30只3周龄SPF鸡购自山东斯派福瑞公司。
1.4 重组表达质粒的鉴定
重组质粒(pET28a-VP2)转化至JM109感受态细胞,重组质粒用BamHⅠ和XhoⅠ内切酶进行双酶切鉴定并送公司测序。
1.5 VP2蛋白的诱导表达与鉴定
1.5.1 诱导表达 将鉴定正确的重组质粒 pET28a-VP2转化到BL21(DE3)感受态细胞,涂布于含卡那抗性的LB平板上,37 ℃倒置培养过夜,然后挑取单菌落接种到含100 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min培养至OD600约为0.5,加入诱导剂 IPTG至终浓度为0.5 mmol/L,于37 ℃培养16 h。收集培养后的菌液于10 000 r/min 离心10 min,弃去上清收集菌体,用PBS缓冲液重悬菌体,并进行超声破碎(振动频率50 Hz,工作4 s,间歇6 s,持续10 min),破碎后,于4 ℃、10 000 r/min离心20 min,分离上清与沉淀,进行SDS-PAGE,考马斯亮蓝染色并脱色,观察结果。
1.5.2 Western blot鉴定 诱导表达的蛋白质经SDS-PAGE分离后,经半干转膜法转移到PVDF膜上,5%的脱脂奶室温封闭2 h后,一抗为1∶3 000稀释的His-Tag单克隆抗体,37 ℃ 孵育1 h,PBST洗涤3次,每次5 min,二抗为1∶1 000稀释的羊抗鼠IgG-HRP,37 ℃ 孵育1 h,PBST洗涤3次,每次5 min,ECL显色液显色。
1.5.3 AGP检测 制备琼脂平板,用梅花打孔器在琼脂平板上打孔,在琼脂平板中间孔加IBDV标准阳性抗体,外周孔加IBDV标准阳性抗原和PBS稀释的VP2蛋白,且依次按1∶2、1∶4、1∶8、1∶16和1∶32进行稀释,将琼脂平板平放在湿盒内,于37 ℃温箱中孵育2~3 d,以测定VP2蛋白表达量。
1.6 VP2蛋白纯化条件的优化
1.6.1 饱和硫酸铵沉淀法纯化VP2蛋白 利用饱和硫酸铵沉淀蛋白的方法,纯化1.5.1中收获的上清。上清液中加入饱和硫酸铵溶液,至饱和硫酸铵体积百分比为10%,充分混悬,4 ℃放置10 min;10 000 r/min离心10 min,分离沉淀与上清,再向上清中继续加入饱和硫酸铵溶液,使其百分比从10%升高到20%,同上操作,依次增至30%、40%、50%、60%、70%,每次离心保留的沉淀用离子交换层析所使用的Binding Buffer进行重悬,并处理样品,进行SDS-PAGE与Western blot分析。
1.6.2 离子交换层析填料及洗脱液浓度的优化 上清液中加入饱和硫酸铵溶液至终含量为30%,4 ℃放置10 min;10 000 r/min离心10 min,沉淀用Binding Buffer(30 mmol/L PB,pH值为7.0)充分混悬,透析,除盐并使用0.45 μm的滤膜进行过滤。得到的样品分别利用DEAE SepharoseTMFast Flow(DEAE)和Q SepharoseTM Fast Flow(Q)进行纯化,流速2 mL/min,Binding Buffer平衡5个柱体积后上样,之后依次使用含200、300、500 mmol/L NaCl的缓冲液(pH值为7.0)洗脱蛋白质,收集洗脱液,进行SDS-PAGE分析。
1.6.3 离子交换层析缓冲液pH值的优化 分别使用不同pH值(6.5、7.0、7.5、8.0)的缓冲液对目的蛋白进行纯化,流速2 mL/min,Binding Buffer平衡5个柱体积后上样,之后使用含200 mmol/L NaCl的缓冲液洗脱目的蛋白,收集洗脱液,进行SDS-PAGE分析。
1.7 动物试验
将30只鸡随机分为3组,每组10只,A组:VP2蛋白;B组:VP2蛋白加MontanideTMISA 71 VG佐剂;C组:PBS阴性对照组。均采用肌肉注射的方式进行免疫,免疫剂量为200 μL(10 μg/羽),分别在免疫后的第7、14、21、28 天,翅下静脉采血并分离血清,采用IBDV ELISA试剂盒检测抗体效价。
1.8 病毒攻毒试验
在免疫28 d后,用IBDV标准强毒株BC6/85进行攻毒保护试验,攻毒剂量为10-5BID50。攻毒后观察鸡的临床症状,4 d后剖检供试鸡,观察腿肌、法氏囊等组织的病理变化,称量体质量和法氏囊质量,并计算囊重比和囊指数。囊重比=法氏囊质量/体质量×1 000;囊指数=试验组囊重比/空白对照组囊重比。
1.9 法氏囊组织学病理检测
取出鸡法氏囊组织置于10%甲醛溶液中固定,之后用石蜡包埋,切片,HE染色,观察组织病理学变化,判定法氏囊组织学损伤分数(1—4)。1分:正常的淋巴滤泡或淋巴细胞减少,无任何局灶性坏死或明显水肿的迹象;2分:中度淋巴损伤,伴有局灶性坏死;3分:严重的淋巴细胞损伤,几乎没有淋巴细胞,有网状细胞和增生的纤维组织;4分:卵泡萎缩,有明显的纤维化。
2 结果与分析
2.1 重组质粒pET28a-VP2的酶切鉴定
从活化的重组菌JM109(pET28a-VP2)菌液中提取质粒,经BamHⅠ和XhoⅠ双酶切鉴定,获得的目的片段及载体的大小分别与预期片段大小一致(图1),表明连接的重组载体pET28a-VP2构建成功。测序结果也表明,重组载体中的VP2片段序列正确。
2.2 VP2蛋白的诱导表达与鉴定
重组菌(pET28a-VP2)在37 ℃、0.5 mmol/L的IPTG诱导16 h后,离心收集菌体,超声破碎后分别收集上清与沉淀进行SDS-PAGE与Western blot检测。SDS-PAGE结果显示(图2A),在分子质量50 ku处有表达条带,与VP2蛋白预期大小一致。此外,破碎沉淀中条带更明显,说明表达的目的蛋白主要以包涵体形式出现。Western blot结果(图2B)与SDS-PAGE中的目标条带一致,表明VP2蛋白在大肠杆菌中成功表达。琼脂扩散试验结果显示(图3),表达的VP2蛋白可以与标准阳性抗体反应形成沉淀线,效价为1∶16,表明其具有良好的反应原性。
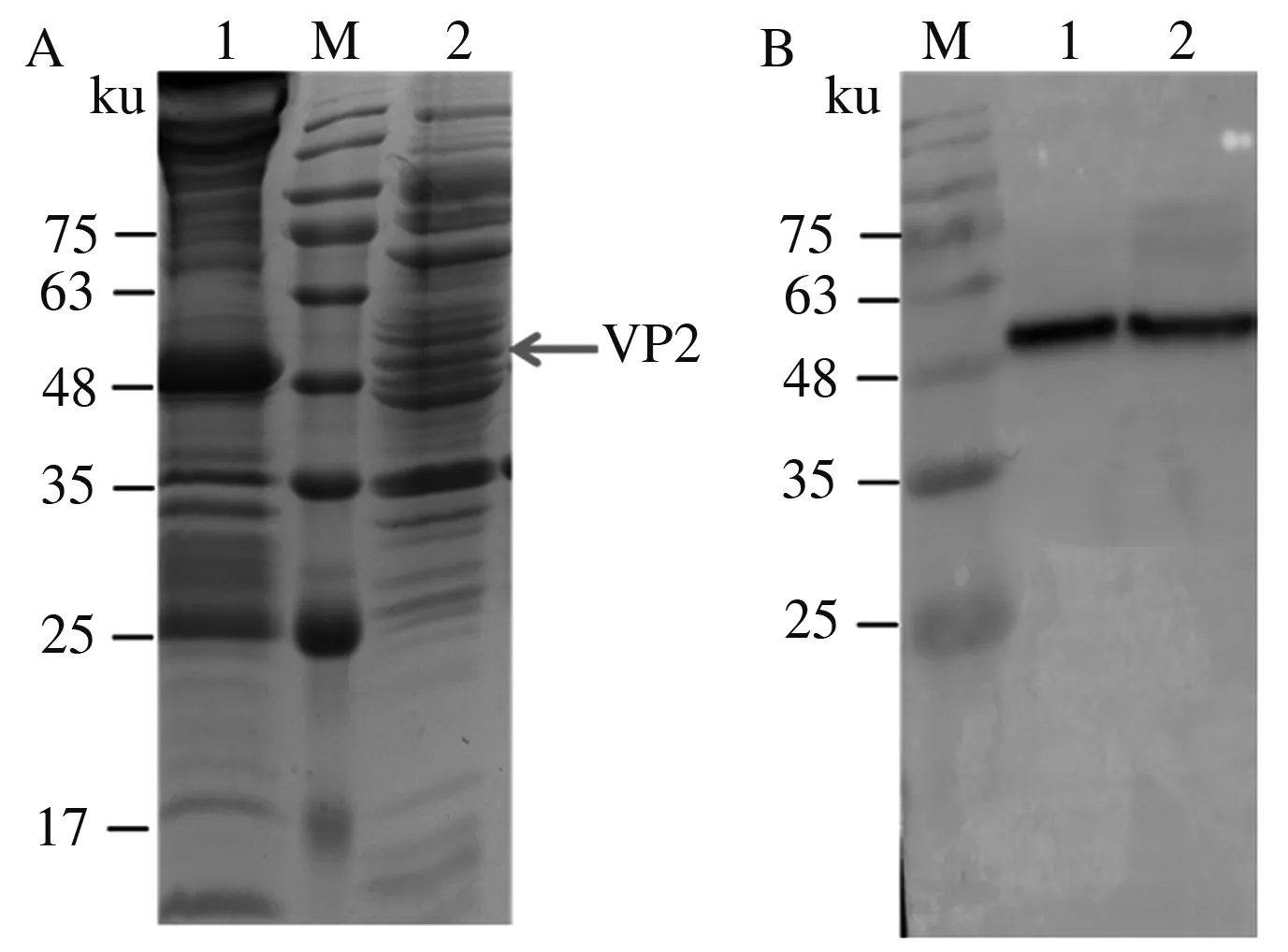
A:SDS-PAGE鉴定;B:Western blot鉴定。

0:IBDV标准阳性抗体;1:IBDV标准阳性抗原;
2.3 VP2蛋白纯化条件的优化
2.3.1 饱和硫酸铵纯化蛋白质 硫酸铵沉淀常用于蛋白质的粗纯,它根据蛋白质疏水性的不同而使其先后沉淀。不同含量的饱和硫酸铵溶液沉淀蛋白质结果显示(图4),表达的目的蛋白经30%的饱和硫酸铵溶液沉淀可除去部分杂蛋白,达到粗纯的目的。

A:SDS-PAGE鉴定;B:Western blot鉴定。M:蛋白质Marker;1:细菌裂解液上清;2—8:梯度饱和硫酸铵(10%、20%、30%、40%、50%、60%、70%)
2.3.2 填料及洗脱浓度的确定 饱和硫酸铵纯化得到的目的蛋白再分别利用DEAE SepharoseTMFast Flow和Q SepharoseTMFast Flow进行纯化。其中DEAE SepharoseTMFast Flow纯化蛋白质的SDS-PAGE结果显示(图5A),含200 mmol/L NaCl的缓冲液可洗脱目的蛋白,但不能有效去除杂蛋白,得到的目的蛋白纯度低;Q SepharoseTMFast Flow纯化蛋白质的SDS-PAGE结果显示(图5B),含200 mmol/L NaCl的缓冲液可洗脱目的蛋白,并且目的蛋白纯度较高,纯化效果良好。可见,Q SepharoseTMFast Flow适合用于纯化VP2蛋白。
2.3.3 缓冲液pH值的确定 使用不同pH值(6.5、7.0、7.5、8.0)的缓冲液纯化蛋白质,SDS-PAGE结果显示(图6A),随着缓冲液pH值的增加,洗脱的目的蛋白纯度越高,最适合纯化目的蛋白的缓冲液pH值为8.0,得到的VP2蛋白纯度最高可达到80%。Western blot结果显示(图6B),经纯化的VP2蛋白能被His-Tag单克隆抗体特异性识别,

A:DEAE SepharoseTM Fast Flow;B:Q SepharoseTM Fast Flow。M:蛋白质Marker;1:30%饱和硫酸铵;2:流穿液;3,7:200 mmol/L NaCl;4—5:300 mmol/L NaCl;6:500 mmol/L NaCl A:DEAE SepharoseTM Fast Flow;B:Q SepharoseTM Fast Flow.M:Protein Marker;1:30% saturated ammonium sulfate;2:Flow-through fluid;3,7:200 mmol/L NaCl;4—5:300 mmol/L NaCl;6:500 mmol/L NaCl

A:SDS-PAGE鉴定;B:Western blot鉴定。a—d:缓冲液pH值分别为6.5、7.0、7.5、8.0;M:蛋白质Maker;1,5:30%饱和硫酸铵;2—4,6—8:200 mmol/L NaCl;9:缓冲液pH值为8.0纯化的VP2蛋白
表明纯化的VP2蛋白具有良好的反应原性。纯化的VP2蛋白经BCA蛋白质浓度试剂盒测定,其质量浓度为0.6 mg/mL。
2.4 VP2蛋白免疫原性分析
纯化的VP2蛋白作为抗原免疫SPF鸡,并将每周采集的血清进行ELISA检测。从图7可以看出,免疫7 d后,抗原组均可检测到抗体,并且抗体滴度逐步提升,其中,VP2组到第21天时达到最高,VP2加佐剂组到第28天时达到最高。此外,在免疫14 d后,VP2加佐剂组产生的抗体滴度明显高于VP2组。这表明纯化的VP2蛋白免疫原性良好,可有效地刺激机体产生体液免疫应答。
2.5 攻毒保护试验结果
免疫28 d后进行攻毒试验,BC6/85毒株仅引起机体免疫抑制,几乎不导致死亡。在本试验中,未观察到鸡的死亡。攻毒4 d后解剖所有鸡,可见患病鸡的腿肌有出血点,法氏囊出现不同程度的肿大,表面有黄色胶冻样渗出物。攻毒保护结果显示(表1),抗原组均可以在一定程度上保护机体不受IBDV的攻击,且VP2加佐剂组比不加佐剂组产生更高的保护率,可达到80%。

图7 免疫鸡的血清抗体检测结果Fig.7 Serum antibody test results of immunized chicken

表1 攻毒保护试验结果Tab.1 Results of the Challenge protection test
2.6 法氏囊病理组织学观察
通过组织病理学评价制备的疫苗对法氏囊的保护效果(表1、图8),VP2加佐剂组有8只鸡的法氏囊组织无损伤,有长而厚的黏膜褶,黏膜由大量多面形滤泡构成(图8A),而VP2组仅有4只法氏囊组织无损伤,两组发病鸡的法氏囊主要表现为部分滤泡坏死程度较轻及周围炎性细胞浸润(图8B)。攻毒组的鸡法氏囊严重坏死,滤泡细胞基本坏死,且滤泡结构消失,周围可见较多的炎性细胞浸润(图8C)。未攻毒组中未出现法氏囊组织损伤(图8D)。
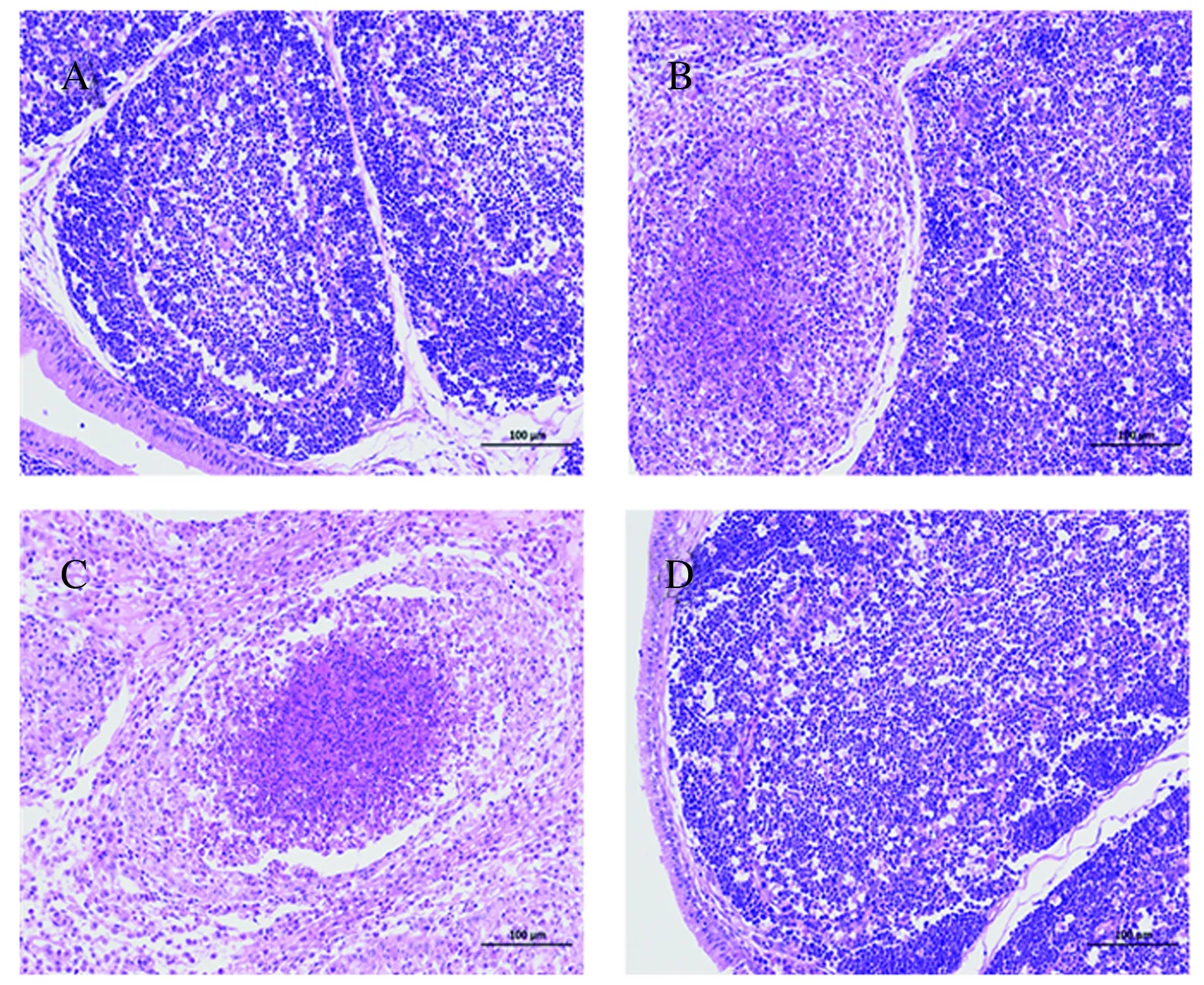
A:VP2加佐剂组;B:VP2组;C:攻毒组;D:未攻毒组
3 结论与讨论
IBDV是严重影响养禽业的一种病毒。VP2蛋白是IBDV的主要结构蛋白和宿主保护性抗原,一直是研究IBDV亚单位疫苗的靶蛋白。目前,VP2蛋白已经在多种表达系统中得到表达。其中,利用大肠杆菌表达系统表达的IBDV VP2的亚单位疫苗已经应用于临床[19]。因此,大肠杆菌表达系统在IBDV亚单位疫苗的研制中具有重要优势。本研究将构建好的pET28a-VP2的重组质粒转化至大肠杆菌BL21(DE3)中,成功表达了VP2蛋白,经AGP检测,表达的目的蛋白可以与标准阳性抗体反应形成沉淀线,表明其具有良好的反应原性。此外,VP2蛋白表达量较低,推测与表达菌株有关。
相比较于亲和层析、凝胶过滤、梯度离心等纯化方法,饱和硫酸铵与离子交换层析具有成本低、操作简单、可纯化大批量蛋白质等优点,所以本试验首先选用饱和硫酸铵溶液对VP2蛋白进行纯化。表达的目的蛋白经饱和硫酸铵溶液沉淀,可以除去部分杂蛋白质,沉淀经缓冲液充分溶解后,可使蛋白质恢复原来的特性,这是由于盐析的过程是可逆的,基本不会影响蛋白质的活性。之后再经离子交换层析进行纯化,并对纯化条件进行优化,DEAE为弱阴离子层析,Q为强阴离子层析。其中强阴离子层析的纯化效果比弱阴离子层析好,可有效地去除大部分杂蛋白质,这可能是由于强阴离子交换填料可以更有效的结合杂蛋白,从而使目的蛋白先被洗脱。此外,在一定范围内,缓冲液偏碱性比偏酸性的纯化效果好,其纯度可高达80%。经纯化的目的蛋白产量可达3.4 mg/L,高于之前利用亲和层析纯化得到的VP2[20]。此纯化方法可用于工业制备VP2蛋白。
在本试验中, VP2蛋白免疫组均产生了特异性抗体。MontanideTMISA 71 VG是一种以矿物油为基础的佐剂,安全有效,可有效增强体液与细胞免疫应答[21]。本试验将纯化的VP2蛋白与MontanideTMISA 71 VG佐剂混合制备成亚单位疫苗进行动物试验,加佐剂的VP2组较不加佐剂的VP2组产生抗体时间早,且产生的抗体滴度高,可有效地保护法氏囊组织。本试验结果显示,VP2蛋白可以刺激机体产生特异性抗体,并在一定程度上保护鸡不受强毒株的攻击,表明VP2蛋白具有良好的免疫效果。
综上,应用大肠杆菌表达系统中成功表达VP2蛋白,采用简便、低成本的纯化方法获得纯度较高且免疫原性良好的目的蛋白,为进一步研究IBD亚单位疫苗和建立IBDV检测方法提供参考。

