基于肠道菌群探讨泡菜中乳酸菌防治非酒精性脂肪肝的研究
王报贵,许海波,杜 文,王 君,孙春龙,董 彬,吴 涛,方菁菁
(1.滨州学院生物与环境工程学院,山东省黄河三角洲生态环境重点实验室,山东省黄河三角洲野生植物资源开发利用工程技术研究中心,滨州市食品安全重点实验室,山东滨州 256603;2.滨州学院体育学院,山东滨州 256603)
泡菜是一种以新鲜蔬菜为原料经微生物发酵而得到的食品,因口感清脆、富含矿物质、纤维素,成为人民日常生活中不可缺少的食物[1-2]。以乳酸菌为代表的一大类益生菌在泡菜的制作中发挥着重要的角色,它们通过生成的发酵产物来降低肠道内环境的pH,有害菌由于在较低酸度下无法生存而被抑制或被杀死,使肠道有益菌数目良性增长,从而调节了肠道菌群的稳定性和多样性[1,3-4]。泡菜中的乳酸菌在调节肠道菌群平衡中起着重要作用,而且具有一定治疗效果,可以减轻和逆转肝脏细胞损伤,极具临床价值。在未来,以乳酸菌为代表的益生菌极有可能是控制肠道微生物群稳定的安全和有效的治疗工具[5-7]。
非酒精性脂肪肝病是除大量饮酒之外的其他肝损伤因素导致的临床上的病理综合征,其特点是肝细胞损伤[8],脂肪沉积[9],肠道菌群紊乱失调[10]。研究报道非酒精性脂肪肝病(NAFLD)会造成体内肝脂水平升高和肠道菌群紊乱[9,11]。虽然没有充分解释NAFLD的发生机制,但肠道内菌群的不平衡[12]与该疾病的发生密切相关[10]。近年来研究人员们普遍接受的说法是包括遗传性因素、饮食因素以及代谢因素、肥胖因素等作用综合而成的“多重打击学说”[5,11]。所以通过改变生活方式可以在一定程度上控制NAFLD的发生和进展,尤其是可以利用调节饮食因素。Han等[12]的研究表明发酵的泡菜可以使一些有益菌相对丰度增加,有害菌相对丰度减少,这就表明了发酵泡菜对肠道菌群的确具有有益的调节作用。陈文瀚等[13]的研究得出结论:肠道菌群这一指标在健康人与NAFLD患者之间存在显著差异,这种差异可以通过乳酸菌补充剂来减少,使症状有所缓解。以上报道发现肠道细菌与非酒精性脂肪肝之间有密切联系。因此,把肠道菌群作为靶点来研制药物便成为现代医学治疗和缓解NAFLD的主要致力方向[14]。研究表明益生菌可通过调节动物肠道内菌群的平衡,起到减轻肝脂变动物肝脏损伤和降低血脂[15],最终有助于NAFLD的控制和治疗,但并未有具体的菌株报道[16-18],本文意在筛选出对NAFLD疾病防治有益的确切菌株。
鉴于此,本论文拟通过采用蛋氨酸-胆碱缺乏饲料(Methionine-choline deficient diet,MCD)喂食C57BL/6J小鼠,成功构建NAFLD疾病小鼠模型,进一步检测从泡菜中分离得到的益生菌对患病小鼠肠道平衡性、脂质沉积、肝功能和炎症因子水平的影响,从而初步确定在泡菜中提取的益生菌对于NAFLD小鼠的肠道菌群和肝脏的作用。本研究将对证实肠道菌群可作为寻找和防治NAFLD药物的新靶点产生实质性意义,同时为未来开发和研制NAFLD的靶向治疗药物提供攻关方向。
1 材料与方法
1.1 材料与仪器
无特定病原体(Specified pathogens free,SPF)级C57BL/6J雄性小鼠,7-8周龄 济南朋悦实验动物繁育有限公司[许可证号:SCXK(鲁)20140007];MCD、MCS饲料 南通特洛菲饲料科技有限公司(饲料代码为TP3005G);维持饲料 济南朋悦实验动物繁育有限公司[许可证号:SCXK(鲁)20180003];MRS固体培养基 生工生物工程股份有限公司;MRS肉汤培养基 北京奥博星生物技术有限公司;Slanetz-Bartley培养基、麦康凯琼脂培养基 北京索莱宝科技有限公司;GAM厌氧培养基 上海西宝生物科技有限公司;市售泡菜 吉林市咕咕熊食品有限责任公司;白细胞介素6(IL-6)、肿瘤坏死因子(TNF-α)、谷草转氨酶(ALT)、谷丙转氨酶(AST)和碱性磷酸酶(ALP)ELISA试剂盒 南京建成生物工程研究所;TG和TC试剂盒 日本协和医药诊断株式会社。
DHP-9052型电热恒温培养箱 中仪国科科技有限公司;BKQ-B50II型全自动高压蒸汽灭菌锅 山东博科生物产业有限公司;ZD-85型数显气浴恒温振荡器 成都市宜邦科析仪器有限公司;TDZ4-WS型台式低速离心机 湖南赫西仪器装备有限公司;SW-CJ-2D型双人单面净化工作台 苏州净化设备有限公司;GFL-70型电热鼓风干燥箱 天津市莱玻特瑞仪器设备有限公司;DNM-9602型酶标分析仪 北京普朗新技术有限公司。
1.2 实验方法
1.2.1 NAFLD模型的建立 采用MCD喂食C57BL/6J雄性小鼠,构建NAFLD疾病小鼠模型。SPF级C57BL/6J雄性小鼠30只,7~8周龄,每只(20±2) g,饲养于本部屏障环境内,温度22~25 ℃,湿度50%,12 h昼夜交替适应性喂养1周后,根据随机数字表法分为2组:对照组(10只)和模型组(20只),模型组喂食MCD饲料,对照组喂食MCS饲料。实验周期为6周,期间动物自由饮水、摄食。采用肝脏苏木精-伊红染色(HE)、TG和TC含量测定和免疫因子测定等多种生物学方法确定脂变模型的建立[19]。
1.2.2 泡菜中益生菌的分离与鉴定 采用平板涂布法进行分离。
1.2.2.1 分离方法 用天平精确称取50 g泡菜样品,加入和样品等比例的无菌PBS缓冲液,在室温下充分粉碎混匀,使其自然沉淀。吸取1 mL上清液放入含有9 mL PBS缓冲液的试管中,梯度稀释至10-2~10-6浓度后,均匀涂布于MRS固体培养基上。于37 ℃恒温厌氧培养箱内倒置培养48 h后观察菌株生长情况。
1.2.2.2 菌种的鉴定 通过分离纯化,得到一株优势菌株,利用16S rDNA分子生物学特征鉴定。根据V3区两端保守区设计引物,则能够扩增细菌V3区相对应的可变区片段,测序分析比较来初步确定菌种的位置。设计引物为 F:5′-AGAGTTTGATCCTGGC TCAG-3′,R:5′-GGCTACCTTGTTACGACTT-3′。以待测菌基因组为模板进行PCR扩增,反应体系:pfu mix 5 μL,上游引物0.5 μL,下游引物0. 5 μL,ddH2O 3 μL,DNA模板1 μL。PCR扩增反应程序为:95 ℃ 10 min;然后于95 ℃ 10 min,55 ℃ 30 s,72 ℃ 3 min,扩增30个循环;72 ℃ 10 min。PCR扩增后,用1%的琼脂糖凝胶电泳检测,得到目的条带后,PCR产物经胶回收后克隆到T载体上由英潍捷基贸易有限公司进行序列的测定。
1.2.2.3 系统树建立方法 测序获得的16S rRNA基因的序列,分别登录EzBioCloud数据库(http://www.ezbiocloud.net/)与NCBI数据库(https://www.ncbi.nlm.nih.gov/),分别进行序列比对。系统发育分析采用MEGA 5.0软件进行多序列匹配排列,使用MEGA 5.0软件的Kimura2-parameter方法计算进化距离,使用Neighbor-joining方法,1000次随机抽样,构建系统发育树,以自引导值(Bootstrap)表示系统发育树的可信度,构建系统发育树。
1.2.3 菌液浓度的确定 增菌方法:将分离得到的菌种接种到MRS液体培养基增菌,37 ℃厌氧培养,等到对数生长期时转种到锥形瓶里扩大培养,瓶底可见白色菌体沉淀。取锥形瓶中的浑浊液适量于50 mL离心管中,用台式离心机以10000 r/min离心5 min。取出后用PBS缓冲液洗涤。后续再次离心处理,使得到的上清液与沉淀重悬,最终得到菌液。将菌液以10倍梯度稀释至10-2~10-6浓度,涂布于MRS固体培养基上培养,待菌落长出后计数并确定菌液浓度。
1.2.4 小鼠的灌胃试验 NAFLD模型建立成功后,用于实验的益生菌浓度为107cfu/mL。用该浓度菌液对小鼠进行灌胃调节,连续6周。肝脂变模型组小鼠分为自然恢复组和实验组。对照组和自然恢复组灌胃无菌PBS缓冲液,实验组给予益生菌菌液灌胃,灌胃剂量0.3 mL/10 g体重/每天,每日一次,固定时间。实验过程中均无小鼠死亡。
1.2.5 活菌计数法选择性培养小鼠肠道菌 各组小鼠的粪便每隔2周收集一次,整个实验周期内共收集4次粪便,分别为灌胃前、灌胃2周、灌胃4周和灌胃6周。若不当天使用,采集的粪便应先加入适量30%甘油保存在冰箱中。具体操作步骤如下:称取各组粪便0.1 g于洁净的EP管中,与0.9 mL PBS混匀后将该混合液制备成10-2~10-8不同浓度梯度的稀释液,各取200 μL涂布于不同的选择培养基进行相应菌的培养:a. 添加莫匹罗星的MRS琼脂培养基用于双歧杆菌的筛选(在37 ℃下厌氧孵育36 h);b. 不含L-半胱氨酸的MRS琼脂用于乳酸杆菌的筛选(厌氧,37 ℃,24 h);c. Slanetz-Bartley培养基用于肠球菌的筛选(需氧,37 ℃,24 h);d. 麦康凯琼脂培养基用于肠杆菌的筛选(需氧,37 ℃,24 h);e. 改良的岐阜厌氧(GAM)琼脂培养基用于脆弱拟杆菌的筛选(需氧,37 ℃,24 h),待平板上长出菌落后,用平板菌落计数法计算每克粪便中对应的菌落数[20]。
1.2.6 肝脏外观和组织学观察 在整个灌胃周期结束后,采用眼球取血法将小鼠处死,并立即对其进行解剖。待完整分离小鼠肝脏和腹部脂肪后,将其放置于清洁平面上进行对比观察,拍照记录。腹部脂肪重量=肾周脂肪重量(g)+附睾脂肪重量(g),脂肪指数(%)=腹部脂肪重量/实验末老鼠体重,观察后将肝脏组织保存,用于后续进行HE染色[21]。
1.2.7 血清肝功能、血脂和炎症因子的检测 摘眼球取血法采集的血液放在血样室,室温静置30 min后,3500 r/min离心10 min,分离血清。得到的血清分别用于肝功(ALP、AST和ALT)、血脂(TG和TC)和炎症因子(IL-6和TNF-α)的检测,具体检测方法参考ELISA试剂盒说明书。
1.3 数据处理
本研究获得的数据均采用SPSS 19.0软件进行统计处理,两组之间采用t检验。P<0.05为显著性差异,P<0.01为极显著差异,具有统计学意义。
2 结果与讨论
2.1 NAFLD模型的建立
通过观察外观发现,MCS喂养的对照组肝表面颜色为暗红色、色泽鲜亮,边缘比较清晰,没有脂肪感(图1A);MCD喂养的模型组肝脏的颜色偏黄,体积明显变大,切面具有脂肪感(图1B)。HE染色发现,对照组肝组织结构完整清晰、肝小叶无异常,肝细胞呈现索状排布,以放射状环绕在中央静脉周围;细胞核大而圆,细胞质在胞内分布均匀,不见脂肪滴(图1C);MCD模型组中肝脏细胞变化明显,细胞质疏松;肝细胞排序混乱;细胞肿大,不见索状排列,变圆;能看到较多的脂肪滴(图1D)。这说明NAFLD模型建立成功,可用于后续实验。

图1 肝脏的外观和HE染色
2.2 菌株鉴定
分别在EzTaxon server和NCBI中对菌株的16S rDNA基因进行比对分析,结果发现,与待测菌株相似度最高的菌株均为植物乳杆菌(Lactobacillusplantarum),相似度为99.02%。分别选取相似度高的模式菌株的16S rRNA基因,以AcetobacteracetiNBRC 14818T为外围参考菌株,构建系统发育树,如图2所示,待测菌株01与LactobacillusplantarumL71T聚到一簇,因此将待测菌株鉴定为植物乳杆菌。

图2 基于16S rRNA基因的系统发育树
2.3 灌胃植物乳杆菌对NAFLD对小鼠肠道菌群稳态的影响
图3A表明,肝脂变小鼠灌胃植物乳杆菌后,从灌胃4周开始可显著提高双歧杆菌的数量,随着灌胃时间的增加,双歧杆菌的数量进一步增多并显著高于自然恢复组(P<0.05),并且灌胃第4周后实验组双歧杆菌的数量超过对照组,说明灌胃植物乳杆菌可以促进肠道益生菌双歧杆菌的增殖,使其恢复到健康小鼠水平。灌胃实验对乳酸杆菌的数量的影响与对双歧杆菌的影响类似(图3B)。而通过对图3的分析发现灌胃植物乳杆菌还可以降低肠球菌(图3C)、肠杆菌(图3D)和脆弱拟杆菌(图3E)的数量。结果表明摄入从泡菜中提取的益生菌(植物乳杆菌)可以使肠道微生态紊乱状态得到改善。

图3 肝脂变小鼠灌胃植物乳杆菌对肠道菌群丰富度的影响
2.4 肝脏病理学检测
观察肝脏外观发现,正常组肝表面颜色通常是暗红色,通体发亮,边缘清晰,没有脂肪感(图4A);自然恢复组肝脏的颜色发黄,肝脏较大,切面有脂肪感,边缘圆润,但较之灌胃前已有所改善(图4C)。实验组肝脏恢复状态较好,呈现暗红色,边缘清晰,几乎与正常肝脏无异(图4B)。

图4 肝脂变小鼠灌胃后肝脏外观、HE染色和TG含量
由图4可知,肝脏HE染色的对照组肝组织结构完整清晰、肝小叶无异常,肝细胞呈现索状排布,以放射状环绕在中央静脉周围;对照组细胞核大而圆,细胞质在胞内分布均匀,不见脂肪滴,TG含量仅为0.83 mg/g prot,TC含量为0.47 mg/g prot;实验组、自然恢复组均有肝脂变情况,肝细胞变圆,排列无序,细胞质疏松且内含脂肪滴,自然恢复组脂肪滴较大;自然恢复组TG和TC含量分别为(2.99和1.38 mg/g prot)显著高于实验组(P<0.05)和对照组(P<0.01),实验组也有脂肪滴存在,但相对脂肪含量较少(TG:1.36 mg/g prot,TC:0.63 mg/g prot)。实验组细胞质分布均匀度比自然恢复组好,但仍次于对照组。这表明泡菜中的益生菌对肝脏病理状态确有改善,但仍不能使肝脏内脂质的含量恢复到正常肝脏的水平,这很有可能是由于灌胃周期短造成的,可进一步延长实验时间。
2.5 脂肪组织病理学检测
机体内脂肪的大小和多少是衡量机体脂肪含量的重要标志。通过对小鼠腹部脂肪HE染色可见:实验组的小鼠腹部脂肪(图5B)体积明显小于自然恢复组(图5C),说明实验组脂肪变形程度降低;但其脂肪体积略大于对照组(图5A),说明灌胃益生菌可降低腹部脂肪体积,并使得实验组老鼠的腹部脂肪含量接近正常健康小鼠体内脂肪水平(表1)。

图5 肝脂变小鼠灌胃后腹部脂肪HE染色

表2 灌胃后小鼠血清肝功能指标检测

表3 灌胃后小鼠血清TG、TC、IL-6,TNF-α含量的影响
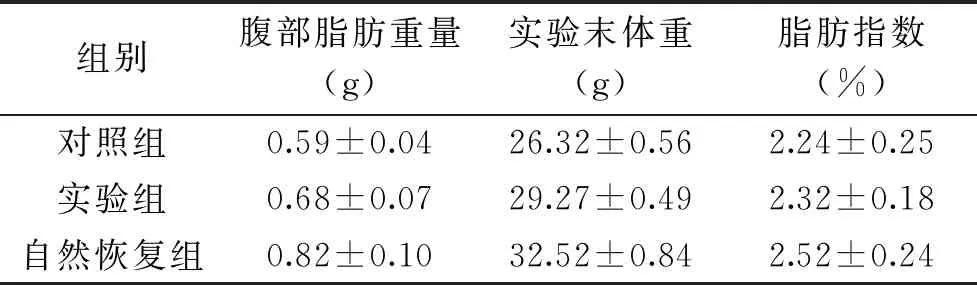
表1 灌胃后小鼠腹部脂肪含量
2.6 血清肝功能指标检测
灌胃6周后,实验组血清中ALT和AST水平与对照组不具有显著性差异(P>0.05);但与自然恢复组相比,血清中ALT和AST水平分别降低了0.42倍和0.23倍,具有显著性差异(P<0.05),说明灌胃植物乳杆菌能使肝脂变小鼠血清中ALT和AST基本恢复到健康小鼠血清中水平。实验组血清中ALP水平,与对照组相比明显增加,具有显著性差异(P<0.05),与自然恢复组相比其含量有着显著性降低(P<0.05)。
2.7 对小鼠血清TG、TC、IL-6,TNF-α含量的影响
通过对血清中血脂和炎症水平检测发现,肝脂变小鼠灌胃益生菌后血清中TG和TC的含量与对照组相比分别降低了0.39倍和0.38倍(P<0.05),与自然恢复组相比增加了0.59倍和0.09倍;实验组老鼠血清中IL-6和TNF-α的含量与对照组相比不具有显著性差异(P>0.05),但与自然恢复组相比分别降低了0.39倍和0.33倍,具有显著性差异(P<0.05)。说明MCD饮食造成血清中TG和TC水平降低,灌胃益生菌能促进血脂水平恢复到正常健康小鼠水平,并且能使血清中炎症因子含量降低。
3 结论和讨论
在NAFLD常规治疗的基础上,患者服用含有乳酸菌、双歧杆菌或枯草芽孢杆菌的益生菌可显著降低血液中ALT、AST水平,使肝损伤和肝纤维化程度减轻[22-23]。但是未有从膳食上改善NAFLD疾病的进展,如果通过日常膳食就可以避免NAFLD的发生将会大大降低该疾病的发生和发展。本文研究发现从泡菜中分离得到的植物乳杆菌可以显著提高小鼠粪便中双歧杆菌和乳酸杆菌的丰富度,降低肠球菌、肠杆菌和脆弱拟杆菌的数量;从而表明日常生活中食用泡菜对肠道菌群的紊乱有着积极作用,进一步能增强肠道屏障功能的作用。实验中进一步发现摄食MCD饲料的肝脂变模型小鼠体重减轻明显,并且实验发现肝脂变模型老鼠肝脏中TG和TC含量显著高于对照组,但是血清中TG和TC含量却明显低于对照组,通过灌胃植物乳杆菌6周后实验组血清中脂质水平虽然与自然恢复组相比有一定程度的恢复,但是与对照组相比仍然未恢复到正常水平。分析原因主要是由于MCD饲料中缺乏蛋氨酸和胆碱从而导致了磷脂的合成受阻,而磷脂又是极低密度脂蛋白(Very low density lipoprotein,VLDL)的重要组成成分之一,磷脂的合成量减少使得肝脏中VLDL的合成和分泌量降低,导致了TG大剂量的积累在肝脏中而减少了运输到血液中,从而导致了肝脏内TG水平升高、血清中TG水平的降低[24-25]。
本研究通过进一步对血清中肝功能(ALT、ALP和AST),肝脂和血脂水平的检测发现分离得到的植物乳杆菌具有减少肝脏内脂质积累和增强肝功能的作用,该项研究与报道的副干酪乳杆菌[26]的作用相一致:副干酪乳杆菌能促进M2型Kupper细胞的极化,减少肝脂肪沉积和血清中的ALT水平,从而改善肝功能指标。郑贤干等[27]的研究发现应用双歧杆菌三联活菌胶囊可以治疗NAFLD,使得患者血清中IL-6和TNF-α炎症因子的水平显著降低,本文的研究印证了植物乳杆菌也具有降低炎症因子的表达作用,从而保护肝脏并延缓NAFLD疾病的进展。结果表明泡菜作为传统发酵食品,其在NAFLD的治疗中发挥着重要作用,有着光明的开发和应用前景。

