LncRNA DDX11-AS1通过靶向miR-497-5p调控胃癌细胞增殖、迁移和凋亡的机制研究
辛小敏 王秀敏 黄宏春
河南省安阳市人民医院消化内科(455000)
背景:LncRNA在胃癌中表达上调或下调,其在胃癌发生、发展中的作用机制尚未完全阐明。目的:探讨LncRNA DDX11-AS1通过靶向miR-497-5p表达来调控胃癌细胞增殖、迁移、凋亡的机制。方法:采用qRT-PCR检测胃癌组织和细胞株中DDX11-AS1和miR-497-5p的表达,Pearson法分析胃癌组织中DDX11-AS1与miR-497-5p的相关性。将胃癌HGC-27细胞随机分为NC组、si-con组、si-DDX11-AS1组、miR-con组、miR-497-5p组、si-DDX11-AS1+anti-miR-con组、si-DDX11-AS1+anti-miR-497-5p组。MTT法检测细胞增殖情况;流式细胞术检测细胞凋亡情况;Transwell实验检测细胞迁移和侵袭能力;双萤光素酶报告系统验证DDX11-AS1与miR-497-5p的靶向调节关系;蛋白质印迹法检测cyclin D1、cleaved caspase-3、MMP-2、MMP-9蛋白表达。结果:胃癌组织和细胞株中DDX11-AS1表达显著升高(P<0.05),而miR-497-5p表达显著降低(P<0.05),DDX11-AS1与miR-497-5p呈负相关(r=-0.754,P<0.05)。干扰DDX11-AS1表达或上调miR-497-5p表达可显著抑制胃癌细胞增殖、迁移和侵袭(P<0.05),诱导细胞凋亡(P<0.05),cyclin D1、MMP-2、MMP-9表达显著降低(P<0.05),cleaved caspase-3表达显著升高(P<0.05)。双萤光素酶报告实验证明DDX11-AS1可负向调控miR-497-5p的表达和活性。抑制miR-497-5p表达可逆转干扰DDX11-AS1表达对胃癌细胞生物学行为的影响。结论:干扰LncRNA DDX11-AS1表达能通过靶向结合并上调miR-497-5p的表达而抑制胃癌细胞增殖、迁移和侵袭,并诱导细胞凋亡。
胃癌是临床常见恶性肿瘤之一,其发病率逐年上升,目前临床主要采用手术、化疗等手段进行治疗,但术后复发率较高[1]。故深入探讨胃癌的发生、发展机制并寻找新型分子标志物对提高治疗效果具有重要意义。目前认为长链非编码RNA(long non-coding RNA, LncRNA)异常表达与胃癌的发生、发展密切相关[2]。有研究[3]发现,LncRNA DDX11-AS1可直接靶向miR-873/CLDN7轴加速结直肠癌进展。DDX11-AS1在肝细胞癌中高表达并可能成为肝细胞癌治疗的潜在靶点[4]。但DDX11-AS1在胃癌发生、发展中的作用机制尚未见相关报道。通过DIANA预测发现DDX11-AS1可能靶向微小RNA-497-5p(miR-497-5p)。有研究[5]表明miR-497-5p在子宫内膜癌组织中低表达并可能参与癌症发生、发展进程。张君等[6]的研究发现,miR-497-5p可通过靶向调控IKCa1表达来抑制宫颈癌细胞增殖情况。目前胃癌中DDX11-AS1对miR-497-5p的靶向调控作用尚未完全明确。本研究通过在胃癌细胞中干扰DDX11-AS1或miR-497-5p表达,旨在探讨DDX11-AS1对胃癌细胞增殖、迁移、侵袭和凋亡的影响,以及对miR-497-5p的调控机制,从而为揭示胃癌发病机制、基因靶向治疗提供新方向。
材料与方法
一、主要材料与试剂
人胃黏膜上皮细胞GES-1与胃癌细胞株MKN-45、BGC-823、MGC-803、HGC-27均购自美国ATCC公司。DMEM培养基、胰蛋白酶均购自美国Gibco公司;Lipofectamine 2000购自美国Thermo Fisher公司;DDX11-AS1小分子干扰RNA(si-DDX11-AS1)、无意义阴性序列(si-con)、miR-497-5p模拟物(mimics)、阴性对照(miR-con)、miR-497-5p特异性寡核苷酸抑制剂(anti-miR-497-5p)及其阴性对照(anti-miR-con)均购自上海吉玛制药技术有限公司;Trizol、反转录试剂盒、SYBR Green试剂盒购自日本TaKaRa公司;甲基噻唑基四唑(MTT)购自武汉艾美捷科技有限公司;细胞凋亡检测试剂盒购自北京索莱宝科技有限公司;Transwell小室购自上海泽迈生物技术有限公司;Matrigel基质胶购自上海钰博生物科技有限公司;BCA蛋白定量试剂盒购自南京森贝伽生物科技有限公司;兔抗人细胞周期蛋白D1(cyclin D1)、活化的caspase-3(cleaved caspase-3)、基质金属蛋白酶-2(MMP-2)、MMP-9抗体购自美国Santa Cruz公司;HRP标记的山羊抗兔二抗购自美国Abcam公司。
二、组织来源
选取2018年2月—2019年3月河南省安阳市人民医院诊治的20例胃癌患者,其中男12例,女8例,平均年龄(56.36±13.36)岁。诊断经病理检查证实。癌旁组织取自距癌灶边缘5 cm处的正常组织,置于-80 ℃超低温冰箱内保存。
三、方法
1. 细胞转染和分组:人胃黏膜上皮细胞GES-1与胃癌细胞株MKN-45、BGC-823、MGC-803、HGC-27培养于含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2培养箱中培养。待细胞生长融合度达70%时进行转染,转染前更换为不含胎牛血清的DMEM培养基。将胃癌HGC-27细胞随机分为NC组(未经任何处理的细胞)、si-con组(转染si-con)、si-DDX11-AS1组(转染si-DDX11-AS1)、miR-con组(转染miR-con)、miR-497-5p组(转染miR-497-5p mimics)、si-DDX11-AS1+anti-miR-con组(共转染si-DDX11-AS1与anti-miR-con)、si-DDX11-AS1+anti-miR-497-5p组(共转染si-DDX11-AS1与anti-miR-497-5p),具体步骤严格按照转染说明书进行。转染6 h后更换为含有10%胎牛血清的DMEM培养基,继续培养48 h。
2. qRT-PCR法检测DDX11-AS1、miR-497-5p表达:收集胃癌及其癌旁组织、GES-1、MKN-45、BGC-823、MGC-803、HGC-27细胞以及成功转染后的HGC-27细胞,Trizol法提取总RNA,反转录成cDNA。DDX11-AS1正向引物:5’-TCT ACC TAC CTG TGC GTG GCA-3’,反向引物:5’-CAA GGT AGA TCA GGC TAC CC-3’; β-actin正向引物:5’-TGC TGT CCC TGT ATG CCT CT-3’,反向引物:5’-TGA TGT CAC GCA CGA TTT-3’;miR-497-5p正向引物:5’-CCT TCA GCA GCA CAC TGT GG-3’,反向引物:5’-CAG TGC AGG GTC CGA GGT AT-3’;U6正向引物:5’-ATT GGA ACG ATA CAG AGA AGA TT-3’,反向引物:5’-GGA ACG CTT CAC GAA TTT G-3’,引物由生工生物工程(上海)股份有限公司设计合成。PCR反应体系:SYBR Green Master Mix 10 μL,正、反向引物各0.8 μL,cDNA 1 μL,ddH2O补足体系至20 μL。反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共循环40次。DDX11-AS1以β-actin为内参,miR-497-5p以U6为内参,采用2-ΔΔCt法计算目的基因相对表达量。
3. MTT法检测细胞增殖:收集各组对数生长期胃癌HGC-27细胞,制备单细胞悬液(3×104个/mL)接种于96孔板(200 μL/孔),分别于转染24 h、48 h、72 h时每孔加入20 μL MTT溶液,室温孵育4 h,弃上清液,加入150 μL DMSO,低速振荡,上酶标仪检测波长490 nm处的吸光度值(A值)。
4. 流式细胞术检测细胞凋亡:取各组对数生长期胃癌HGC-27细胞,0.25%胰蛋白酶消化细胞,室温条件下1 000 r/min离心5 min,弃上清液,PBS洗涤,加入500 μL结合缓冲液,加入5 μL Annexin V-FITC,充分混匀,加入5 μL PI,室温避光孵育,应用流式细胞仪检测细胞凋亡率。
5. Transwell实验检测细胞迁移和侵袭:取对数生长期胃癌HGC-27细胞,0.25%胰蛋白酶消化后制备单细胞悬液(不含血清的DMEM培养基),调整细胞密度(5×104个/mL),接种于Transwell小室的上室(200 μL/孔)。Transwell小室的下室中加入600 μL含10%胎牛血清的培养基,置于37 ℃、5% CO2培养箱内培养24 h,PBS洗涤,多聚甲醛溶液固定,PBS洗涤后行0.1%结晶紫染色,显微镜下随机选取5个视野,观察迁移细胞数。
Matrigel基质胶稀释液(以预冷培养液按照9∶1的比例进行稀释)平铺于Transwell小室上室,置于37 ℃、5% CO2培养箱中孵育5 h,后续实验步骤同上述细胞迁移实验,显微镜下随机选取5个视野观察侵袭细胞数。
6. 双萤光素酶报告基因检测:通过DIANA预测到DDX11-AS1可能靶向miR-497-5p,利用基因突变技术将结合位点进行突变,将结合位点与突变位点分别载入萤光素酶报告基因载体构建的野生型WT-DDX11-AS1载体和突变型载体MUT-DDX11-AS1,分别与miR-497-5p mimics、miR-con共转染胃癌HGC-27细胞并分为WT-DDX11-AS1+miR-con组、WT-DDX11-AS1+miR-497-5p组、MUT-DDX11-AS1+miR-con组和MUT-DDX11-AS1+miR-497-5p组。为验证DDX11-AS1对miR-497-5p表达的调控作用,将胃癌HGC-27细胞分为si-con组、si-DDX11-AS1组、pcDNA组(转染空质粒)、pcDNA-DDX11-AS1组(转染DDX11-AS1过表达质粒)。转染24 h后检测细胞相对萤光素酶活性。
7. 蛋白质印迹法检测cyclin D1、MMP-2、MMP-9、cleaved caspase-3蛋白表达:收集各组胃癌HGC-27细胞,提取细胞总蛋白,采用BCA法定量蛋白浓度。取30 μg蛋白行SDS-PAGE电泳,将分离的蛋白凝胶转移至PVDF膜,5%脱脂奶粉封闭2 h,加入一抗(工作浓度为1∶1 000)4 ℃孵育过夜,TBST洗涤,加入二抗稀释液(1∶2 000),摇床上孵育1 h,TBST洗涤,曝光,显影,应用凝胶成像分析系统和Image J软件分析各条带灰度值。
四、统计学分析
结 果
一、DDX11-AS1和miR-497-5p在胃癌组织中的表达及其相关性分析
与癌旁组织相比,胃癌组织中DDX11-AS1表达显著升高(P<0.05),而miR-497-5p表达显著降低(P<0.05;表1)。Pearson相关性分析结果显示DDX11-AS1与miR-497-5p呈负相关(r=-0.754,P<0.05)。

表1 DDX11-AS1和miR-497-5p在胃癌组织中的表达
二、胃癌细胞株中DDX11-AS1和miR-497-5p的表达
与GES-1细胞相比,胃癌MKN-45、BGC-823、MGC-803、HGC-27细胞中DDX11-AS1表达显著升高(P<0.05),而miR-497-5p表达显著降低(P<0.05;表2),其中DDX11-AS1在胃癌HGC-27细胞中的表达相对较高,因而选择胃癌HGC-27细胞行后续实验研究。

表2 胃癌细胞中DDX11-AS1和miR-497-5p的表达
三、干扰DDX11-AS1表达对胃癌HGC-27细胞增殖和凋亡的影响
qRT-PCR法结果显示,与si-con组相比,si-DDX11-AS1组胃癌HGC-27细胞中DDX11-AS1表达显著降低(P<0.05;表3)。与si-con组相比,si-DDX11-AS1组胃癌HGC-27细胞增殖活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),cyclin D1蛋白表达显著降低(P<0.05),cleaved caspase-3蛋白表达显著升高(P<0.05),而si-con组与NC组相比无明显差异(P>0.05;图1、表3)。

表3 下调DDX11-AS1表达对胃癌HGC-27细胞增殖和凋亡的影响

1 Da=0.992 1 u
四、干扰DDX11-AS1表达对胃癌HGC-27细胞迁移和侵袭的影响
与si-con组相比,si-DDX11-AS1组胃癌细胞迁移、侵袭数均显著减少(P<0.05),MMP-2、MMP-9蛋白表达显著降低(P<0.05;图2、表4)。

表4 干扰DDX11-AS1表达对胃癌HGC-27细胞迁移和侵袭的影响

A:Transwell法检测细胞迁移和侵袭;B:蛋白质印迹法检测MMP-2和MMP-9表达
五、DDX11-AS1靶向调控miR-497-5p表达
DIANA预测显示DDX11-AS1与miR-497-5p存在互补的核苷酸序列(图3)。双萤光素酶报告实验结果显示,与WT-DDX11-AS1+miR-con组相比,WT-DDX11-AS1+miR-497-5p组萤光素酶活性显著降低(P<0.05);与MUT-DDX11-AS1+miR-con组相比,MUT-DDX11-AS1+miR-497-5p组萤光素酶活性无明显差异(P>0.05;表5)。qRT-PCR法检测结果显示,与si-con组相比,si-DDX11-AS1组miR-497-5p表达显著升高(P<0.05);与pcDNA组相比,pcDNA-DDX11-AS1组miR-497-5p表达显著降低(P<0.05;图4)。表明DDX11-AS1能特异性结合miR-497-5p并调控其表达。

图3 DDX11-AS1与miR-497-5p存在互补的核苷酸序列

*与si-con组比较,P<0.05;#与pcDNA组比较,P<0.05

表5 双萤光素酶报告实验
六、转染miR-497-5p对胃癌HGC-27细胞的抑制作用
与miR-con组相比,miR-497-5p组胃癌HGC-27细胞中miR-497-5p mRNA表达显著升高(P<0.05),提示转染成功。与miR-con组相比,miR-497-5p组胃癌HGC-27细胞活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),迁移和侵袭细胞数显著减少(P<0.05),cyclin D1、MMP-2、MMP-9蛋白表达显著降低(P<0.05),cleaved caspase-3蛋白表达显著升高(P<0.05;表6、图5)。
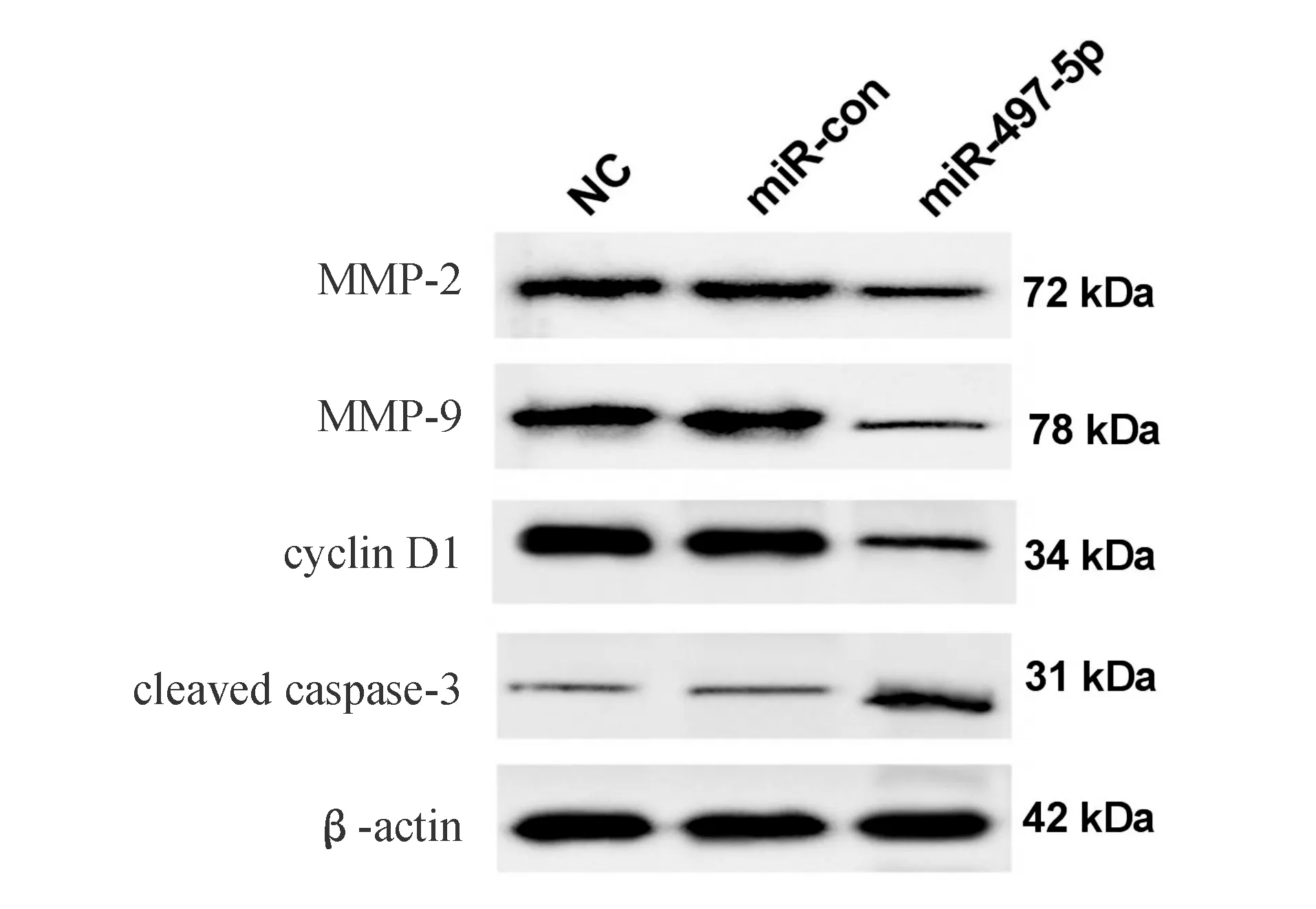
图5 转染miR-497-5p对胃癌HGC-27细胞中MMP-2、MMP-9、cyclin D1和cleaved caspase-3蛋白表达的影响(蛋白质印迹法)

表6 转染miR-497-5p可抑制胃癌HGC-27细胞增殖、迁移、侵袭和诱导凋亡
七、沉默DDX11-AS1表达和干扰miR-497-5p表达对胃癌细胞生物学行为的影响
与si-DDX11-AS1+anti-miR-con组相比,si-DDX11-AS1+anti-miR-497-5p组胃癌HGC-27细胞活力显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),迁移和侵袭细胞数显著增加(P<0.05),cyclin D1、MMP-2、MMP-9蛋白表达显著升高(P<0.05),cleaved caspase-3蛋白表达显著降低(P<0.05;图6、表7)。

表7 沉默DDX11-AS1表达和干扰miR-497-5p表达对胃癌细胞增殖、迁移、侵袭和凋亡的影响

图6 沉默DDX11-AS1表达和干扰miR-497-5p表达对胃癌细胞中cyclin D1、MMP-2、MMP-9、cleaved caspase-3蛋白表达的影响(蛋白质印迹法)
讨 论
LncRNA参与肿瘤发生、发展过程,并可通过调控基因表达的转录、表观遗传等发挥作用[7]。研究表明LncRNA可作为内源竞争RNA(ceRNA)通过miRNA应答元件而竞争性结合miRNA来调控靶基因表达,这种调控机制在胃癌等肿瘤的发生、发展中发挥调控作用[8]。本研究通过积极探寻新型LncRNA分子并探究其可能的作用机制,为进一步阐释胃癌的发生和转移机制奠定理论基础。
DDX11-AS1是一种新型LncRNA分子,在神经胶质瘤、胃癌、肝细胞癌等多种肿瘤中高表达,并可参与肿瘤发生、发展过程[9-11]。但DDX11-AS1在胃癌发生、转移过程中的作用机制尚未明确。本研究结果显示DDX11-AS1在胃癌组织和细胞株中的表达均显著升高,提示DDX11-AS1表达升高可能参与胃癌的发生。进一步研究显示干扰DDX11-AS1表达后,细胞活力显著降低,cyclin D1蛋白表达显著降低,说明干扰DDX11-AS1表达可抑制胃癌细胞增殖。研究表明cyclin D1可正向调控细胞周期并可促进细胞增殖[12]。提示干扰DDX11-AS1表达可通过抑制cyclin D1表达而抑制胃癌细胞增殖。本研究还发现,干扰DDX11-AS1表达可显著增加胃癌细胞凋亡率,减少细胞迁移与侵袭,并可降低MMP-2、MMP-9表达,促进cleaved caspase-3表达。MMP-2、MMP-9表达降低可抑制肿瘤细胞迁移和侵袭能力,cleaved caspase-3表达升高可促进细胞凋亡[13-14]。提示干扰DDX11-AS1表达可通过明显降低MMP-2、MMP-9表达以及升高cleaved caspase-3表达来抑制胃癌细胞迁移、侵袭,并促进细胞凋亡。
MiR-497-5p通过靶向KCa3.1抑制血管肉瘤细胞增殖和侵袭[15]。LncRNA XIST通过靶向miR-497-5p抑制肝细胞癌的增殖和迁移[16]。MiR-497-5p通过靶向胰岛素样生长因子1抑制肝细胞癌的细胞增殖和转移[17]。LncRNA HOXC13-AS通过调节miR-497-5p/PTEN轴促进乳腺癌细胞生长[18]。本研究中,miR-497-5p在胃癌组织和细胞中的表达均显著降低,上调miR-497-5p表达可抑制胃癌细胞增殖、迁移和侵袭,并诱导细胞凋亡。与Feng等[19]的研究结果基本相似。本研究通过生物信息学分析显示miR-497-5p可能是DDX11-AS1的靶基因,双萤光素酶报告实验和qRT-PCR法结果均证实DDX11-AS1可负向调控靶基因miR-497-5p表达。同时抑制miR-497-5p表达可逆转干扰DDX11-AS1表达对胃癌细胞增殖、迁移、侵袭和凋亡的影响。提示干扰DDX11-AS1表达可通过上调miR-497-5p表达而抑制胃癌细胞增殖、迁移和侵袭,并诱导细胞凋亡。
综上所述,DDX11-AS1能通过靶向结合并上调miR-497-5p表达进而抑制胃癌细胞增殖、迁移和侵袭,并诱导细胞凋亡,可为胃癌早期诊断和基因治疗提供潜在的靶点。但关于胃癌发生和转移过程中DDX11-AS1对相关通路的影响及其可能的调控机制仍需行进一步研究。

