5-磷酸二酯酶抑制剂他达拉非治疗对伴有感音神经性聋的性功能障碍患者听功能的影响
梁媛 马桂琴 刘红 刘吉娜 曹静 张洁 黄岳雁
河北省承德市承德医学院附属医院耳鼻喉科(河北承德067000)
感音神经性聋是指由于耳蜗毛细胞、听神经、听觉传导路径或各级神经元受损害,致声音的感受与神经冲动传递障碍以及皮层功能缺损的一种听力障碍疾病。据2016年调查显示,我国四省中度以上听力障碍(致残性)患病率为5.17%,其中感音神经性聋患者占70%以上[1]。感音神经性聋的发病机制至今尚未完全阐明,也无完全治愈的药物或方法。近年来,尽管人工耳蜗植入、干细胞移植等治疗方法获得较大进展,但临床疗效仍不确切,并且不适用于所有患者[2-3]。JAUMAMM 等[4]研究发现,环磷酸鸟苷(cyclic guanosine mono phosphate,cGMP)依赖性蛋白激酶-1(protein kinase-1,Prkg1)和5-磷酸二酯酶(5-phosphodiesterase,PDE5)在耳蜗毛细胞中一起表达,并且通过药理学方法确定PDE5 在内耳中具有cGMP-Prkg1 信号级联作用。本课题组前期动物实验也证实PDE5抑制剂可减轻豚鼠耳蜗毛细胞损害[5],但缺少临床研究。目前PDE5 抑制剂是治疗男子勃起功能障碍的一线药物,尚未用于治疗耳科疾病。因此,本次研究以性功能障碍合并感音神经性聋患者为研究对象,借此观察患者在使用PDE5 抑制剂治疗勃起功能障碍的同时,是否对感音神经性聋具有影响,以明确PDE5 在感音神经性聋中的作用机制,为感音神经性聋临床治疗提供了新的路径。
1 资料与方法
1.1 一般资料选择2017年1月至2018年1月在承德医学院附属医院门诊首次诊断的性勃起功能障碍同时伴有感音神经性聋的男性患者38 例(60耳)为研究对象,年龄40 ~68 岁,平均(48.69 ±3.73)岁;轻度聋6 耳,中度聋26 耳,重度聋20 耳,极重度聋8 耳;伴有不同程度耳鸣有50 耳。本研究得到承德医学院附属医院医院伦理委员会批准同意,与参与该研究的患者签订知情同意书。
1.1.1 诊断标准勃起功能障碍诊断符合美国国立卫生研究院(National Institutes of Health,NIH)标准,即:不能达到和(或)不能维持足够的勃起以完成满意的性交,IIEF-5 评分<21 分。感音神经性耳聋诊断符合《耳鼻咽喉科诊断学》中的标准,即:(1)没有明确具体病因的单耳或双耳听力下降,病史超过3 个月;(2)非波动性感音神经性聋,至少需要在相邻的2 个频率听力损伤超过20 dB;(3)除外眩晕发作病史;(4)影像学检查(头颅MRI或颞骨三维重建)及听力学检查确已除外听神经瘤、中耳疾病、圆窗膜破裂、药物性中毒及头颅外伤等病变;(5)已除外家族性遗传因素。听力障碍分级标准采用世界卫生组织(1997)日内瓦会议推荐的标准,以纯音测听为基础,根据频率(500 kHz、1 000 Hz、2 000 Hz、4 000 Hz)的气导平均听阈分为4 级:轻度聋:听力计检查纯音和语言听阈在26 ~40 dB HL;中度聋:听阈41 ~60 dB HL;重度聋:听阈61 ~80 dB HL;极重度聋:听阈>80 dB HL。
1.1.2 纳入与排除标准纳入标准:(1)同时符合上述诊断标准者;(2)首次接受性勃起功能障碍治疗者;(3)有规律的性生活者;(4)既往未接受药物、人工耳蜗植入等方法治疗感音神经性聋,或者虽使用过药物治疗但无明显治疗效果,而且迄今已停止药物治疗超过2 周者;(5)具有良好依从性,能服从正规治疗并按要求接受听力检查者。排除标准:(1)伴发造血系统疾病及心、脑、血管、肝脏、肾脏等脏器慢性疾病者;(2)先天性耳聋、耳蜗病变、传导性耳聋以及其他非感音神经性聋患者。剔除:(1)未按要求治疗者;(2)研究期间接受了其他方法治疗勃起功能障碍或感音神经性聋者;(3)失访者。
1.2 治疗方法38 例患者在病史询问、查体、勃起功能评估以及纯音测听检查完成后,给予PDE5抑制剂(选用他达拉非Eli Lilly Nederland B.V 生产,国药准字H20170286)10 mg 口服,性生活前1h服用,以连续治疗2 周为1 个疗程。
1.3 观察指标
1.3.1 听功能治疗前后38 例患者(60 耳)行纯音测听(GSI-61)、声导抗检查(GSI Tympstar ABR(HIS Smart EP)评估听功能,记录治疗前后250 Hz、500 Hz、1 kHz、2 kHz、4 kHz、8 kHz 纯音测听结果,正常听阈范围<25 dB。测听仪器采用美国GSI 61 型,测听室符合国家1640 检测标准。
1.3.2 耳鸣程度治疗前后采用耳鸣残疾评估量表(tinnitus handicap inventory,THI)进行评定,该量表共有25 个问题,患者根据自身症状回答“是”、“有时”或“不”,回答“是”记为4 分,回答“有时”记为2 分,回答“无”记为0 分。总分范围为0 ~100分,评分越高耳鸣症状越严重。
1.3.3 不良反应观察38 例患者治疗前后药物不良反应发生情况。
1.4 听功能疗效评定痊愈受损频率听力恢复至正常,或达健耳水平,或达此次患病前水平。显效:受损频率听力平均提高30 dB 以上。有效:受损频率听力平均提高15 ~30 dB。无效:受损频率听力平均提高不足15 dB。治疗总有效率=[(痊愈耳数+显效耳数+有效耳数)/总耳数]×100%。
1.5 统计学方法应用SPSS 21.0 统计分析软件处理数据。数据进行正态性检验,服从正态分布或近似正态分布的计量资料采用(±s)表示,治疗前后比较采用配对t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 38 例患者治疗后勃起功能改善情况38 例患者采用他达那非治疗后自诉,勃起功能获得明显的改善。
2.2 60 耳听治疗效果情况经2周治疗后,痊愈4耳,显效20 耳,有效26 耳,治疗总有效率为83.3%。其中,轻度聋治疗总有效率达到100%,随着耳聋程度的加重,治疗有效率逐渐下降。见表1。
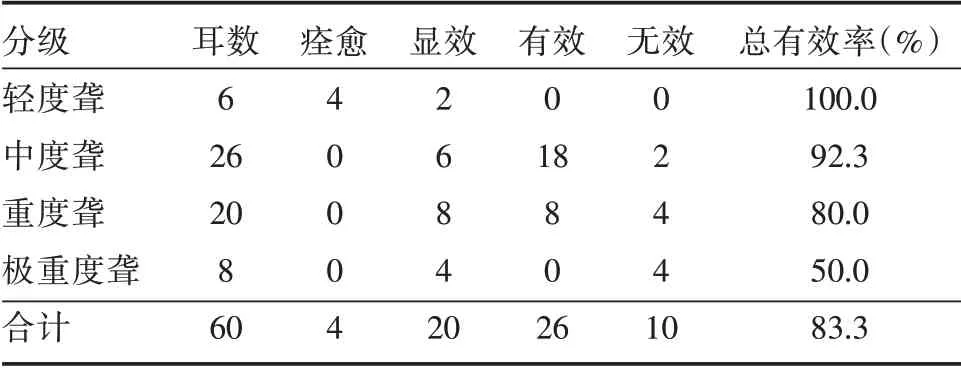
表1 60 耳治疗效果情况Tab.1 Therapeutic effect of 60 ears 例
2.3 60 耳治疗前后各频率纯音测听结果治疗2 周后,60 耳在各频率下纯音听阈值都较治疗前明显下降,差异有统计学意义(P<0.01)。见表2。
2.4 60 耳治疗前后语言频率均值情况治疗前60 耳言语频率均值为(64.5 ± 5.2)dB,服用PDE5抑制剂2 周后,60 耳言语频率均值为(42.3 ± 3.4)dB,治疗前后比较差异有统计学意义(P<0.01)。
表2 60 耳治疗前后的各频率纯音测听结果Tab.2 The pure tone audiometry results of each frequency before and after 60 ears treatment ±s

表2 60 耳治疗前后的各频率纯音测听结果Tab.2 The pure tone audiometry results of each frequency before and after 60 ears treatment ±s
注:与治疗前相应频率比较,aP <0.01
时间治疗前治疗后耳数60 60 250 Hz 55.2±4.6 30.8±3.7a 500 Hz 60.0±5.7 36.0±3.8a 1 kHz 64.0±5.8 41.2±3.9a 2 kHz 64.5±5.5 40.7±4.0a 4 kHz 70.2±5.3 52.2±4.6a 8 kHz 70.8±6.0 59.6±4.5a
2.5 患者治疗前后耳鸣症状改善情况治疗前,60耳中有50耳存在不同程度的耳鸣症状,THI评分为(28.36±8.21),治疗后THI评分为(12.67±5.11),治疗前后THI 评分比较,差异有统计学意义(P<0.01)。根据患者主诉,耳鸣消失有10耳,耳鸣减轻有20耳,耳鸣无变化20耳,有效率达60.0%。
2.6 不良反应患者治疗过程中出现头痛2 例,面红2 例,均持续短暂时间后自行消失,未影响治疗。
3 讨论
感音神经性聋是一个快速增长的医疗保健问题,目前全球范围内感音性听力损伤总人口达到1.9 亿,预计到2050年这一数字将增加到7 亿。由于感音神经性聋致残率较高,严重影响着人类的心理健康与生存质量[6],因此,阐明感应神经性聋的发病机制及研究有效治疗神经性聋的药物是耳科学领域研究的重点。
近年来研究[7-8]发现,人类内耳中存在的NO/cGMP 途径能够调节内耳的微循环和生理功能,尤其在改善听觉传导、内环境的稳定及微循环等方面发挥着重要作用。NO/cGMP 途径的基本过程可能是一氧化氮合成酶(NOS)以L-精氨酸为底物合成NO,后者作为一种可以自由弥散的气体信使分子与细胞内的可溶性鸟苷酸环化酶(guanidine cyclase,sGC)结合并进一步激活sGC,sGC 又以三磷酸鸟苷(guanosine triphosphate,GTP)为底物生成cGMP,后者作为细胞内的第二信使再进一步激活下游的酶系统(诸如依赖cGMP 的蛋白激酶C 等),从而引起细胞的生理效应,起到调节耳蜗微循环及细胞生理的作用[9-10]。这一途径的发现,使PDE5 抑制剂治疗感音神经性聋成为一种可能,但目前缺少相关的临床性研究。
本课题组前期做了动物实验研究,结果显示,PDE5抑制剂可改善噪声性聋豚鼠的听功能[11]。在前期动物实验基础上,本次研究观察性功能障碍合并感音神经性聋患者PDE5 抑制剂治疗对听功能的影响。结果显示,勃起功能障碍伴有感音神经性聋患者在接受2 周的PDE5 抑制剂他达那非治疗后,勃起功能获得明显改善的同时,听力亦有改善,其中60 患耳治疗总有效率达到83.3%,轻度耳聋患者治疗有效率为100%,中度耳聋患者92.3%治疗有效,重度聋患者有效率为80%。治疗后60 耳各频率下纯音听阈值、言语频率均值都较治疗前明显下降。提示,PDE5 抑制剂他达那非对轻度、中度聋的治疗效果较为明显,可明显改善勃起功能障碍伴有感音神经性聋患者的听功能,与JAUMAMM 等[4]研究结果基本一致。
他达拉非改善感音神经性聋的机制可能与下述有关:作为一种选择性5-磷酸二酯酶抑制剂,他达那非对离体人海绵体无直接松弛作用,但能够通过抑制海绵体内分解cGMP 的PDE5 来增强NO的作用[12]。cGMP 作用于特异性受体蛋白,包括cGMP 依赖性蛋白激酶,表达Prkg 神经元和非神经元细胞类型,包括豚鼠耳蜗支持细胞和螺旋神经节神经元(spiral ganglion neuron,SGNs)[13-14]。因此,cGMP 介导的途径可以通过PDE5 抑制剂刺激。国外研究表明,PDE5-Prkg1-cGMP-PARP 信号肽存在于耳蜗毛细胞内[15]。聚腺苷二磷酸核糖聚合酶(polyadenosine diphosphate ribose polymerase,PARP1)是一种普遍表达的DNA 缺口末端传感器,它通过烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)作为底物催化PAR 加入受体蛋白,特别是组蛋白、转录因子和PARP 本身[16],使DNA 断裂激活PARP,促进转录、复制和DNA 碱基切除修复[17-18]。然而NO 的毒性作用又与DNA 损伤、PARP1 的过度激活有关,并且伴随NAD+ 耗尽或ATP 耗尽导致细胞死亡。在这种情况下,他达那非既可以增强cGMP 信号传导的保护作用又不会促进高浓度NO 的潜在破坏作用,从而对听力损伤发挥着治疗作用。
在耳鸣症状方面,伴有耳鸣症状的50 耳中,治疗后THI 评分较治疗前显著下降,患者主诉耳鸣症状改善率达到60.0%。提示,PDE5 抑制剂对感音神经性聋伴耳鸣也有较好的疗效。内耳血循环障碍是导致神经性耳鸣的重要因素[19],而PDE5 抑制剂本身具扩张血管的作用[20],当药物进入内耳后可以扩张内耳中的血管,使内耳血循环障碍获得一定程度的改善,从而缓解耳鸣症状。在PDE5抑制剂治疗不良反应方面,本次研究结果显示,出现头痛2 例,面红2 例,均持续短暂时间后自行消失,未影响治疗。曾有个别病例报道服用PDE5 抑制剂可能导致突发性耳聋,考虑可能与服用PDE5抑制剂的剂量及时间有一定的关系。骆晓琴等[21]通过临床研究发现随着剂量的增加,PDE5 抑制剂不良反应出现的几率逐渐增多,约超过80%的患者口服安全程度较高的剂量为50 ~150 mg。
本次研究显示,PDE5 抑制剂在改善勃起功能障碍伴感音神经性聋患者勃起功能的同时,对感音神经性聋也有一定的治疗效果,尤其在改善轻度、中度感音神经性聋患者听功能、耳鸣症状方面具有显著的效果,PDE5 抑制剂可能成为治疗或保护感音神经性聋的感觉和神经组织的一种潜在的药物。本次研究尚存在一些不足之处,如样本量较少、观察期较短等,在后续的研究中,将扩大样本量、延长观察期来对本次研究结果加以证实。此外,对PDE5 抑制剂的作用机制是否也是通过PDE5-cGMP-Prkg1 途径进行调节还是通过其他途径则需要进一步深入研究。

