增强CT与MRI在原发性肝癌介入治疗后疗效评估中的价值对比分析
张燕军 蒋 强 张 倩 蒋忠仆
我国原发性肝癌(primary hepatic carcinoma,PHC)发病率高,约占恶性肿瘤12.9%,男性发病率高于女性。PHC起病隐匿,早期缺乏显著症状,且进展快,因此临床PHC晚期患者较多,预后较差[1]。目前PHC临床治疗方法多,包括射频消融术、手术切除、放化疗、经动脉化疗栓塞术(TACE)等,对于中晚期患者而言,手术风险高,此时适合选择TACE治疗。TACE是PHC重要介入治疗方法,通过栓塞肿瘤主要供血动脉,促使肿瘤细胞因缺血缺氧而快速死亡,长期抑制肿瘤进展。但肝癌患者肿瘤供血血管多,侧枝循环密,一次性TACE无法完全栓塞所有供血血管,因此评估TACE后疗效对后续治疗具有指导价值[2]。随着影像学技术快速发展,数字减影血管造影成为TACE术后残留病灶和新发灶的重要观察手段,此外电子计算机断层扫描(CT)和磁共振成像(MRI)技术也被应用到PHC诊断和疗效评估中,由于DSA费用高且局限性大,故需要寻找除此之外的最佳影像学技术,为此本研究分析了增强CT和MRI在该方面的应用价值,报告如下。
1 资料与方法
1.1 一般资料
选择2017年1月至2019年3月本院收治的120例PHC患者。纳入标准[3-4]:患者及法定监护人签署知情同意书;经病理学证实为PHV,符合《原发性肝癌诊疗规范》相关标准;肝功能分级为A级、B级;年龄为18~70岁;预计术后生存期至少为3个月。排除标准[5-6]:患有严重肾、脑、心等基础疾病;存在自身免疫性缺陷、严重感染、凝血功能异常、除PHC外的恶性肿瘤;肝脏体积大且超出扫描范围;其他原因导致肝灌注异常;有大量或中量腹水;血清转氨酶是正常人群的3倍;Karnofsky评分<90分;精神疾病史;妊娠期和哺乳期女性。本研究获得本院伦理委员会批准。120例患者中男性68例,女性52例;年龄36~69岁,平均(58.13±5.11)岁;肝功能A级共59例,B级共61例;美国肿瘤联合会(AJCC)细胞肝癌分期Ⅰ~Ⅱ期者共79例,Ⅲ~Ⅳ者41例;其中块状型共61例、结节型共44例、弥漫型共15例,块状型的肿块平均大小为[(7.32×4.03)±(2.31×2.09)]cm2,结节型的肿块大小平均为[(4.18×3.50)±(1.43×1.06)]cm2。
1.2 方法
1.2.1 TACE治疗方法 患者仰卧后常规消毒铺巾,用2%利多卡因做右侧腹股沟区局部麻醉,将导管置于腹腔干内,行右股动脉穿刺,造影剂染色肿瘤。于肿瘤供血动脉灌注100~200 mg奥沙利铂、1.0 g氟尿嘧啶,充分乳化10~30 mg盐酸表柔比星和10~20 ml碘油,注入10~20 ml乳化剂,将肿瘤供血血管栓塞,术后肝内碘油沉积较好,染色异常消失。
1.2.2 CT检查 TACE完成后2~6个月内给予数字减影血管造影(DSA)、CT、MRI扫描。将DSA作为金标准,以此分析CT和MRI的扫描结果。CT扫描方法:将德国西门子公司提供的Somaton Perspective 65层螺旋CT扫描机螺距调整为1.2 mm,层厚为6 mm,层距为8 mm,准直取0.6~1.2 mm,设置管电压、管电流分别为130 kv和180 mAs。使用高压注射器将威视派克(对比剂)以2.5~3.0 ml/s、1.5 ml/kg注入肘静脉中。完成膈顶至肾脏下极的上腹区平扫,注射造影剂,行动脉期、门脉期和延迟期扫描,分别是在注射后20~30 s、60~70 s和120 s进行,以肿瘤直径最大层面作为扫描层,在以上参数条件下勾画感兴趣区(ROI),将ROI置于强化显著区,测肿瘤周围肝实质,计算CT值。
1.2.3 MRI检查 用德国西门子公司提供的Avanto 1.5T超导磁共振扫描仪8通道体部相阵控线圈,指导患者仰卧和呼吸训练,以头先进方式进行扫描,主要对冠状面和横断面进行扫描,以2 ml/s、0.2 mmol/kg注入扎喷酸普安(对比剂),进行FSET1W平扫(TR/TE为110 ms/2.4 ms)、FSET2W平扫(TR/TE为1000 ms/85 ms)、增强扫描(TR/TE为4.8 ms/2.3 ms);层间距7.8 mm,层厚为6 mm,矩阵为384×512,视野260 mm×350 mm,带宽380 Hz;分别是在注射对比剂后20 s、40 s、60 s,行动脉早期、晚期和门静脉期增强扫描,尽可能将肝脏膈顶至双肾下极覆盖。
1.2.4 肿瘤残留观察 CT扫描:动脉期强化,CT值>10 HU,门脉期低密度,提示有残留。MRI:动态增强为主,增强早期强化,提示有残留病灶。DSA:动静脉瘘、肿瘤血管、染色,即为残留。
1.3 观察指标
观察TACE治疗后3种方法在新发病灶和残留病灶的静脉癌栓、主要供血来源、病灶包膜、病灶大小上的判断结果;对比CT和CT+MRI在残留动脉期强化区评分、增强图像最小短径和最大长径。
1.4 统计学分析
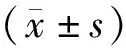
2 结果
2.1 增强CT、MRI与DSA诊断TACE后残留和新发灶结果比较
与DSA相比,MRI、增强CT门静脉癌栓塞检出数更少。MRI、增强CT均发现主要供血动脉为腹腔动脉,MRI结果与DSA一致。与MRI比较,增强CT下腹腔动脉更少,肠系膜上动脉更多。MRI发现的有包膜病灶较DSA多,而CT较DSA少。MRI及CT发现的≤5 cm病灶均较DSA少,但MRI较CT多。见表1。
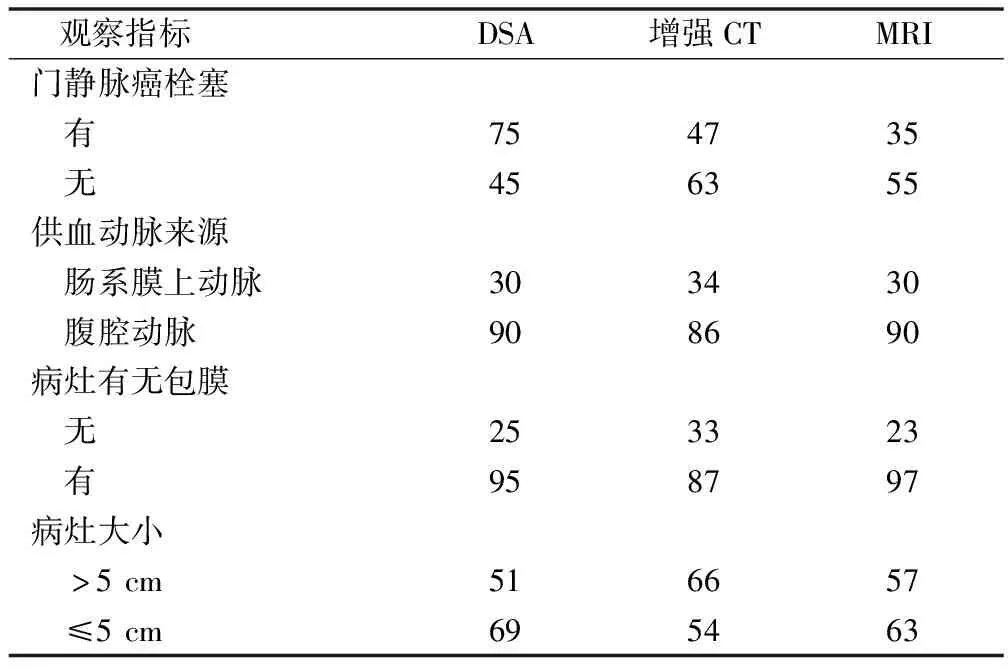
表1 增强CT、MRI与DSA诊断TACE后残留和新发灶结果比较/例
2.2 增强CT与MRI在TACE后残留或新发灶观察中的效能对比
与增强CT相比,MRI检查TACE后残留或新发病灶时在≤5 cm的病灶上有更高灵敏度和准确性,在包膜判断上有更高特异度和灵敏度,差异有统计学意义(P<0.05)。见表2。

表2 增强CT与MRI在TACE后残留或新发灶观察中的效能对比
2.3 增强CT与MRI评估TACE疗效的价值分析
与增强CT相比,MRI的增强图像最大长径更长,最小短径更小,差异有统计学意义(P<0.05)。见表3。

表3 增强CT、MRI评估TACE疗效的价值分析
3 讨论
TACE术后新发病灶、残留病灶是评估TACE疗效的重要临床指标,目前判断TACE术后新发灶和残留灶的方法较多,DSA是有较高特异度的敏感性诊断方法,但由于DSA属于有创检查,重复利用性差,且费用高,在体积较大的肝癌肿瘤血管以及肝动脉增粗上染色较少见,在乏血供微小癌灶上呈不明显染色或无染色,诊断乏血供微小病灶的准确率为50%,甚至更低[7]。常规CT扫描受高密度碘油硬化伪影影响,在肿瘤血供消失与否和非碘油沉积的肿瘤组织是否还有活性的判断上准确性较差[8-9]。因此越来越多的研究者关注增强CT和MRI在该领域的使用价值。本研究发现,与增强CT相比,MRI在微小病灶诊断上具有更高价值,现结合研究结果进行分析。
MRI有固定的扫描动脉期时间,对动脉期前期和动脉期后期强化的病灶敏感性不如DSA;但MRI检查缺乏血供病灶的敏感性较DSA好,且能避免DSA检查时呼吸运动干扰膈下病灶而发生的漏诊[10]。MRI与增强CT相比,前者能更清晰分辨软组织,有丰富的图像采集信号,且无放射性损伤,为影像学医师提供肝脏解剖学图像、代谢信息和病理生理信息,更全面地完成介入治疗后复查;此外MRI还具备多序列成像,从而提高残留病灶和新发病灶检出率,并直观展示残留和新发灶特点,其优势在小病灶上更明显[11-12]。本研究中MRI诊断≤5 cm病灶特异度(93.49%)、灵敏度(94.27%)均高于增强CT,差异有统计学意义(P<0.05)。这与朱风叶等[13]指出的MRI能提高PHC介入治疗后≤5 cm新发灶和残余灶检出率(P<0.05),在>5 cm病灶检出上与CT相似的结果一致。考虑是因为本研究使用的64层CT,扫描时间间隔短,扫描快,分辨率高,运动伪影较少;注射对比剂增强CT扫描能提供肝脏形态学特征,反应血供,且成像受血供影响较大,而绝大多数干细胞血液是由干细胞提供,故增强CT扫描动脉期病灶强化不够明显,对比剂在门脉期快速消退,强化中断,信号密度下降,呈“快显快出”的特点;CT增强为间歇式扫描,固定时间短,在乏血供病灶中局限性大,出现漏诊、误诊;当病灶>5 cm时,供血丰富,增强CT确诊容易;而病灶越小则血供越少,增强CT扫描动脉期不强化,容易漏诊;而MRI场强及早期成像速度慢,对小病灶敏感,能提高敏感度。这也是本研究中增强CT对≤5 cm病灶(供血小)的诊断价值不如MRI的原因[14]。本研究中MRI在判断包膜上的特异度和灵敏度较增强CT高,差异有统计学意义(P<0.05)。考虑是因为增强CT对肿瘤周边组织显示清晰度不足,容易出现伪影,而MRI能多方位、多参数扫描,成像清晰度高,尤其对软组织敏感性高,能显示肝内组织、血管和胆管结构,尤其在包膜和包膜判断上更清晰[15]。本研究中与增强CT相比,MRI的增强图像最大长径更长,最小短径更小,差异有统计学意义(P<0.05);提示MRI成像更佳,在肿瘤包膜观察上更清晰。
综上所述,与增强CT相比,MRI对原发性肝癌患者TACE术后疗效的评估具有更高价值,尤其适合乏血供小病灶和包膜情况观察,能减少漏诊。

