前列腺癌P504S蛋白表达与肿瘤特征及预后的关系
杨 东
前列腺癌的发生具有较高的基础发病率和年发病人数[1],在研究前列腺癌病情进展机理的过程中,可以认定肿瘤调控蛋白能够在移行上皮细胞的病变中发挥作用[2]。α-甲酰基辅酶A消旋酶(P504S)主要表达于线粒体及内质网上,作为过氧化酶因子,其能够通过影响脂肪酸的代谢,加剧上皮细胞能力代谢,进而促进恶性肿瘤的早期发生过程[3]。部分研究者探讨了P504S的表达与前列腺癌的关系,认为在前列腺癌患者中,P504S蛋白的表达阳性率明显上升[4],但缺乏对于P504S的表达与前列腺癌患者的临床病理特征的关系分析。本研究旨在探讨P504S蛋白的表达与前列腺癌临床病理特征的关系。
1 材料与方法
1.1 一般资料
选取我院2014年1月至2016年7月手术切除的86例前列腺癌病理学组织标本作为前列腺癌组、90例前列腺增生组织作为良性组。前列腺癌组,患者年龄52~78岁,平均(66.3±9.1)岁,血清前列腺特异性抗原(PSA)>4.0 ng/ml 43例、PSA≤4.0 ng/ml 43例;病灶直径>5 cm 39例、≤5 cm 47例;TNM分期:Ⅰ期20例、Ⅱ期33例、Ⅲ期26例、Ⅳ期7例;组织学分化:高、中、低分化患者各为22、36、28例;术后淋巴结转移检查结果发现阳性38例。良性组,患者年龄为52~79岁,平均年龄为(65.1±10.2)岁。前列腺癌患者与前列腺良性增生患者的年龄差异无统计学意义(P>0.05)。入选标准:①前列腺癌的诊断标准参考中华医学会制定的标准[5];②患者年龄≤79岁;③手术后病理学检查确诊为前列腺癌,患者接受2年的随访观察;④2组研究对象的基线资料完整;⑤本研究符合《赫尔透辛基宣言》相关伦理及保密原则。排除标准:①合并其他部位恶性肿瘤;②术前具有放化疗史、内分泌治疗史;③伴有其他系统的重大疾病。
1.2 免疫组化染色方法及评价标准
石蜡切片采用二甲苯进行脱蜡至水,5%的双氧水常温孵育10 min,采用磷酸盐缓冲液孵育5 min,蒸馏水冲洗3次,每次5 min,5%的山羊血清抗体封闭10 min,不冲洗,滴加一抗(购自abcum公司 批号:20119304 浓度:1∶500),4 ℃冰箱孵育过夜,蒸馏水冲洗3次,每次5 min,滴加生物素标记好的二抗(购自北京康泰生物 批号:20104856 浓度:1∶1000),37 ℃孵育30 min,蒸馏水冲洗3次,每次5 min,滴加第二代辣根酶标记的工作液体,37 ℃孵育10 min,蒸馏水冲洗3次,每次5 min,显色之后采用酒精脱水、二甲苯透明、树胶封片,镜下观察。免疫组化结果判定:P504S蛋白定位于细胞质,阳性染色呈黄色、棕黄色、褐色表达。①依据染色的程度分为:未染色(0分)、仅仅淡黄色染色(1分)、棕黄色染色(2分)、染色呈褐色、黑色(3分);②根据染色的细胞占比结果:占比≤10%计分1分、>10%~50%计分2分、>50%~75%计分3分、占比>75%计分4分。染色程度与阳性细胞计分之乘积<3分为阴性、≥3分为阳性。
1.3 统计学方法
采用SPSS 21.0软件分析数据,应用χ2检验分析不同组别间P504S蛋白阳性表达率;生存分析采用Kaplan-Meier法;P<0.05表明差异具有统计学意义。
2 结果
2.1 P504S蛋白在2种组织中的表达情况对比
P504S蛋白阳性表达率在前列腺癌组织中为68.60%(59/86),在前列腺增生组织中为24.44%(22/90),差异有统计学意义(χ2=34.523,P=0.000)。
2.2 前列腺癌组织中P504S蛋白阳性表达率与病理学特征的关系
前列腺癌组织中的P504S蛋白阳性表达与TNM分期、淋巴结转移、PSA水平有关(P<0.05);与年龄、组织学分化程度、病灶直径、Gleason评分无关(P>0.05),见表1。

表1 前列腺癌组织中P504S蛋白阳性表达率与病理学特征的关系(例,%)
2.3 P504S蛋白表达与前列腺癌患者预后的关系
随访2年,P504S蛋白阳性表达组失访4例患者,P504S蛋白阳性表达患者的2年生存率为63.64%(35/55)、阴性表达患者为81.48%(22/27),差异无统计学意义(χ2=2.560,P=0.110)。
经Kaplan-Meier法分析,P504S蛋白阳性表达患者的生存时间与阴性表达患者的生存时间差异无统计学意义[Log-rank(Mantel-Cox)=1.432,P=0.233>0.05];见图1。
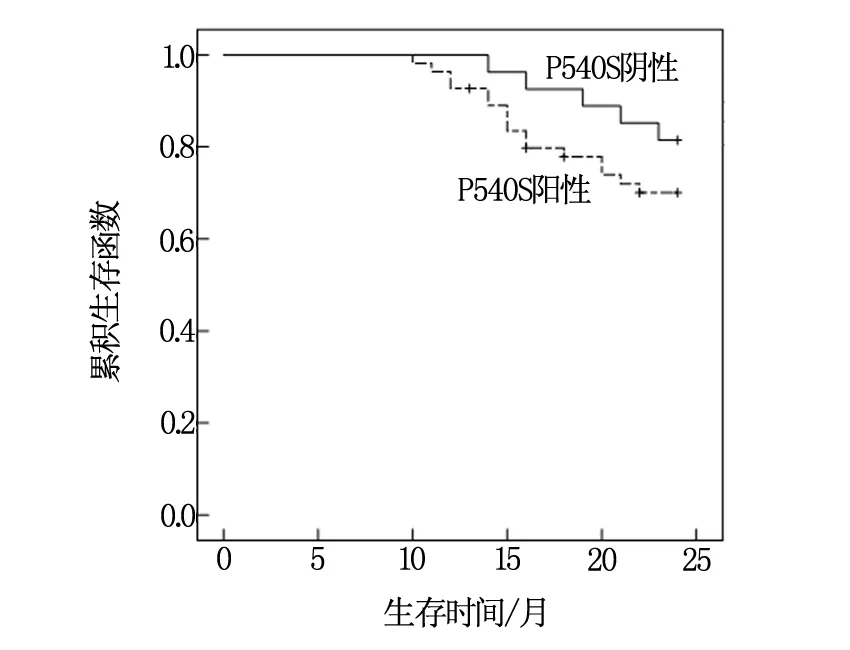
图1 P504S蛋白阳性与阴性患者的生存曲线图
3 讨论
长期的临床随访观察研究发现,不同措施治疗后前列腺癌患者的病情进展速度仍然较快,远期临床预后或者生存时间仍然无明显的改善[6-8]。现阶段缺乏对于前列腺癌患者病情评估的肿瘤标志物,虽然前列腺特异性抗原能够在前列腺癌的病情评估过程中发挥作用。但部分单中心的临床回顾性分析研究发现,采用前列腺特异性抗原评估前列腺癌临床预后的假阳性率较高,其对于前列腺癌患者临床预后评估的吻合程度较低,参考价值不高[9]。本次研究通过对前列腺癌患者病灶组织中P504S蛋白的表达分析,深入揭示泌尿系统恶性肿瘤发生的部分机制。
P504S蛋白是过氧化物酶相关因子,能够通过影响线粒体能量代谢,提高线粒体合成ATP的速率,为癌细胞的异常扩增提供前提。P504S蛋白能够影响氧化还原蛋白基因的转录水平,导致氧化还原反应平衡的紊乱,促进了氧化应激诱导下癌细胞的异常转录过程。P504S蛋白的表达上升能够影响到肿瘤细胞核DNA的非对称分裂速度,导致肿瘤癌基因的异常激活。部分研究者探讨了P504S蛋白的表达及其与前列腺癌的关系,认为P504S蛋白的上升能够影响到前列腺癌短期内病情进展速度[10]。
对于前列腺癌患者病灶组织中P504S蛋白的表达分析研究可见,在病例组患者中,P504S蛋白的表达阳性率明显的上升,高于前列腺良性增生组患者,统计学差异显著,提示了P504S蛋白的高表达在前列腺癌的早期发生和中晚期病情进展中发挥了作用。汪玉等[11]研究者也发现,在前列腺癌患者病灶组织中,P504S蛋白的表达阳性率可平均上升30%,同时短期内肿瘤恶病质较为明显或者合并远期复发转移的前列腺癌患者中,P504S蛋白的表达可翻倍上升。在探讨P504S蛋白的表达与前列腺癌临床病理特征的关系过程中,发现在临床分期较晚、发生了淋巴结转移或者PSA水平较高的患者中,P504S蛋白的表达阳性率较高,提示了P504S蛋白的表达与前列腺癌患者临床病理特征的关系,这主要可以从下列几个方面进行理解[12-14]:①P504S蛋白的表达上升,能够提高癌细胞的上皮间质转换程度,促进癌细胞浸润深度和远处转移的发生,进而提高了临床分期;②P504S蛋白的表达上升能够提高癌细胞粘附淋巴结组织的能力,进而促进了淋巴结转移的发生。但并未发现P504S蛋白与Gleason评分的关系,提示P504S蛋白并不会调控前列腺癌细胞的分化成熟。最后本次研究并未发现P504S蛋白的表达与前列腺癌患者临床预后的关系,提示临床上暂时不能够通过检测P504S蛋白预测前列腺癌患者的临床转归。
综上所述,在前列腺癌患者中,P504S蛋白的表达明显上升,同时P504S蛋白的表达与前列腺癌患者的临床分期及淋巴结转移密切相关。希望后续研究可以探讨P504S蛋白的表达与前列腺癌患者病死率的关系。

