TR3的线粒体靶向参与TPA诱导乳腺癌细胞凋亡的机制
张辰铭 王东君 孙春阳
乳腺癌是最常见的妇科癌症之一,转移是导致乳腺癌高致死率的主要原因。虽然已经开发了多种治疗人乳腺癌的方法,但乳腺癌患者的死亡率仍未下降[1]。因此,急需研究新的更有效的治疗策略。研究报道,12-O-十四烷酰佛波醇-13-乙酸酯(TPA)是一种癌症启动因子,其诱导的肿瘤发生与细胞上皮细胞增殖并向间充质转化和转移有关[2]。矛盾的是,TPA也是一种有效的细胞凋亡刺激因子,在7种人细胞中可激活至少26种蛋白,包括MAPK、PKC同工酶等[3]。多项研究表明TPA可通过释放细胞色素C诱导角质形成细胞和骨髓性白血病细胞等多种细胞凋亡[4],但对乳腺癌细胞的作用还鲜少报道。早前的研究表明,TPA可通过上调Bax诱导乳腺癌细胞凋亡。然而,TPA诱导细胞凋亡的具体分子机制尚不清楚。TR3(也称为Nur77和NR4A1)已成为肿瘤细胞存活的主要调节因子和潜在治疗靶标,参与多种化学治疗药物介导的各种癌细胞的凋亡[5]。已知TR3诱导细胞凋亡的机制主要包括释放细胞色素C、上调促凋亡基因和/或下调抗凋亡基因[5]。然而,TR3是否介导TPA对乳腺癌细胞的凋亡仍不清楚。本研究旨在研究TPA对乳腺癌细胞增殖、凋亡及线粒体功能的影响,并探讨TR3是否介导TPA对乳腺癌细胞功能的调控作用,为乳腺癌的靶向治疗提供理论依据。
1 材料与方法
1.1 细胞培养
人乳腺癌细胞系MCF-7购自中国典型培养物保藏中心细胞库,将细胞培养在含有10%胎牛血清的RPMI-1640培养基中,37 ℃、5% CO2的培养箱中培养。
1.2 细胞干预
将细胞以5×103/孔的密度接种于96孔板,分别采用2.5 nM和10 nM的TPA(美国Sigma-Aldrich公司)干预细胞48 h,之后用于后续检测。对照组用DMSO干预。
1.3 细胞增殖抑制率检测
将20 μl 5 mg/ml的MTT溶液加入至干预48 h后的细胞中,孵育4 h,用酶标仪在570 nm处读取吸光值(A)。以只加培养基的孔作为空白对照。细胞增殖抑制率(%)=(1-A实验组/A空白组)×100%。
1.4 细胞凋亡检测
收获干预48 h后的细胞,采用Annexin V/PI Cell Apoptosis Detection Kit试剂盒对细胞进行染色(南京KeyGen Biotech公司)。采用FACS Calibur流式细胞仪及Cell-Quest软件获取及分析数据。
1.5 Western Blot
采用RIPA裂解液从干预48 h后的细胞中提取总蛋白,经定量后取30 g的总蛋白加入上样缓冲液中,用10% SDS-PAGE凝胶分离总蛋白,转膜后用5%胎牛血清封闭45 min,加入一抗,4 ℃孵育过夜,加入辣根过氧化物酶标记的二抗,室温摇床孵育1 h,采用电化学发光试剂在暗室发光。采用美国Bio-Rad公司提供的Quantity One 4.6.2软件分析及处理条带。抗体均购自美国Abcam公司。pro-caspase-9和cleaved-caspase-9检测内参用-actin。
采用Nuclear/Cytosol Fractionation Kit试剂盒(加拿大BioVision公司)分别提取细胞核和细胞质中的总蛋白,用Western Blot检测细胞核和细胞质(含线粒体)中TR3蛋白的表达。细胞质中TR3检测内参用Tubulin,细胞核中TR3检测内参用Lamin A。
采用线粒体分离试剂盒(南京KeyGen Biotech公司)分离线粒体,用Western Blot检测线粒体和细胞质(不含线粒体)中TR3蛋白的表达。线粒体中TR3检测内参用VDAC1,细胞质中TR3检测内参用Tubulin。
1.6 流式细胞仪
采用线粒体膜电位检测试剂盒(JC-1)(上海碧云天公司)检测干预48 h后的细胞线粒体膜电位,用FACS Calibur流式细胞仪及Cell-Quest软件获取及分析数据,结果用FL2/FL1(红/绿荧光强度)的比值表示。将10 mM Fluo-3 AM(上海碧云天公司)装载于干预48 h后的细胞,用于细胞中Ca2+水平的检测,37 ℃暗室孵育30 min后用FACS Calibur流式细胞仪在Ex./Em.为488/525 nm时检测荧光强度。
采用活性氧检测试剂盒(上海碧云天公司)检测干预48 h后的细胞中ROS水平,将细胞用二氢二氯荧光素(DCFH-DA)探针在37 ℃暗室孵育30 min后,用FACS Calibur流式细胞仪检测荧光强度。
1.7 生物信息学检测
采用UALCAN软件(http://ualcan.path.uab.edu/)分析TR3在正常人和乳腺癌患者中的表达。采用Kaplan Meier-plotter[Breast Cancer]软件(http://kmpl ot.com/analysis/)检测TR3对乳腺癌患者总体生存率的影响。
1.8 统计学分析
2 结果
2.1 TPA对乳腺癌细胞增殖抑制率的影响
对照组细胞增殖抑制率为(0.94±0.12)%,2.5TPA组为(16.07±2.68)%、10TPA组为(37.65±4.92)%。与对照组相比,2.5TPA组和10TPA组细胞增殖抑制率显著增加(F=130.06,P<0.001),对比差异具有统计学意义。
2.2 TPA对乳腺癌细胞凋亡的影响
如表1所示,与对照组相比,2.5TPA组和10TPA组细胞凋亡率和cleaved-caspase-9蛋白表达显著增加(P<0.05),pro-caspase-9蛋白表达无显著变化(P>0.05)。

表1 各组细胞凋亡对比
2.3 TPA对乳腺癌细胞线粒体功能的影响
如表2所示,与对照组相比,2.5TPA组和10TPA组细胞线粒体膜电位显著降低(P<0.05),Ca2+水平和ROS水平显著增加,对比差异具有统计学意义(P<0.05)。

表2 各组细胞线粒体功能对比
2.4 TPA对TR3线粒体靶向的影响
如表3所示,与对照组相比,2.5TPA组和10TPA组细胞核和细胞质(不含线粒体)中TR3蛋白的表达显著降低(P<0.05),而细胞质(含线粒体)和线粒体中TR3蛋白的表达显著增加,对比差异具有统计学意义(P<0.05)。
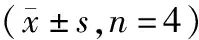
表3 各组细胞组分中TR3表达对比
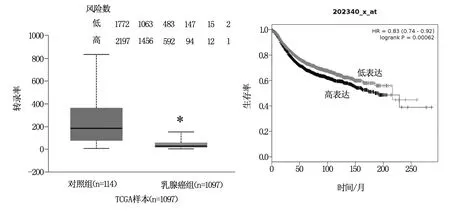
2.5 TR3对乳腺癌患者临床结局的影响
如图1所示,与正常人相比,TR3在乳腺癌患者中的表达显著降低(P<0.05)。与TR3低表达的乳腺癌患者相比,TR3高表达的乳腺癌患者总体生存率显著增加(P<0.05)。
注:*P<0.05,与对照组比较。
3 讨论
众所周知,TPA是一种肿瘤启动因子,其可通过激活蛋白激酶C(PKC)诱导肿瘤细胞侵袭[6]。然而,矛盾的是TPA又可诱导肿瘤细胞凋亡[7]。这样的矛盾点表明TPA在肿瘤中的作用需要进一步研究。本研究旨在研究TPA对乳腺癌细胞凋亡的影响,并探讨其分子机制,结果发现2.5 nM和10 nM的TPA均可抑制人乳腺癌细胞MCF-7的细胞增殖,促进其凋亡。此外,还观察到TPA作用48 h后,可明显观察到caspase-9裂解。在线粒体凋亡通路中,caspase-9募集细胞色素C和Apaf-1而激活,完整的caspase-9激活后裂解为活性片段,进而激活其下游底物caspase-3,启动线粒体凋亡通路[8],因此caspase-9裂解物的表达增加表示caspase-9激活,线粒体凋亡通路激活。这些结果证实,TPA可抑制乳腺癌细胞增殖,促进乳腺癌细胞凋亡,凋亡机制可能与线粒体凋亡通路的启动有关。
线粒体凋亡途径常伴有线粒体功能障碍[9],为进一步验证线粒体功能障碍是否介导TPA导致乳腺癌细胞凋亡过程,我们采用流式细胞仪检测2.5 nM和10 nM的TPA干预48 h后细胞线粒体膜电位、Ca2+水平和ROS水平的变化,结果发现2.5 nM和10 nM的TPA均可显著降低乳腺癌细胞线粒体膜电位,增加Ca2+水平和ROS水平。线粒体膜电位降低,导致线粒体膜通道孔(mPTP)开放,引起线粒体内钠、钾、钙等离子平衡失调,而高Ca2+水平又可进一步刺激mPTP的开放,最终导致线粒体功能紊乱及结构破坏,导致细胞死亡[10]。而TPA导致ROS水平的增加,是过度氧化应激的表现,也可进一步刺激mPTP的开放,导致细胞死亡[10]。这些结果表明,TPA诱导的线粒体功能紊乱可能是其引起细胞凋亡的机制之一。
靶向促凋亡因子TR3已成为一种新的癌症治疗策略,TR3介导的细胞凋亡主要是将TR3从细胞核转运至细胞质而引起的,最终导致线粒体中细胞色素C释放。细胞色素C是内源性凋亡通路的核心介导因子,当大量的细胞色素C释放进入细胞质后,将启动下游caspase的瀑布式激活而诱发凋亡。因此TR3由细胞核转运至细胞质是细胞凋亡的启动因素。为探讨TR3在TPA诱导细胞凋亡中的作用,我们检测TPA对乳腺癌细胞核、细胞质和线粒体中TR3蛋白表达的影响,结果显示2.5 nM和10 nM的TPA显著降低细胞核和细胞质(不含线粒体)中TR3蛋白的表达,增加细胞质(含线粒体)和线粒体中TR3蛋白的表达,提示TPA可促进TR3由细胞核向细胞质中线粒体转运,是导致细胞色素C介导的线粒体凋亡的前提条件。此外,我们的研究表明,TR3在乳腺癌患者中低表达,且其高表达可显著增加乳腺癌患者的总体生存率(OS),因此,TR3可用作乳腺癌治疗的新靶标。
总之,TPA诱导乳腺癌细胞凋亡取决于TR3蛋白的表达,分子机制是促进TR3核输出并定位于线粒体,从而引起线粒体凋亡,这进一步表明TR3是乳腺癌治疗的潜在靶标。

