TRAIL对骨肉瘤细胞U-2OS凋亡与增殖的影响
范培军 王志坚 仲 涛
骨肉瘤是最常见的恶性骨肿瘤,具有恶性程度高、转移容易、预后差等特点[1],手术与化疗是其主要治疗方法[2]。顺铂(Cisplatin,CDDP)、甲氨喋呤(Methotrexate,MTX)、阿霉素(Doxorubicin,DOX)是临床上应用最多的骨肉瘤化疗药物,但长时间应用后会对正常组织和器官产生严重的毒副作用[3-4]。TNF相关的凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)是介导细胞凋亡的信号分子,也为一种Ⅱ型跨膜蛋白,可通过与死亡受体的相互作用,从而活化Caspase蛋白酶家族的级联反应,诱导细胞凋亡[5]。当前研究表明TRAIL与化疗药物合用,可提升肿瘤细胞对TRAIL的敏感性[6-7]。本文具体探讨了TRAIL对骨肉瘤细胞U-2OS凋亡与增殖的影响,以明确TRAIL的作用效果与机制。现总结报告如下。
1 材料与方法
1.1 主要研究材料
骨肉瘤U-2OS细胞株购自湖北武汉大学中国典型培养物保藏中心,培养于含15%胎牛血清和1%青霉素/链霉素的DMEM培养基混合液内,采用37 ℃、5% CO2的培养箱进行培养。阿霉素(法玛西亚普强公司)、DMEM培养基(Gibeo公司)、人可溶性TRAIL蛋白(上海广澜生物工程公司)。
1.2 细胞分组与处理
取处于生长对数期细胞状态良好的细胞,随机分为3组,分别为对照组、阿霉素组与联合组,每组(3~5)×105个细胞/ml。对照组进行常规培养,以PBS代替药物处理;阿霉素组采用100 μg/ml的阿霉素处理,联合组在阿霉素组处理的基础上采用1 000 ng/ml的TRAIL处理。
1.3 MTT法检测细胞增殖
把处理后的细胞制成1×104个/ml的细胞悬液,每孔加入20 μl MTT染液,继续培养4 h。小心吸弃孔内培养上清,每孔加150 μl DMSO,震荡15 min,使用酶标仪测定490 nm波长吸光度,计算细胞增殖指数。
1.4 双染法检测细胞凋亡指数
细胞处理后经过消化离心,用4 ℃预冷的无菌PBS漂洗细胞2遍,用250 μl结合缓冲液重新悬浮细胞,调整细胞浓度5×105/ml,取200 μl的细胞悬液加入10 μl的Annexin联膜蛋白V-异硫氰酸荧光素,然后加入10 μl浓度20 μg/ml的碘化丙锭,室温避光孵育10 min,加入500 μl PBS后上流式细胞仪检测细胞凋亡指数。
1.5 流式细胞仪检测细胞周期
细胞处理后经过消化离心,重悬细胞,1500 rpm离心5 min,弃净上清,加入1 ml冰预冷的70%乙醇重悬细胞,4 ℃固定过夜;PBS重悬细胞,1 500 rpm离心5 min洗去乙醇;每管加入500 μl碘化丙啶染色液,室温避光孵育15 min,上流式细胞仪检测细胞周期。
1.6 Western-blot检测相关蛋白表达
细胞处理后收获细胞,裂解并提出蛋白,使用BCA试剂盒检测总蛋白浓度,上样20 μg蛋白,利用SDS-PAGE电泳对蛋白进行分离后,湿转法转膜后,通过5%脱脂牛奶进行封闭处理,时长1 h,然后加入1∶1 000稀释的一抗(抗Caspase-3抗体、抗β-actin抗体),然后放入到摇床中进行孵育,环境设置为4 ℃,时长为12 h,TBST清洗3次,每次10 min,然后加入1∶5 000稀释的二抗,再重复以上清洗,最后采用超敏ECL试剂暗室曝光检测蛋白条带。
1.7 统计学分析
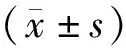
2 结果
2.1 细胞增殖指数与凋亡指数对比
处理后24 h和48 h,相比于对照组,阿霉素组和联合组的细胞增殖指数显著降低(P<0.05),细胞凋亡指数显著增加(P<0.05),阿霉素组与联合组间的对比差异也有统计学意义(P<0.05),见表1。

表1 3组处理后细胞增殖指数与凋亡指数对比
2.2 细胞周期对比
处理后48 h,相比于对照组,阿霉素组与联合组的G0/G1期比例显著降低(P<0.05),S期和G2/M期比例显著增加(P<0.05),阿霉素组与联合组间的对比差异也有统计学意义(P<0.05),见表2。

表2 3组处理后48 h细胞周期对比
2.3 蛋白表达对比
处理后24 h和48 h,相比于对照组,阿霉素组与联合组的Caspase-3蛋白相对表达水平显著增加(P<0.05),阿霉素组与联合组间的对比差异也有统计学意义(P<0.05),见表3与图1。

表3 3组处理后Caspase-3蛋白表达对比

图1 3组处理后不同时间点的Caspase-3蛋白
3 讨论
骨肉瘤是一种起源于间叶组织的恶性肿瘤,是骨骼系统最常见的恶性肿瘤,以能产生骨样组织的梭形基质细胞为特征,多发于青少年,血行转移发生率高,进展迅速,因此患者的预后比较差[8]。阿霉素目前仍然是临床上治疗骨肉瘤的主要化疗药物,但是单一用药很难见效,目前多采用多种抗肿瘤药物联合应用来治疗骨肉瘤[9-10]。
TRAIL属于肿瘤坏死因子超家族成员之一,可通过与细胞膜上的死亡受体结合,诱导肿瘤细胞凋亡,而对正常组织和细胞的毒性较低[11]。TRAIL具有胞内死亡结构域,能有效传递凋亡信号而诱导细胞凋亡。当TRAIL浓度较低时,TRAIL 能与诱导受体竞争性结合,为此对细胞的杀伤作用还不够明显;而当TRAIL浓度较高时,TRAIL可与死亡受体结合,进而诱导细胞凋亡[12-13]。本研究显示处理后24 h和48 h,相对于对照组,阿霉素组和联合组的细胞增殖指数显著降低,细胞凋亡指数显著增加,阿霉素组与联合组对比差异也有统计学意义,表明TRAIL的加入能促进细胞凋亡,抑制细胞增殖。
随着化疗方案临床应用及基础理论研究的不断深入,临床上已有多种因素可影响骨肉瘤的化疗疗效。TRAIL最主要的生物学特点是只能诱导肿瘤细胞、转化细胞凋亡,而不能诱导正常细胞凋亡[14]。细胞周期指细胞从一次分裂结束至下一次分裂完成所经历的时期,分为G0期、G1期、G2期、S期,在一系列周期蛋白的调控下,细胞周期得以正常有序的进行。当细胞周期出现异常情况时,如DNA损伤、DNA复制受阻时,细胞周期检验点将被激活,及时中断细胞周期运行并进行修复;但是如果修复失败,细胞将启动凋亡程序[15]。本研究显示处理后48 h,相对于对照组,阿霉素组与联合组的G0/G1期比例显著降低,S期和G2/M期比例显著增加,阿霉素组与联合组对比差异也有统计学意义,表明TRAIL的加入能降低G0/G1期细胞比例。
当前骨肉瘤的治疗有了很大的发展,但是传统化疗药的毒副作用及耐受性限制了其应用,因此调整化疗药物剂量以及合理选择辅助治疗药物已成为抗肿瘤研究的重要方向[16]。TRAIL与死亡受体DR4及DR5特异性结合并诱发其活化,可催化形成活化的Caspase-3,进一步进行级联反应激活下游的Caspases因子,最终诱发凋亡[17-18],并且TRAIL可促使Bax从胞浆转位至线粒体膜上,使线粒体膜通透性增强,释放大量促凋亡分子[19-20]。本研究显示处理后24 h和48 h,相对于对照组,阿霉素组与联合组的Caspase-3蛋白相对表达水平显著增加,阿霉素组与联合组对比差异也有统计学意义,表明TRAIL的加入能促进Caspase-3蛋白的表达。本研究也存在一定的不足,没有进行动物模型分析,且Caspase-3的作用信号通路分析还不够深入,将在后续研究中进行进一步分析。
总之,TRAIL在骨肉瘤细胞中的应用能促进Caspase-3蛋白表达,降低G0/G1期细胞比例,从而抑制细胞增殖,促进细胞凋亡。

