预测根治性胃癌切除术后并发症危险因素的列线图模型的建立
吕恒宇,黄 晨,夏 翔,赵 刚
上海交通大学医学院附属仁济医院胃肠外科,上海200127
胃癌是消化道最常见的恶性肿瘤之一,在全球所有恶性肿瘤中其发病率和死亡率分别排在第四位和第二位[1]。在中国,每年新增胃癌患者约40 万例,占全球新发病例的40%;年死亡病例约30 万例,占全球死亡病例的近50%[2]。不同于日本、韩国早期诊断率较高,中国胃癌早期诊断率低,近70%的患者就诊时肿瘤已处于局部进展期[3]。对于局部进展期胃癌,根治性胃癌切除术+D2 淋巴结清扫术是标准的手术治疗方式[4]。但是,该术式也同时伴随出血、肺炎、吻合口漏、吻合口狭窄和术后感染等术后并发症的发生[5]。
术后并发症不仅导致胃癌患者住院时间延长、住院费用增加、术后化学治疗(化疗)延期,还会对其长期生存造成不良影响[6-9]。所以,如何在保证肿瘤根治的前提下降低术后并发症发生的风险、缩短住院时间、减少住院费用、降低术后死亡风险并同时提高术后化疗的及时性已得到越来越多临床医师的重视。故本研究拟采用国际上较为常用的Clavien-Dindo 分级系统对胃癌术后并发症进行标准化的统计。通过单因素和多因素分析探究导致术后并发症的潜在危险因素,并以此建立根治性胃癌切除术+D2淋巴结清扫术后并发症的预测模型,旨在帮助胃肠外科医师准确评估术后并发症风险,对高风险患者采取必要的预防措施以减少术后并发症的发生率,最终达到缩短住院时间、延长生存期的目的。
1 资料与方法
1.1 研究对象
收集2016 年7 月—2019 年6 月在上海交通大学医学院附属仁济医院胃肠外科胃癌专业组接受手术治疗的胃癌患者,入组标准:①患者既往临床病史资料完整。②电子胃镜下组织病理检查诊断明确的胃腺癌。③患者接受根治性胃癌切除术+D2 淋巴结清扫术。④术前影像学检查或术中探查未发现远处转移。排除标准:①急诊手术,包括胃癌并发症如出血、梗阻、穿孔导致的急诊手术。②术后病理提示Ⅳ期或R1、R2 切除。③接受新辅助化疗的患者。研究得到上海交通大学医学院附属仁济医院伦理委员会批准(2018-105),在中国临床试验注册中心中进行了注册(ChiCTR-PIC-17012358),获得所有患者的知情同意。
1.2 变量和定义
采用Clavien-Dindo 分级系统对出现术后并发症的患者进行分组[10]。Ⅰ级并发症包括任何偏离正常术后过程但无需药物治疗或外科治疗、内窥镜和放射学干预的情况;允许使用止吐药、退热药、镇痛药、利尿剂和电解质以及理疗药物等治疗方案;还包括在床旁开放的伤口感染。Ⅱ级为需要其他药物治疗的并发症,还包括输血和全肠外营养。Ⅲ级为需要手术或介入治疗的并发症:Ⅲa 级,不需要全身麻醉;Ⅲb 级,需要全身麻醉。Ⅳ级为需要重症监护处理的并发症:Ⅳa 级,单器官衰竭;Ⅳb 级,多器官衰竭。Ⅴ级为术后死亡。
将发生≥Ⅱ级并发症的患者纳入并发症组,未发生并发症或发生Ⅰ级并发症的患者纳入无并发症组。如果单个患者发生多种并发症,则采用最高评分。相关并发症的定义如下:①肺炎:在胸部X 线或者CT 图像中出现炎性病灶,并且痰液培养呈阳性结果。②吻合口漏:术后出现发热、腹痛、腹胀及腹膜炎体征等;腹腔引流管量异常,发现肠液、胃液流出;口服造影剂后,指示剂从腹腔引流管引出;CT 图像提示吻合口周脓肿或存在积液;消化道造影发现影像对比剂在片中从吻合口向外渗或流至引流管周围。③术后出血:包括胃内出血和腹腔出血;前者表现为胃肠减压吸出大量鲜红色血液,或出现呕血、黑粪等症状;后者表现为引流管引流出鲜红血液,严重者可出现休克。④胰漏:淀粉酶水平大于上海交通大学医学院附属仁济医院临床研究中心的正常血清淀粉酶活性上限(110 U/L)3 倍。⑤乳糜漏:术后3 d 或3 d 以后引流部位或伤口处引流出乳白色液体,检验发现三酰甘油水平≥110 mg/dL。⑥腹泻:每日3 次或3 次以上稀便或水样便。⑦胃排空障碍:在没有肠梗阻的情况下,在术后第10 日不能耐受口服。⑧室上性心动过速:静息时心房率 >100 次/min。⑨尿路感染:清洁离心中段尿沉淀白细胞数≥10 个/HP(高倍视野),或有尿路感染症状者。⑩切口裂开:术后患者突然用力后,切口破裂并伴随疼痛。11 腹腔脓肿:患者术后感染形成腹腔局限性脓液聚积。12 呼吸衰竭或者心功能衰竭:急性心力衰竭和急性肺水肿,或射血分数大幅度下降(>50%)或需要气管插管的辅助通气。病理分期依据国际抗癌联盟(Union for International Cancer Control,UICC)TNM(Tumor Node Metastasis)分类第8 版[11]标准进行。
1.3 列线图模型的构建
从患者的术前基本资料、术后病程以及术后病理报告中收集术后并发症的可能危险因素,包括性别、年龄、手术方式、切除范围、肿瘤最大径、病理分级、淋巴结清扫数目等。对各类指标用χ2检验进行单因素分析,将其中有统计学意义(P<0.05)的变量进一步进行多因素Logistic回归分析,筛选出独立危险因素。将筛选结果引入R 软件(版本3.3.2),运用rms 软件包构建列线图模型。
1.4 列线图模型的验证
分别采用区分度和校准曲线评价列线图模型。绘制受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线),计算曲线下面积(area under the cure,AUC)来评价模型的区分度。绘制列线图模型预测并发症概率与实际并发症概率的校准曲线,验证列线图模型的一 致性。
将本研究中的样本作为训练组,以bootstrap 法进行内部验证;并选取2019 年7 月—12 月期间在上海交通大学医学院附属仁济医院胃肠外科胃癌专业组行根治性胃癌切除术+D2 淋巴结清扫的612 例胃癌患者作为验证组进行外部验证,其纳入和排除标准同训练组。应用区分度和校准曲线进行评价,并用Hosmer-Lemeshow 检验分别判断训练组和验证组模型的拟合优度;当P>0.05 时,认为模型的拟合优度较高。
1.5 统计学分析
采用SPSS 22.0 软件进行统计学分析。定性资料用n(%)表示,使用χ2检验。P<0.05 表示差异有统计学 意义。
2 结果
2.1 术后并发症统计
根据入组标准纳入接受根治性胃癌切除术+D2 淋巴结清扫的胃癌患者共计1 705 例。根据Clavien-Dindo 分级系统,416 例(24.4%)患者发生了≥Ⅱ级术后并发症。其中,Ⅱ级为376 例,包括胃排空障碍17 例、吻合口漏48 例、胰漏24 例、乳糜漏6 例、术后出血7 例、腹泻12例、室上性心动过速39 例、尿路感染25 例、肺炎198例;Ⅲa 级为7 例,包括切口裂开3 例、腹腔脓肿4 例;Ⅲb 级为12 例,包括吻合口漏9 例、术后出血3 例;Ⅳa级为12 例,均为心功能衰竭;Ⅳb 级为6 例,均为心功能衰竭伴肺功能衰竭;Ⅴ级为3 例。
2.2 影响术后并发症的危险因素
单因素分析显示,男性、年龄≥60 岁、T 分期、TNM 分期、肿瘤最大径≥5 cm、全胃切除以及开放手术与术后并发症发生有关(P<0.05)(表1)。进一步多因素Logistic 回归分析显示男性(OR=1.507,P=0.002)、年龄≥60 岁(OR=1.962,P=0.001)、肿瘤最大径≥5 cm(OR=1.456,P=0.002)、全胃切除(OR=1.313,P=0.026)是导致术后并发症发生的独立危险因素(表2)。
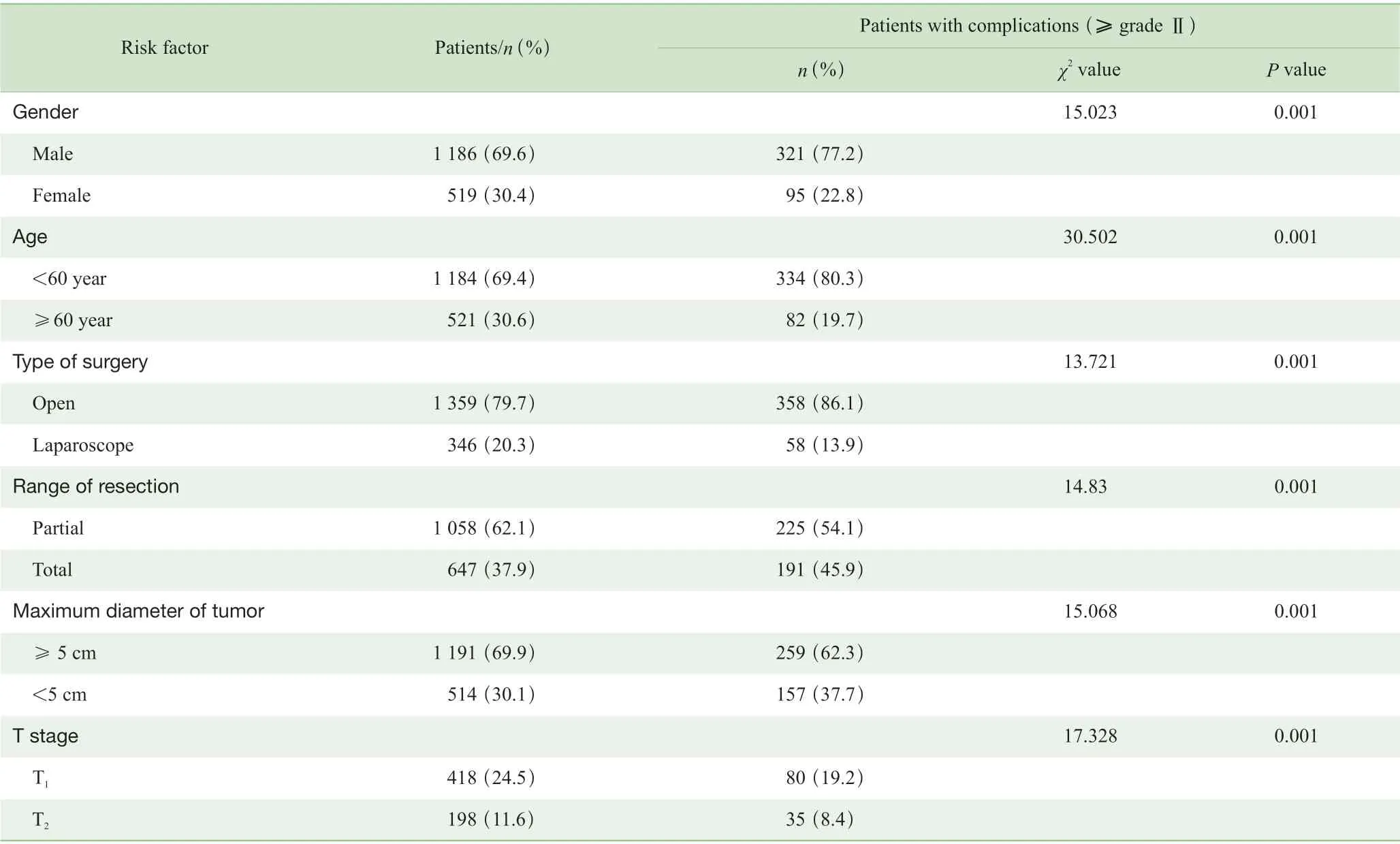
表1 1 705 例胃癌患者术后并发症(≥Ⅱ级)危险因素的单因素分析Tab 1 Univariate analysis of risk factors of postoperative complications ( ≥grade Ⅱ ) of 1 705 gastric cancer patients
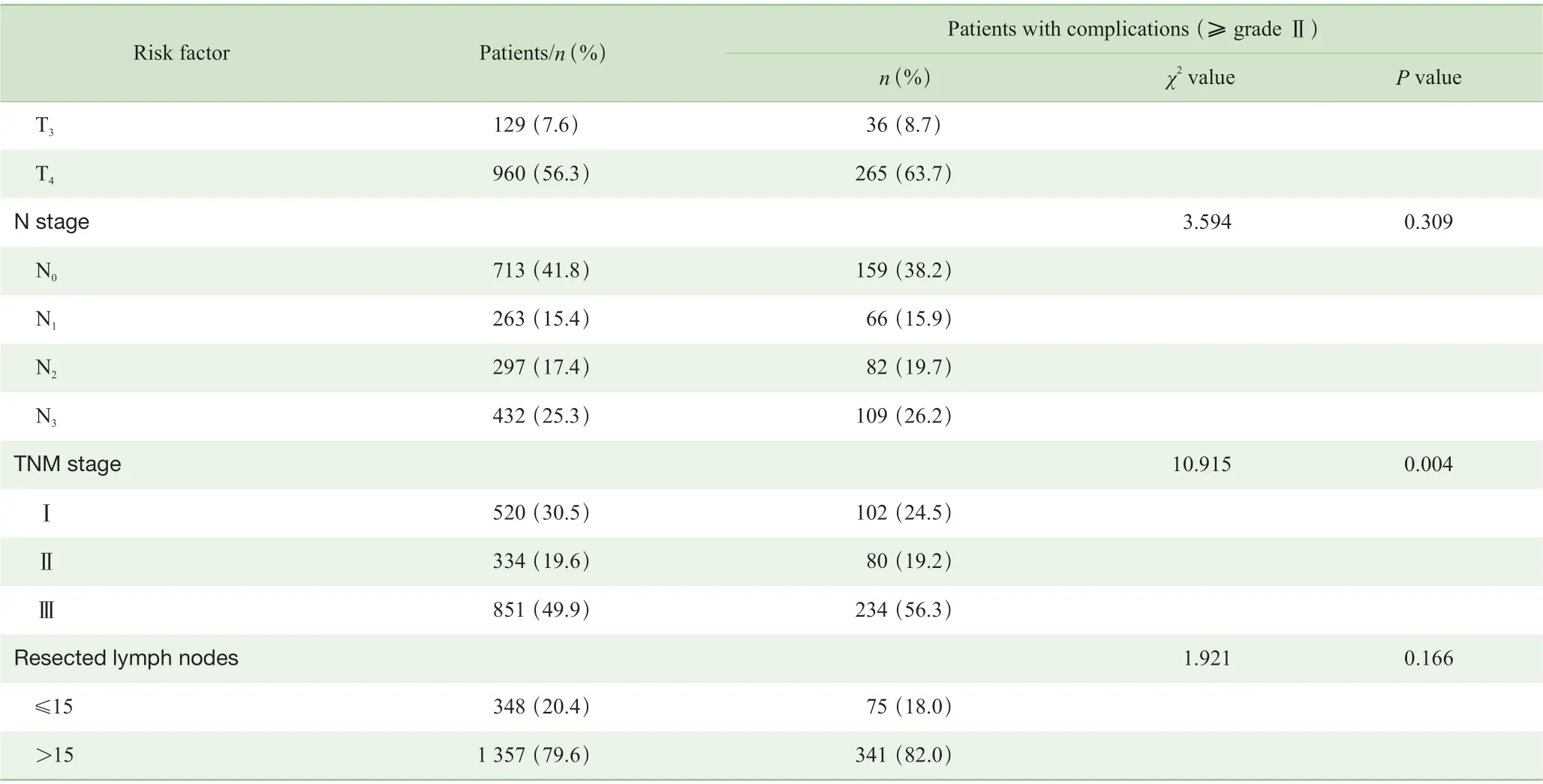
Continued Tab
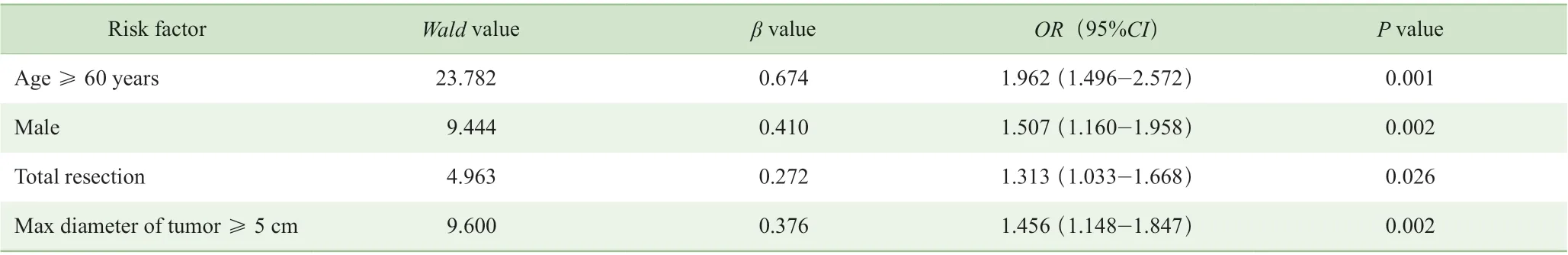
表2 1 705 例胃癌患者术后并发症(≥Ⅱ级)危险因素的多因素分析Tab 2 Multivariate analysis of risk factors of postoperative complications ( ≥grade Ⅱ ) of 1 705 gastric cancer patients
2.3 列线图模型的建立及评价
根据多因素分析结果,运用R 软件建立预测根治性胃癌切除术+D2 淋巴结清扫术后并发症的列线图模型(图1)。 通过绘制ROC 曲线,对各项危险因素及该列线图模型在训练组中的预测能力进行评价,结果显示:男性、年龄≥60 岁、肿瘤最大径≥5 cm、全胃切除预测术后并发症的AUC 分别为0.550、0.572、0.560、0.553,而列线图模型的AUC 为0.625,说明列线图模型较其他单项危险因素具备更好的预测性能(图2A);在612 例的胃癌验证组中,列线图模型(AUC=0.646)同样显示出较好的预测性能和一致性(图2B)。校正曲线显示,该模型在训练组和验证组中均具备较好的一致性(图2C、D)。用Hosmer-Lemeshow 检验分别判断训练组和验证组模型的拟合优度,结果显示训练组的P值为0.116,验证组的P值为0.961,均>0.05,表明本研究建立的列线图模型拟合优度较好。
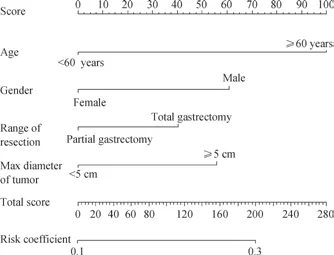
图1 预测根治性胃癌切除术后并发症(≥Ⅱ级)的列线图模型Fig 1 Nomogram predicting postoperative complications ( ≥grade Ⅱ ) after radical resection of gastric cancer
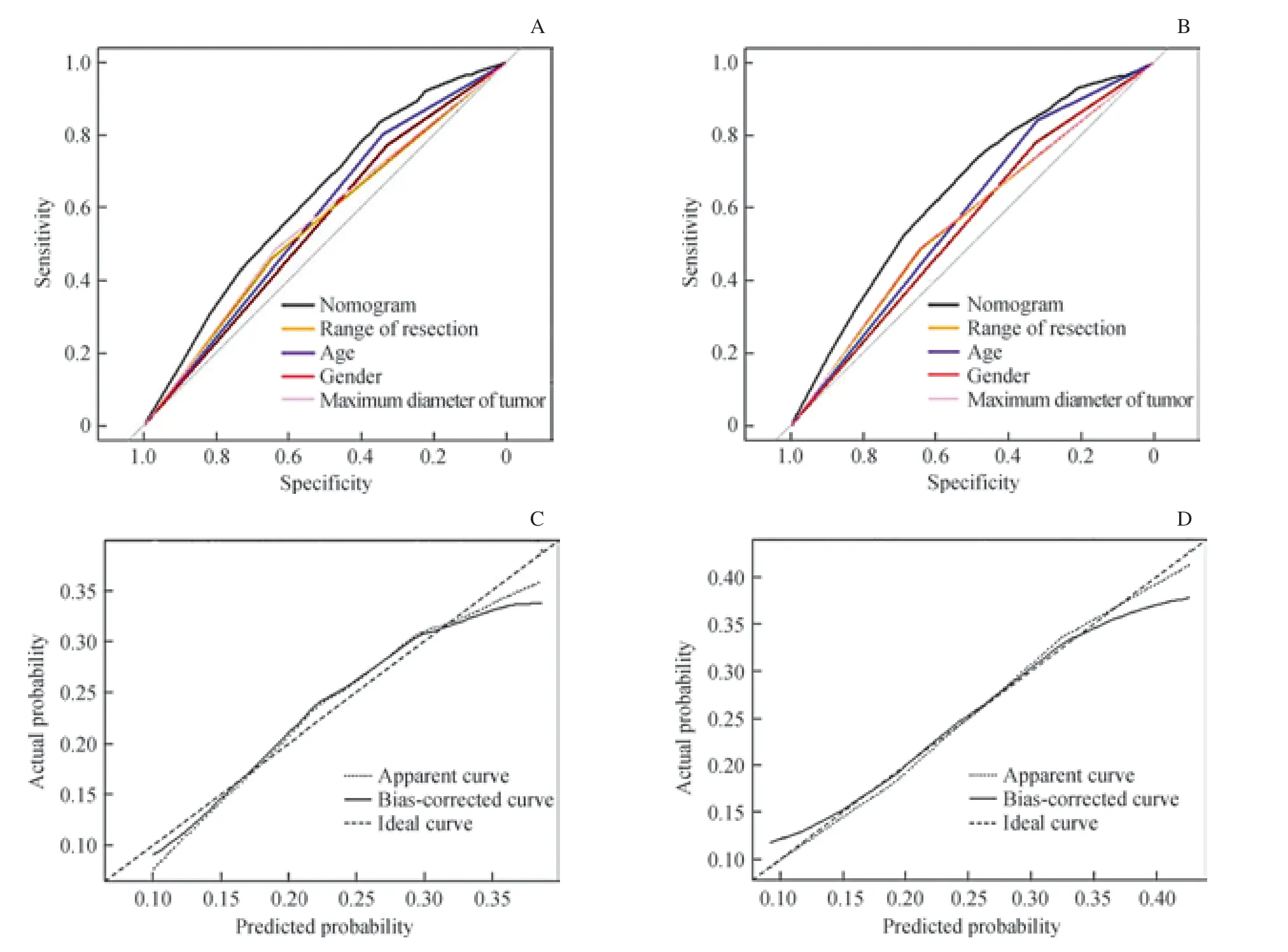
图2 在训练组(n=1 705)和验证组(n=612)中的ROC 曲线和校正曲线 Fig 2 ROC curve and calibration curve for predicting postoperative complications after radical resection of gastric cancer in training set (n=1 705) and validation set (n=612)
3 讨论
手术治疗是胃癌根治的基石。对于局部进展期胃癌,根治性胃癌切除+D2 淋巴结清扫术已获得大量循证医学证据的支持和专家的认可[12]。随着该术式在中国的推广普及,如何有效地提高手术安全性、降低术后并发症发生的风险、加快患者术后康复、减少住院时间、降低住院费用是目前胃癌外科领域的研究重点。特别是对于具有术后并发症高危因素的患者,应根据潜在的危险因素制定相对个体化术后并发症的防治策略,争取早发现、早诊断、早治疗,以促进患者快速恢复。
本研究中术后并发症的统计主要采用Clavien-Dindo分级系统[10]。该分级系统最初由Clavien 等[13]在1992 年提出,主要用于比较开放手术与腹腔镜胆囊切除术的治疗效果。2009 年,Clavien 团队[10]发表了补充和更新版本的Clavien-Dindo 分级系统和测评报告。该版本操作简易、评价客观,已广泛用于评价外科手术的治疗效果,包括胰腺外科[14]、胃肠外科[15-17]、肝外科[18]等。根据该分级系统,在本专业组接受手术治疗的1 705 例胃癌患者中≥Ⅱ级术后并发症发生率为24.4%,处于文献报道的术后并发症发生率范围(21%~50%)[7,19-21]。
多因素分析结果表明,年龄≥60 岁、男性、全胃切除、肿瘤最大径≥5 cm 是导致术后并发症发生的独立危险因素。年龄≥60 岁已经在很多文献中被证明是术后并发症的危险因素[22-23]。然而对比年龄因素,高龄导致的合并症对术后并发症的影响可能更大。已有文献表明在高龄的老年患者中,美国麻醉协会分级(American Society of Anesthesiologists,ASA)3 级、4 级的比例更高[9]。罹患心脏病或者肝病的胃癌患者术后发生并发症的风险也较高[24]。因此,高龄、伴有合并症或存在系统性疾病的胃癌患者术后发生并发症的风险较高,应引起胃肠外科医师的重视。除了高龄,全胃切除[25-26]、男性[27-28]、肿瘤最大径≥5 cm[29]也被认为是导致胃癌术后并发症发生的危险因素,这与本研究的结论相符。
列线图模型可以将多因素Logistic 回归分析结果图形化、可视化,以更加直观地衡量术后并发症的发生风险,为临床使用提供支持。本研究依据多因素分析结果,纳入年龄、性别、切除范围、肿瘤最大径4 个临床指标制定预测术后并发症的列线图模型。相较于单项指标,该模型无论在训练组还是验证组均显示出更高的区分度和准确度,可为临床胃肠外科医师预防和诊断术后并发症提供参考。但该预测模型基于单中心研究得出,仍需要多中心、前瞻性、大样本量的临床研究进一步证实。
综上所述,年龄≥60 岁、男性、全胃切除、肿瘤最大径≥5 cm 是导致接受根治性胃癌切除术+D2 淋巴结清扫术的胃癌患者术后并发症(≥Ⅱ级)发生的独立危险因素。基于这4 个独立危险因素建立的列线图模型对术后并发症有较好的预测性能,具有推广价值。
参·考·文·献
[1] van Cutsem E, Sagaert X, Topal B, et al. Gastric cancer[J]. Lancet, 2016, 388(10060): 2654-2664.
[2] Russo A, Li P, Strong VE. Differences in the multimodal treatment of gastric cancer: eastversuswest[J]. J Surg Oncol, 2017, 115(5): 603-614.
[3] Yang L, Zheng RS, Wang N, et al. Incidence and mortality of stomach cancer in China, 2014[J]. Chin J Cancer Res, 2018, 30(3): 291-298.
[4] 王宇宸, 吴舟桥, 石晋瑶, 等. 通过医嘱信息评估胃癌术后并发症登记情况的单中心可行性研究[J]. 中华胃肠外科杂志, 2019, 22(8): 729-735.
[5] 张鹏, 兰天珩, 周一鸣, 等. 胃癌根治术围手术期并发症危险因素分析[J]. 中华胃肠外科杂志, 2019, 22(8): 736-741.
[6] Wang SQ, Xu L, Wang Q, et al. Postoperative complications and prognosis after radical gastrectomy for gastric cancer: a systematic review and metaanalysis of observational studies[J]. World J Surg Oncol, 2019, 17(1): 52.
[7] Kubota T, Hiki N, Sano T, et al. Prognostic significance of complications after curative surgery for gastric cancer[J]. Ann Surg Oncol, 2014, 21(3): 891-898.
[8] Kim TH, Suh YS, Huh YJ, et al. The comprehensive complication index (CCI) is a more sensitive complication index than the conventional Clavien-Dindo classification in radical gastric cancer surgery[J]. Gastric Cancer, 2018, 21(1): 171-181.
[9] Lee KG, Lee HJ, Yang JY, et al. Risk factors associated with complication following gastrectomy for gastric cancer: retrospective analysis of prospectively collected data based on the Clavien-Dindo system[J]. J Gastrointest Surg, 2014, 18(7): 1269-1277.
[10] Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience[J]. Ann Surg, 2009, 250(2): 187-196.
[11] Amin MB, Greene FL, Edge SB, et al. The eighth editionAJCC Cancer Staging Manual: continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging[J]. CA Cancer J Clin, 2017, 67(2): 93-99.
[12] 季加孚, 季鑫, 步召德. 从规范化到精准化: 胃癌手术治疗的发展[J]. 中华外科杂志, 2016, 54(3): 164-168.
[13] Clavien PA, Sanabria JR, Strasberg SM. Proposed classification of complications of surgery with examples of utility in cholecystectomy[J]. Surgery, 1992, 111(5): 518-526.
[14] DeOliveira ML, Winter JM, Schafer M, et al. Assessment of complications after pancreatic surgery: a novel grading system applied to 633 patients undergoing pancreaticoduodenectomy[J]. Ann Surg, 2006, 244(6): 931-937.
[15] Xia X, Xu J, Zhu CC, et al.Objectiveevaluation of clinical outcomes of laparoscopy-assisted pylorus-preserving gastrectomy for middle-third early gastric cancer[J]. BMC Cancer, 2019, 19(1): 481.
[16] Powell A, Coxon AH, Patel N, et al. Prognostic significance of post-operative morbidity severity score after potentially curative D2 gastrectomy for carcinoma[J]. J Gastrointest Surg, 2018, 22(9): 1516-1527.
[17] Bosma E, Pullens MJ, de Vries J, et al. The impact of complications on quality of life following colorectal surgery: a prospective cohort study to evaluate the Clavien-Dindo classification system[J]. Colorectal Dis, 2016, 18(6): 594- 602.
[18] Levi Sandri GB, Colasanti M, Santoro R, et al. Laparoscopic right hepatectomy for hepatocellular carcinoma in cirrhotic patient[J]. Hepatobiliary Surg Nutr, 2015, 4(6): 436-438.
[19] Li ZY, Bai B, Zhao Y, et al. Severity of complications and long-term survival after laparoscopic total gastrectomy with D2 lymph node dissection for advanced gastric cancer: a propensity score-matched, case-control study[J]. Int J Surg, 2018, 54(Pt A): 62-69.
[20] Eto K, Hiki N, Kumagai K, et al. Prophylactic effect of neoadjuvant chemotherapy in gastric cancer patients with postoperative complications[J]. Gastric Cancer, 2018, 21(4): 703-709.
[21] Watanabe M, Kinoshita T, Tokunaga M, et al. Complications and their correlation with prognosis in patients undergoing total gastrectomy with splenectomy for treatment of proximal advanced gastric cancer[J]. Eur J Surg Oncol, 2018, 44(8): 1181-1185.
[22] Park DJ, Lee HJ, Kim HH, et al. Predictors of operative morbidity and mortality in gastric cancer surgery[J]. Br J Surg, 2005, 92(9): 1099-1102.
[23] Persiani R, Antonacci V, Biondi A, et al. Determinants of surgical morbidity in gastric cancer treatment[J]. J Am Coll Surg, 2008, 207(1): 13-19.
[24] Jeong SH, Ahn HS, Yoo MW, et al. Increased morbidity rates in patients with heart disease or chronic liver disease following radical gastric surgery[J]. J Surg Oncol, 2010, 101: 200-204.
[25] Bozzetti F, Marubini E, Bonfanti G, et al. Totalversussubtotal gastrectomy: surgical morbidity and mortality rates in a multicenter Italian randomized trial. The Italian Gastrointestinal Tumor Study Group[J]. Ann Surg, 1997, 226(5): 613-620.
[26] Degiuli M, Sasako M, Ponti A, et al. Morbidity and mortality after D2 gastrectomy for gastric cancer: results of the Italian Gastric Cancer Study Group prospective multicenter surgical study[J]. J Clin Oncol, 1998, 16(4): 1490-1493.
[27] Kim SM, Youn HG, An JY, et al. Comparison of open and laparoscopic gastrectomy in elderly patients[J]. J Gastrointest Surg, 2018, 22(5): 785-791.
[28] Li SS, Costantino CL, Mullen JT. Morbidity and mortality of total gastrectomy: a comprehensive analysis of 90-day outcomes[J]. J Gastrointest Surg, 2019, 23(7): 1340-1348.
[29] Jiang N, Deng JY, Ding XW, et al. Effect of complication grade on survival following curative gastrectomy for carcinoma[J]. World J Gastroenterol, 2014, 20(25): 8244-8252.

