连续型脾性腺融合1 例报道及文献复习
李晓溪,谢 华,黄轶晨,吕逸清,梁 龑,陈 方,
1. 上海市儿童医院/上海交通大学附属儿童医院泌尿外科,上海200062;2. 上海交通大学附属第六人民医院泌尿外科,上海 200233;3. 上海市东方泌尿修复重建研究所,上海200233
脾性腺融合(splenogonadal fusion,SGF)是临床少见的先天性畸形,主要表现为脾脏组织与生殖腺或中肾管残迹的异常融合[1]。因其病例少见,术前影像学检查较难做出明确诊断,临床上可能出现误诊以及不必要的睾丸切除[2]。现结合文献将上海市儿童医院/上海交通大学附属儿童医院泌尿外科诊治的1 例SGF 病例报告如下。
1 临床资料
1.1 临床表现及查体
患儿,男,4 岁,出生后1 年发现左侧阴囊无痛性团块,未予处理。后因团块3 年未缩小,于我科进一步诊疗。查体:心肺正常,腹平软;左侧腹股沟至阴囊依次可及3 个类似睾丸样团块,其上方及中部质地稍硬,下方质地稍软,位于阴囊中上部,周边有囊性感,无压痛,不可还纳。术前诊断左侧多睾症可能,并左侧鞘膜积液。
1.2 实验室及影像学检查
肿瘤标志物、内分泌检查未见明显异常。腹部B 超检查提示肝、胆、脾未见异常;腹腔、腹股沟淋巴结未见明显异常;左侧腹股沟至阴囊内自上而下见3 个低回声团,大小分别为10 mm×4 mm×6 mm、15 mm×7 mm× 8 mm、15 mm×7 mm×8 mm,左侧阴囊内探及无回声区。B 超提示左侧多睾可能,左侧鞘膜积液。盆腔CT 增强扫描提示左侧睾丸上方占位,左侧鞘膜积液,左侧精索增粗(图1A)。盆腔磁共振成像(magnetic resonance imaging,MRI)增强扫描提示左侧阴囊2 枚睾丸信号,上方1 枚异常信号(图1B)。
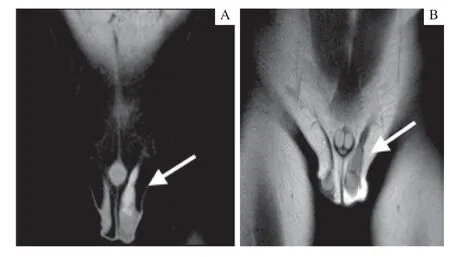
图1 盆腔CT 增强及MRI 增强扫描图像Fig 1 Enhanced CT and enhanced MRI images of pelvic cavity
1.3 治疗和随访
患儿完善术前检查行腹腔镜探查,见左侧条索状棕红色组织,近端发自脾门,远端变细并通过孔状未闭合鞘状突至腹股沟;腹股沟探查见棕红色条索增粗,远端连接棕红色团块并与睾丸上极相连,团块与睾丸边界清晰,睾丸颜色正常,考虑棕红色团块为副脾。术中所见增粗条索、团块,睾丸与术前超声描述基本相同,近端2 枚质地稍硬,远端(睾丸)质地稍软。腹腔镜下近端高位双重结扎条索并切断,从腹股沟切口将条索牵出切口外。沿团块与睾丸连接部切开包膜表面,将副脾从睾丸上极游离以保留完整睾丸组织,松解后左睾丸可位于阴囊底部,同时行左睾丸下降固定术、左侧鞘状突高位结扎术(图2)。术后苏木精-伊红染色(hematoxylin-eosin staining,H-E 染色)石蜡切片证实为副脾(图3)。手术顺利,术后第1 日出院。最后确诊为连续型SGF。术后半个月门诊复查,血常规正常,腹部B 超检查肝、胆、脾未见异常,睾丸位于阴囊内,无红肿、感染等并发症。术后随访18 个月,睾丸发育良好、无萎缩,腹部B 超提示肝、胆、脾未见异常。
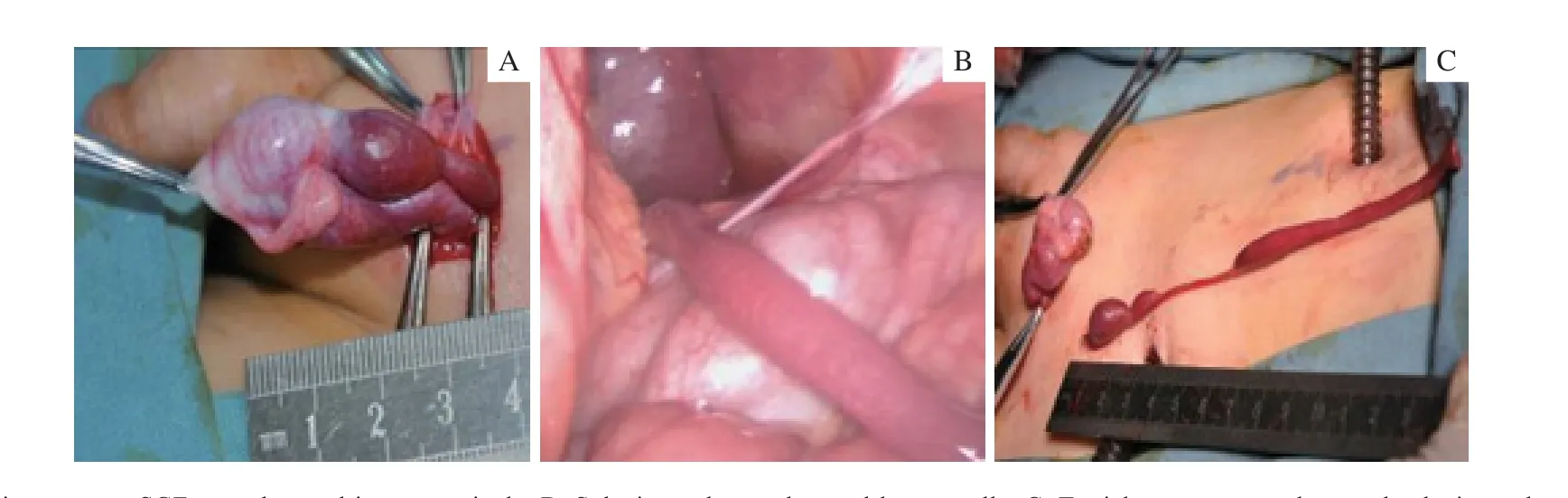
图2 连续型SGF 手术中图像 Fig 2 Intra-operative surgical procedures of continuous-type SGF

图3 副脾组织石蜡切片H-E 染色Fig 3 H-E staining of SGF tissues
2 讨论
SGF 是临床罕见的先天性畸形,多见于男性,约97%的病例发生在左侧[3]。70%的病例发病年龄小于20 岁,50%的病例小于10 岁[4],男女发病率的比例为15.0:1 ~16.6:1[5-6]。根据异位脾组织和脾脏之间有无索带连接,SGF 分为连续型和不连续型[7]。早期研究[4]显示2种类型的SGF 发生比例相近,但近年来研究[8]表明连续型SGF 比例更高。连续型SGF 中,有一条索状脾样组织或纤维组织从原位脾的上极向睾丸延伸;不连续型SGF中,脾脏和性腺之间不存在异常连接[4,9]。本病例是1 例4岁男性左侧连续型SGF。
SGF 具体发病机制尚不清楚。胚胎发育5 ~8 周,性腺尚未下降时,脾脏和性腺发生融合,同时覆盖于脾脏和生殖脊的腹膜表面的轻度炎症可能导致这2 个器官部分融合[3]。约50%的连续型SGF 伴有先天发育异常,常见伴发隐睾、四肢不全、小颌畸形,少见合并先天性心脏病、腭裂、肛门闭锁、脊柱裂,而不连续型SGF 很少合并上述先天发育异常[10]。本病例虽为连续型SGF,也未见上述相关异常。
SGF 是一种罕见的良性疾病。由于SGF 可干扰正常的睾丸下降及鞘状突闭合[11-12],故大多数SGF 病例是在腹股沟疝、隐睾或睾丸肿块等手术探查中偶然诊断发现[5]。影像学检查主要包括B 超、CT、MRI 和同位素检查。Karray 等[2]报道B 超及MRI 对SGF 检查不够精确,敏感度及特异度不高,术前很难做出精确诊断;Jakkani等[8]和Bosnalı 等[13]认为 CT 及锝-99m(99mTc)同位素扫描对SGF 有一定诊断价值,但相关报道很少。本病例术前同样未确诊,曾考虑多睾症可能,但因体检提示各团块质地不均匀,故采用腹腔镜探查才确诊为SGF。
目前,对于SGF 采取保守观察还是手术治疗仍存在争议。有文献[4]指出SGF 是良性病变,如果不存在临床症状,无需手术治疗。另有文献[2]报道SGF 虽然为良性病变,但仍需手术探查,并需术中病理组织学检查以排除恶性肿瘤。手术一般采用腹腔镜探查,对连续型SGF术中可同时切除索带以避免并发肠梗阻。由于术前缺乏对SGF 解剖的正确认识,仍然有37%的SGF 患者错误地接受睾丸切除术[14]。实际上脾组织通常可以很容易地从性腺中分离出来[15],手术应采取保留睾丸的副脾切除术。Srinivasa 等[14]报道副脾两侧纤维索带扭转360°情况下,仍可顺利保留睾丸而仅行副脾切除。本例因受异位副脾牵拉,睾丸位置上移,睾丸下降受到影响,切除副脾及索带即可使精索延展,解决睾丸未降问题。
SGF 临床症状不典型,多数没有临床症状,少部分表现阴囊肿大、肿块,个别病例表现为疼痛、睾丸炎、睾丸扭转、异位脾组织外伤性破裂或腹腔内脾索造成的肠梗阻[16],易误诊、漏诊,故需要进一步提高对SFG 的认识。结合文献,总结以下经验:①本病例表现阴囊无痛性多发团块,需要排除阴囊肿瘤,可以首选超声及肿瘤标志物进行鉴别。②超声虽然考虑多睾症可能,但查体发现团块质地与睾丸有一定差别,副脾质地比睾丸质地更硬。③本例术前仅做盆腔扫描,脾索在下腹部扫描中止时被误认为增粗的精索;术前如考虑SFG,增加腹部扫描可以发现脾索与脾脏的关系从而帮助诊断;进而行同位素扫描可进一步确诊。④术前如考虑SFG,建议进行腹腔镜探查以明确诊断;对于连续型SFG,腹腔镜下高位结扎脾索操作更为方便;因SFG 合并内环口未闭,切断脾索后可以很容易在腹股沟切口牵出脾索。⑤保留睾丸手术应作为首选,副脾与睾丸有明显边界,可以很容易将副脾从睾丸上分离。
综上所述,SFG 是一种罕见的先天性畸形,临床诊断困难;腹腔镜可作为一个有效的诊治方法,且还需提高医师对SFG 的认识,避免不必要的睾丸切除术。
参·考·文·献
[1] Sountoulides P, Neri F, Bellocci R, et al. Splenogonadal fusion mimicking a testis tumor[J]. J Postgrad Med, 2014, 60(2): 202-204.
[2] Karray O, Oueslati A, Chakroun M, et al. Splenogonadal fusion——a rare cause of scrotal swelling: a case report[J]. J Med Case Rep, 2018, 12(1): 172.
[3] Malik RD, Liu DB. Splenogonadal fusion: an unusual case of an acute scrotum[J]. Rev Urol, 2013, 15(4): 197-201.
[4] Huang GZ, Huang YD, Zeng L, et al. Continuous-type splenogonadal fusion: a case report[J]. Exp Ther Med, 2017, 13(5): 2019-2021.
[5] Kumar S, Jayant K, Agrawal S, et al. A rare case of continuous type splenogonadal fusion in a young male with primary infertility[J]. Case Rep Urol, 2014, 2014: 796761.
[6] Varma DR, Sirineni GR, Rao MV, et al. Sonographic and CT features of splenogonadal fusion[J]. Pediatr Radiol, 2007, 37(9): 916-919.
[7] Putschar WG, Manion WC. Splenicgonadal fusion[J]. Am J Pathol, 1956, 32(1): 15-33.
[8] Jakkani R, Alhajri FA, Alteriki A, et al. Discontinuous splenogonadal fusion diagnosed on computed tomography[J]. Indian J Radiol Imaging, 2016, 26(4): 506-509.
[9] Akama Y, Shimanuki K, Asahi S, et al. Incidentally detected splenogonadal fusion in a laparoscopic transabdominal preperitoneal hernia repair operation: a case report[J]. Int J Surg Case Rep, 2017, 35: 29-32.
[10] Lin CS, Lazarowicz JL, Allan RW, et al. Splenogonadal fusion[J]. J Urol, 2010, 184(1): 332-333.
[11] Lopes RI, de Medeiros MT, Arap MA, et al. Splenogonadal fusion and testicular cancer: case report and review of the literature[J]. Einstein (Sao Paulo), 2012, 10(1): 92-95.
[12] Joda AE, Aziz A. Spleno-gonadal fusion as a cause of left undescended testis: case report & review of literature[J]. J Pediatr Surg Case Rep, 2017, 21: 22-25.
[13] Bosnalı O, Cici İ, Moralıoğlu S, et al. Continuous-type splenogonadal fusion: report of a rare case[J]. Turk J Pediatr, 2014, 56(6): 680-683.
[14] Srinivasa Rao RC, Radhakrishna V, Rao N, et al. Torsion of a splenule in a case of splenogonadal fusion mimicking a strangulated inguinal hernia[J]. J Indian Assoc Pediatr Surg, 2018, 23(2): 100-102.
[15] Abokrecha A, Almatrfi A. Discontinued splenogonadal fusion and bilateral empty scrotum in an 18-month-old boy[J]. European J Pediatr Surg Rep, 2017, 5(1): E1-E3.
[16] Khairat AB, Ismail AM. Splenogonadal fusion: case presentation and literature review[J]. J Pediatr Surg, 2005, 40(8): 1357-1360.

