PolyQ 重复变异对ATXN1基因转录的影响*
陆盈,孙顺昌
(1.上海交通大学医学院附属瑞金医院 检验科,上海 200025;2.上海交通大学医学院附属瑞金医院北院 检验科,上海 201801)
脊髓小脑型共济失调(spinocerebellar ataxia, SCA)是一组临床和遗传均具异质性的遗传性神经系统退行性疾病,主要临床表现为小脑性共济失调,可伴有构音障碍、意向性震颤、眼球运动障碍等症状[1]。SCA 遗传模式有常染色体显性遗传、常染色体隐性遗传及X-连锁隐性遗传等模式,以常染色体显性遗传为主[2]。目前临床已发现30 多型SCA,其中大部分型SCA 的致病基因已被确定[3]。研究发现,SCA1、SCA2、SCA3、SCA6、SCA7、SCA12、SCA17 和齿状核红核苍白球路易体萎缩症(dentatorubral-pallidoluysian atrophy,DRPLA)等亚型是由基因编码区CAG 三核苷酸重复序列的拷贝数增加所致,而CAG 编码的氨基酸为谷氨酰胺,因此该亚型SCA 又称为多聚谷氨酰胺病,即PolyQ 病[4]。SCA1 致病机制仍不完全清楚,有研究显示SCA1 发病与突变产物的堆积有关,也有研究显示SCA1 发病与正常失调蛋白(Ataxin-1)的功能缺失有关,Ataxin-1 是ATXN1基因的表达产物[5]。本研究通过构建正常和突变的ATXN1基因,采用实时荧光定量PCR 检测正常和突变ATXN1 mRNA 的水平,分析ATXN1基因内PolyQ 重复数的增加对基因自身转录的影响。
1 材料与方法
1.1 材料
SW-CJ-1D 型超净工作台和BHC-1300IIA/B3 型生物安全柜(苏州江苏苏静集团),3111 型二氧化碳培养箱和ST16R 型低温冷冻离心机(美国赛默飞公司),MF51 型倒置显微镜(广州明美光电公司),ABI7500 荧光定量聚合酶链反应(qRT-PCR)扩增仪(美国Life technology 公司),SMA4000 型超微量分光光度计(北京Merinton 公司),Bestar 逆转录试剂盒和qRT-PCR 扩增试剂盒(德国DBI 公司),引物由Life technology 公司合成,人胚肾细胞(293T 细胞)和大肠杆菌Stbl3(广州辉骏生物科技有限公司),DMEM 细胞培养液、胎牛血清及0.25%胰蛋白酶(美国Gibco 公司),BC117125.1 克隆质粒和pLVX-Puro-3xflag-C、pMD2.G 及psPAX2 载体(广州辉骏生物科技有限公司),ATXN1-MUT 基因由广州辉骏生物科技有限公司合成。
1.2 pLVX-Puro-3xflag-ATXN1 表达载体构建及鉴定
以BC117125.1 克隆质粒为模板扩增正常ATXN1基因(ATXN1-WT),突变ATXN1基因(ATXN1-MUT)通过化学合成。ATXN1-WT 和ATXN1-MUT 用核酸内切酶EcoRⅠ和XbaⅠ进行双酶切,再用T4 DNA连接酶接到pLVX-Puro-3xflag-C 载体上构建pLVXPuro-3xflag-ATXN1-WT(野生)和pLVX-Puro-3xflag-ATXN1-MUT(突变)表达载体。同时以pLVX-Puro-3xflag-C 空载体为载体对照。将构建的野生型和突变型表达载体,以及载体对照分别导入感受态大肠杆菌Stbl3 中进行克隆,收集菌液并抽提质粒。通过核酸内切酶EcoRⅠ和XbaⅠ双酶切及测序鉴定构建的野生型和突变型ATXN1表达载体。
1.3 ATXN1 稳转细胞株的筛选及鉴定
将包装质粒和上述经鉴定构建正确的pLVX-Puro-3xflag-ATXN1-WT 或pLVX-Puro-3xflag-ATXN1-MUT表达载体质粒及载体对照分别共转染293T 细胞,产生重组慢病毒颗粒,并用超速离心法进行纯化。在Polybrene 介导下,用重组慢病毒颗粒感染293T 细胞,用Puromycin 筛选稳定表达野生和突变Ataxin-1 蛋白的细胞株,通过Western blotting 鉴定表达的野生和突变Ataxin-1 蛋白。将稳定表达野生和突变Ataxin-1 蛋白的细胞株和携带载体对照的293T 细胞继续培养,通过实时荧光定量PCR 检测ATXN1 mRNA 的表达水平。
1.4 ATXN1 转录检测方法的建立
依据Trizol RNA 分离试剂盒说明书抽提细胞内总RNA,并溶解于无RNA 酶的灭菌水中,紫外分光光度计检测RNA 浓度和纯度。将RNA 溶液加入到gDNA吸附柱,室温13 200 r/min 离心1 min,过柱,收集的滤液即为去除基因组DNA 的RNA 溶液。依据Bestar逆转录试剂盒说明书合成cDNA 备用。依据ATXN1序列(NM_001128164)和GAPDH序列(NM_002046.3),使用Primer 3 在线软件(http://primer3.ut.ee/),分别设计扩增ATXN1 和GAPDH cDNA 的引物(见表1),分别扩增目的基因ATXN1和内参基因GAPDH,表达野生和突变Ataxin-1 的细胞株分设3 份,293T 细胞和携带载体对照的293T 细胞也分设3 份,4 组同时进行扩增,依据试剂盒说明书推荐的扩增体系配置扩增反应液。扩增程序为95℃预变性2 min,共45 个循环,每一循环包括95℃变性10 s,60℃退火34 s(采集荧光信号),72℃延伸30 s,循环结束后从60℃升温到98℃获取熔解曲线。以GAPDH 扩增Ct 值(荧光信号到达设定阈值时所经历的循环数)为参考,计算ATXN1基因表达的相对量(-△Ct)=ATXN1基因Ct 值均值-GAPDH基因Ct 值均值。野生型和突变型ATXN1表达量差异(-△△Ct)=-△Ct 野生型-(-△Ct突变型)。
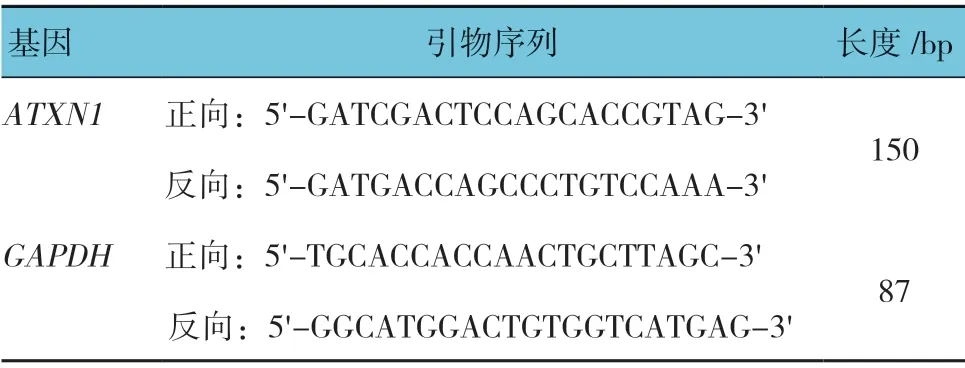
表1 PCR 扩增所用引物
1.5 ATXN1 转录检测方法的评价
通过慢病毒载体介导,本研究将野生ATXN1和突变ATXN1表达载体导入293T 细胞,通过qRT-PCR检测正常ATXN1 和突变ATXN1 的mRNA 水平。通过扩增曲线判断ATXN1和GAPDH基因是否成功扩增,通过扩增后熔解曲线分析判断ATXN1和GAPDH基因扩增是否为特异扩增。
1.6 统计学方法
数据分析采用SPSS 23.0 统计软件。细胞内野生型和突变型ATXN1相对表达量以均数±标准差(±s)表示,比较用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 ATXN1 转录水平检测方法建立成功
ATXN1和GAPDH基因的扩增曲线呈S 形,显示扩增方法成功(见图1),扩增后熔解曲线分析显示ATXN1和GAPDH基因的熔解曲线峰值分别在X 轴同一位点,说明扩增产物分别为均一性产物,即扩增为特异性扩增(见图2)。因此本研究的扩增方法可用于对ATXN1 mRNA 进行相对定量。

图1 GAPDH 和ATXN1 基因扩增曲线

图2 GAPDH 和ATXN1 基因的熔解曲线
2.2 ATXN1 基因内PolyQ 重复变异对基因自身转录的影响
通过实时荧光定量PCR 扩增发现293T 细胞内正常ATXN1 mRNA 的相对表达量为(661.9±17.7),而突变ATXN1 mRNA 的相对表达量为(381.0±20.5),两者比较,差异有统计学意义(t=17.950,P=0.006),正常ATXN1 mRNA 的相对表达量高于突变ATXN1 mRNA,正常293T 细胞和仅转染载体对照的293T 细胞中ATXN1 mRNA 的相对表达量分别为(1.0±0.1)和(0.3±0.0)。
3 讨论
ATXN1基因定位于6p23,基因全长约450 kb,含9 个外显子,表达产物为Ataxin-1 蛋白。在ATXN1基因外显子7 中存在一段CAG 三核苷酸重复序列,正常人群中重复数为6 ~44,且多被1 ~4 个编码组氨酸的CAT 序列隔开[6]。SCA1 是ATXN1基因外显子7 中的CAG 重复序列拷贝数增加所致的退行性疾病,CAG重复序列数越多,患者的发病年龄越早,疾病越严重。CAG 重复序列数增加致SCA1 的机制目前尚不完全清楚[7]。有研究发现,小鼠被敲除ATXN1基因后并未出现共济失调症状或浦肯野细胞的病理改变;另有研究发现在小鼠和果蝇体内过度表达PolyQ 超出正常长度的Ataxin-1 会导致神经退行性改变,甚至在小鼠和果蝇体内过度表达正常的Ataxin-1 蛋白也会导致神经元的退行性改变,只是病变程度较突变Ataxin-1 蛋白所致轻[8]。因此,SCA1 发病的分子机制与突变产物毒性功能获得有关。在ATXN1基因杂合突变小鼠体内,若再敲除另一拷贝的正常ATXN1基因,小鼠的SCA1症状会进一步加重,这显示正常Ataxin-1 蛋白功能的丢失也可能与SCA1 发病有关[9]。现有研究结果显示,SCA1 发病机制较为复杂,既有突变蛋白的毒性功能获得,也有野生蛋白的功能缺失[10]。此外,SCA1 的发病可能还与Ataxin-1 蛋白的修饰有关,Ataxin-1 蛋白翻译后需经修饰才具有生物功能,这些修饰有磷酸化、泛素化、类泛素化、转谷氨酰胺等,这些修饰能改变Ataxin-1 蛋白的稳定性或Ataxin-1 蛋白对靶基因的调控能力,导致SCA1 病,如Ataxin-1 蛋白776 位丝氨酸残基通过Akt 激酶被磷酸化,可与14-3-3 蛋白作用形成包涵体,使神经元发生退行性改变,Ataxin-1分子中PolyQ 长度越长,Ataxin-1 与14-3-3 蛋白作用愈强[11]。
一般认为Ataxin-1 蛋白为转录抑制因子,参与其转录调控的分子有Capicua、HDAC3、Gfi-1 等[12]。ATXN1基因外显子7 中的CAG 重复序列拷贝数增加会影响其调控的目标基因转录,但对ATXN1基因自身转录是否产生影响,目前未见报道。本研究发现,突变ATXN1基因转录产物mRNA 在细胞内的相对表达量低于正常ATXN1基因。以往研究显示,Ataxin-1蛋白有3 段氨基酸残基结构与SCA1 发病密切相关,它们分别是PolyQ 结构段、AXH 结构段及近C 端的NLS 结构段[13]。PolyQ 延伸是SCA1 发病的基础,AXH 肽段结构中570 ~689 位氨基酸对Ataxin-1 蛋白聚集作用是SCA1 发病的因素之一,NLS 结构段引导Ataxin-1 蛋白进入胞核也是SCA1 发病的一个因素[14]。本研究显示,PolyQ 延伸同时导致ATXN1基因转录量减少,推测ATXN1基因内PolyQ 重复变异抑制ATXN1基因自身转录可能对SCA1 发病产生影响,突变的Ataxin-1 量减少,则进入胞核的突变Ataxin-1减少,理论上可减轻SCA1 发病。因此,本研究认为PolyQ 延伸可通过影响基因转录,减轻SCA1 发病。
——一道江苏高考题的奥秘解读和拓展

