Wnt-1诱导分泌蛋白2对胃癌细胞上皮间质转化的影响*
任春梅,许斌,邹文蓉,彭鹏,文黎明
(四川绵阳四〇四医院 1.消化内科 2.感染科3.血液肿瘤科 四川 绵阳 621000)
胃癌是消化道常见的恶性肿瘤之一[1]。胃癌早期症状隐匿,确诊时多数患者已失去最佳的手术治疗机会。胃癌的侵袭、转移是造成患者死亡的首要原因[2],了解胃癌的侵袭、转移机制对其临床诊疗具有重要的意义。上皮间质转化(epithelial-mesenchymal transformation, EMT)是指上皮细胞向间质细胞转化的生物学过程,肿瘤细胞发生EMT 后,细胞黏附性降低,具有更强的侵袭能力,是恶性肿瘤发生侵袭和转移的重要途径[3]。Wnt-1 诱导分泌蛋白2(Wnt-inducible secreted protein 2, WISP2)是CNN 家族成员之一,广泛参与细胞增殖、分化、侵袭、间质转化、血管生成等多种生物学过程[4]。近年来的研究发现WISP2 在多种组织和肿瘤中存在差异性表达,并正向或负向调控肿瘤的发生、发展[5]。本研究旨在探究WISP2 对胃癌细胞EMT 的影响。
1 资料与方法
1.1 一般资料
选取2016年3月—2018年5月四川绵阳四〇四医院接收并行胃癌根治术的胃癌患者85 例,取其肿瘤组织和癌旁组织标本。其中,男性51 例,女性34 例;年龄34 ~77 岁,平均(56.7±5.7)岁;TNM 分期: Ⅰ期14 例,Ⅱ期29 例,Ⅲ期27 例,Ⅳ期15 例;分化程度: 高分化19 例,中分化29 例,低分化37 例;有淋巴结转移50 例,无淋巴结转移35 例。纳入标准: ①所有患者肿瘤组织标本经病理学检测确定为原发性胃癌;②所有患者术前未接受放疗、化疗等抗肿瘤治疗;③所有患者临床病理资料完整;④排除合并其他恶性肿瘤、重大脏器疾病和免疫性疾病的患者。本研究经医院医学伦理委员会批准,患者家属术前签署知情同意书。
1.2 免疫组织化学检测WISP2 的表达及其判断标准
组织标本用4%多聚甲醛固定,石蜡包埋,切片。常规脱蜡、水化,柠檬酸钠抗原修复液高压加热15 min,3%过氧化氢溶液室温孵育10 min,5% BAS 室温封闭1 h。加入1 ∶50 稀释的兔多克隆WISP2 抗体(英国Abcam 公司),4℃孵育过夜。磷酸盐缓冲液(PBS)冲洗3 次,加入1 ∶5 000 稀释的辣根过氧化物酶标记的羊抗兔二抗(上海碧云天生物技术公司),室温孵育1 h。PBS 冲洗3 次,DAB 染色液(北京中杉金桥生物技术公司)显色,苏木精-伊红(HE)(北京中杉金桥生物技术公司)复染,脱水透明,中性树胶封片。光学显微镜观察。判断标准: 免疫组织化学(以下简称免疫组化)结果由2 位病理医师采用双盲法评估,每张切片随机选取5 个视野,综合阳性细胞比例和染色强度判断。阳性细胞比例: 阳性比例<25%为1 分,25%~<50%为2 分,50%~75%为3 分,>75%为4 分;染色强度: 无着色计0 分,淡黄色计1 分,棕黄色计2 分,黄褐色计3 分。阳性细胞比例和染色强度乘积0 ~2 分为阴性,≥3 分为阳性。
1.3 WISP2 敲低稳定细胞系构建
WISP2-shRNA-GFP 或NC-shRNA-GFP慢病毒表达载体(上海吉玛制药技术有限公司构建)分别与辅助质粒pMD2.0G 和pAXAS2 共转293T 细胞,6 h 后更换培养基。48 h 后收集WISP2-shRNA 和NC-shRNA 病毒培养上清液,0.45 μm 滤器过滤,分别加入培养至对数生长期、密度为70%的人胃癌细胞MGC80-3(武汉普诺赛生命科技公司)中,37℃、5%二氧化碳CO2感染48 h 后,更换含1 μg/ml 嘌呤霉素的新鲜培养基进行筛选,当显微镜下细胞均产生绿色荧光时表明细胞系构建成功。
1.4 细胞划痕实验检测WISP2 敲低对细胞迁移能力的影响
WISP2-shRNA 和NC-shRNA 慢病毒稳定细胞系培养至对数生长期,胰酶消化,重悬、计数并调整细胞密度至2.5×105个/ml,取2 ml 接种于6 孔板(6 孔板提前用Marker 笔在板背均匀地划5 条间隔横线),每组细胞设置3 个复孔。37℃、5% CO2培养过夜后,用1 ml 枪头垂直于板背的横线划痕,PBS 洗3 次以去除被划落的细胞,加入2 ml 无血清培养基继续培养。在第0、6、12 及24 小时用细胞成像设备扫描读板,采用Image J 分析划痕修复情况。
1.5 Transwell 检测WISP2 敲低对细胞侵袭能力的影响
WISP2-shRNA 和NC-shRNA 慢病毒稳定细胞系培养至对数生长期,胰酶消化,PBS 洗2 次,无血清培养基重悬、计数并调整细胞密度至5×105个/ml,取100 μl接种于Transwell 小室(美国Corning 公司)中,下室加入500 μl 完全培养基,继续培养24 h。Transwell 小室用PBS 洗涤2 次,甲醇固定30 min。PBS 洗涤2 次后加入0.1%结晶紫(北京索莱宝生物科技公司)孵育20 min。PBS 洗涤2 次,并用棉签轻微擦拭上层未迁移的细胞,显微镜下随机选取5个视野观察细胞侵袭情况。
1.6 Western blotting 检测WISP2 敲低对E-钙黏蛋白、神经-钙黏蛋白和波形蛋白表达的影响
WISP2-shRNA 和NC-shRNA 慢病毒稳定细胞系培养至对数生长期,胰酶消化并调整细胞密度至2.5×105个/ml,取2 ml 接种于6 孔板,过夜培养后,弃上清,PBS 洗1 次,加入RIPA 裂解液(上海碧云天生物技术有限公司)300 μl,冰上裂解30 min,12 000 r/min 离心10 min,加入SDS 上样缓冲液后煮沸10 min。SDSPAGE 凝胶电泳,转膜,5% BSA 封闭,加入1 ∶50 稀释的WISP2 抗体(英国Abcam 公司),1 ∶200 稀释的E- 钙黏蛋白(E-cadherin)抗体(美国Santa Cruz Biotechnology 公司),1 ∶500 稀释的神经-钙黏蛋白(N-cadherin)抗体(美国Santa Cruz Biotechnology 公司)和1 ∶500 稀释的波形蛋白(Vimentin)抗体(美国Santa Cruz Biotechnology 公司),4℃孵育过夜。PBST 洗3 次,加入1 ∶5 000 稀释的辣根过氧化物酶标记的二抗(上海碧云天生物技术公司),PBST 洗3 次。电化学发光(ECL)液显影。
1.7 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 WISP2 在胃癌组织和癌旁组织中的表达
免疫组化结果显示,WISP2 主要定位于细胞质,在癌旁组织和胃癌组织中的阳性表达率分别为11.8%(10/85)和61.2%(52/85),两者比较,差异有统计学意义(χ2=5.836,P=0.017),WISP2 在胃癌组织中的阳性表达率高于癌旁组织。见图1。
2.2 WISP2 敲低对胃癌细胞迁移的影响
细胞划痕实验结果显示,NC-shRNA 组和WISP2-shRNA组细胞愈合程度分别为(84.74±9.61)%和(57.18±6.05)%,两者比较,差异有统计学意义(t=3.091,P=0.023),NC-shRNA 组细胞迁移能力高于WISP2-shRNA 组细胞。见图2。
2.3 WISP2 敲低对胃癌细胞侵袭的影响
Transwell 统计结果表明,NC-shRNA 组和WISP2-shRNA 组细胞侵袭个数分别为(404.91±38.16)和(195.36±23.45)个,两者比较,差异有统计学意义(t=6.377,P=0.012),WISP2-shRNA 组细胞侵袭个数较NC-shRNA 组减少。见图3。
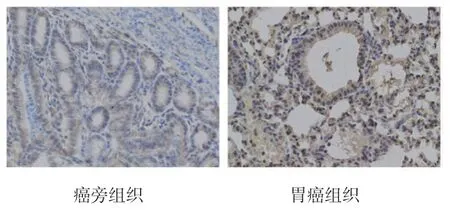
图1 WISP2 在胃癌组织和癌旁组织中的表达(免疫组织化学染色×200)
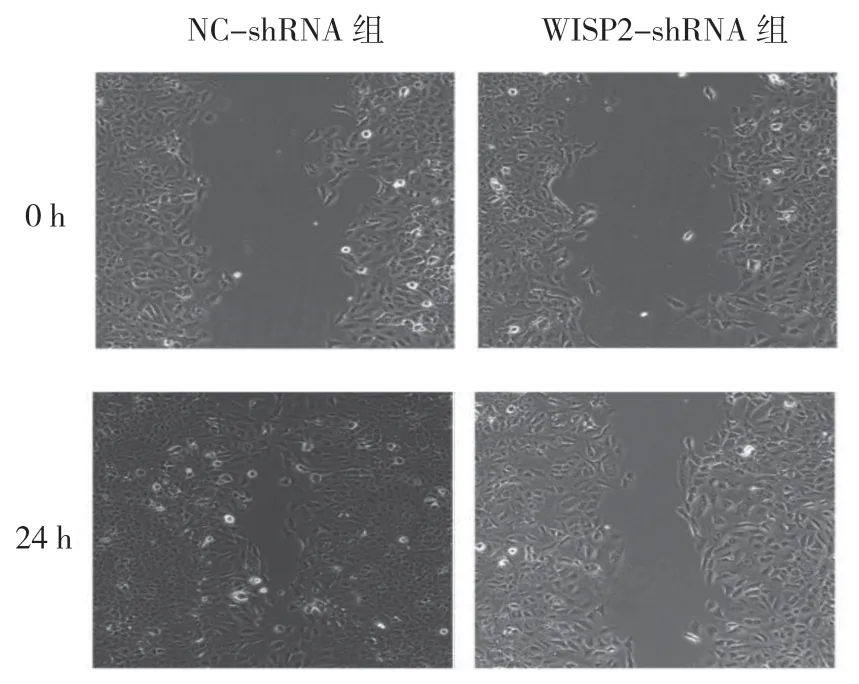
图2 WISP2 敲低对胃癌细胞迁移能力的影响
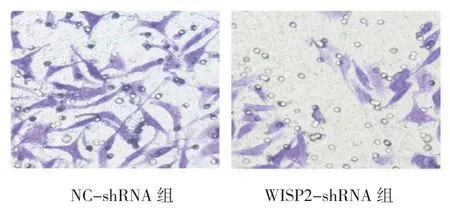
图3 WISP2 敲低对胃癌细胞侵袭能力的影响(0.1%结晶紫×400)
2.4 WISP2 敲低对胃癌细胞上皮间质转化相关蛋白表达的影响
两组E-cadherin、N-cadherin 和Vimentin 比较,差异均有统计学意义(P<0.05)。与NC-shRNA 组比较,WISP2-shRNA组细胞E-cadherin的相对表达量升高,Ncadherin 和Vimentin 的相对表达量降低。见表1和图4。
表1 两组WISP2、E-cadherin、N-cadherin 和Vimentin蛋白相对表达量比较 (±s)
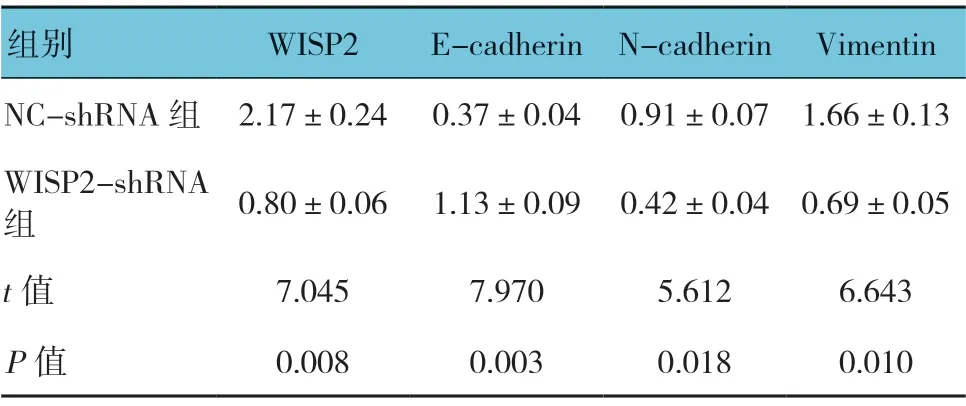
表1 两组WISP2、E-cadherin、N-cadherin 和Vimentin蛋白相对表达量比较 (±s)
组别 WISP2 E-cadherin N-cadherin Vimentin NC-shRNA 组 2.17±0.24 0.37±0.04 0.91±0.07 1.66±0.13 WISP2-shRNA组0.80±0.06 1.13±0.09 0.42±0.04 0.69±0.05 t 值 7.045 7.970 5.612 6.643 P 值 0.008 0.003 0.018 0.010
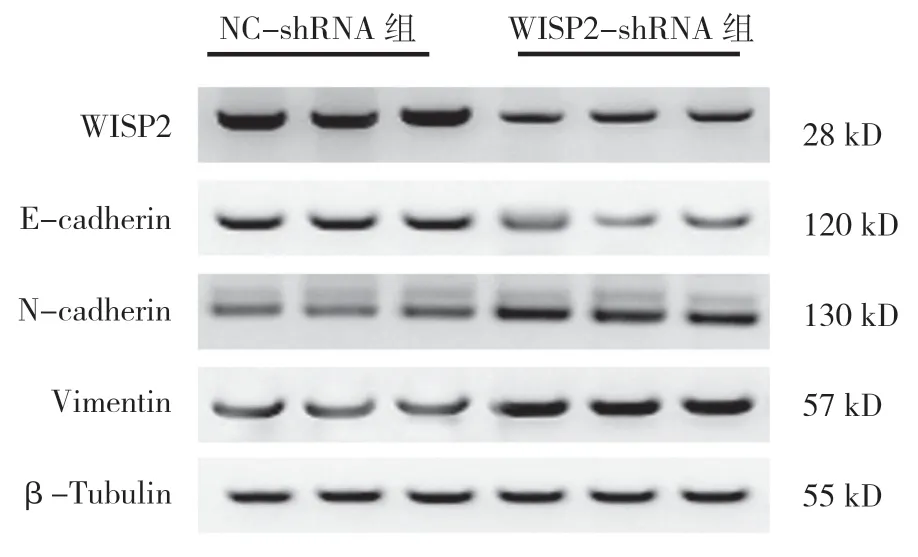
图4 WISP2 敲低对上皮间质转化相关蛋白表达的影响
3 讨论
CNN 家族包括富半胱氨酸蛋白61(CRY61)、结缔组织生长因子(CTGF)、肾母细胞瘤过表达蛋白(NOV)以及Wnt 诱导的分泌蛋白WISP-1、WISP2、WISP-3 6 种具有高度同源性和保守性的基质蛋白,在胚胎发育、血管生成、创伤修复、炎症反应、纤维化以及肿瘤疾病等多种病理生理过程中发挥关键的作用[6-7]。WISP2 又称CNN5,是一种长度为250 个氨基酸、富含半胱氨酸的分泌性蛋白多肽,在调节细胞增殖、黏附以及迁移过程中起着重要作用[8]。WISP2 的异常表达与多种肿瘤的发生、发展密切相关。如FRITAH 的研究[9]显示,WISP2 是参与维持乳腺癌上皮细胞分化表型的重要调节因子,并在肿瘤细胞的侵袭和转移中发挥关键作用;DAVIES 等[10]证明WISP2 在结直肠癌细胞表达水平低于正常组织,且与正常组织比较,高侵袭性肿瘤的表达水平更低;DHAR 的研究[11]则显示WISP2 在胰腺癌呈低表达,并密切参与胰腺癌的发生和进展。本研究发现,WISP2 在胃癌组织和癌旁组织中表达差异有统计学意义,且在胃癌组织中的阳性表达率高于癌旁组织,这与LI 等[12]的研究结果一致,提示WISP2 可能在胃癌的发生、发展中扮演重要角色。
WISP2 的表达对胃癌细胞生物学功能的影响。本研究结果显示,与NC-shRNA 组细胞比较,WISP2-shRNA 组细胞迁移能力下降,细胞划痕愈合较慢;此外,WISP2-shRNA 组细胞侵袭数较NC-shRNA 组少。WISP2 下调可抑制胃癌细胞的迁移和侵袭,在肿瘤的生长过程中起重要的调节作用。
肿瘤的发生、发展和侵袭转移是一个多基因、多水平、多步骤的复杂调控过程。研究显示,EMT 的发生与胃癌、乳腺癌、肝癌、胰腺癌、食管癌等多种肿瘤的侵袭转移密切相关[13-14]。EMT 发生后,肿瘤细胞间的黏附力下降,迁移和运动能力增强,肿瘤细胞更易脱离原发灶进入体内循环系统,进而导致远处转移的发生,已被视为促进肿瘤发生、侵袭和转移的重要机制[15]。EMT 的发生和调节涉及一系列的复杂信号传导通路,最终体现在上皮细胞标志蛋白E-cadherin、角蛋白的下降,以及间质细胞标志蛋白N-cadherin、Vimentin 和基质金属蛋白酶-9 的增加[16]。E-cadherin属钙黏蛋白家族成员,主要介导细胞连接与黏附,其表达缺失与多种上皮恶性肿瘤的侵袭和转移密切相关[17]。N-cadherin 和Vimentin 是间质细胞的重要标志蛋白,其高表达与多种恶性肿瘤的增殖、浸润以及预后不良存在相关性[18]。本研究发现,与NC-shRNA 组比较,WISP2-shRNA 组细胞E-cadherin 的表达水平升高,N-cadherin 和Vimentin 的表达水平下降,提示WISP2 的沉默可通过调控胃癌细胞的EMT 进程,进而抑制肿瘤细胞的侵袭和转移。
综上所述,WISP2 在胃癌组织中的高表达,WISP2的下调可抑制胃癌细胞的EMT 和转移过程,但WISP2参与调控EMT 的具体分子机制仍待后续的深入研究。

