电镀Cr涂层对TC4钛合金燃烧性能的影响
熊家帅,黄进峰✉,解国良,喻嘉彬,张 诚,邵 磊,王亚宇,李洪莹,何光宇
1) 北京科技大学新金属材料国家重点实验室,北京 100083 2) 空军工程大学航空航天工程学院,西安 710100
钛合金因具有比强度高、耐蚀性好、耐热性高等特点在航空、航天、化工、兵器、舰船、汽车、建筑、医疗等领域有着广阔的应用前景[1]. 然而,因其硬度低、耐磨性差、导热性差等特点,在极端工况下,存在着燃烧敏感性强的问题. 例如为了增加飞机发动机的推重比,钛合金材料常用于航空飞机发动机压气机叶片,在偶然状况下,叶片与机匣摩擦[2],会产生大量的热,由于本身导热性差,在高的热量累积与外部工况(高温、高压、高速气流)的共同作用下,使得钛合金叶片的局部能量超过其燃烧所需要的临界能量,到达某一临界温度[3−4],使其发生像木材、尼龙一样的燃烧现象,具体特征为体积减少,有火光产生,并产生大量的热[5−8]. 燃烧时的瞬间温度高达2700 ℃,速度极快,一旦发生燃烧,来不及采取灭火措施,会造成不可估量的损失[9]. 为了解决这一关键问题,进行了大量的尝试,开发了一系列阻燃钛合金和耐燃涂层. 美国和俄罗斯的研究人员先后研究出Ti-Cr-V系及Ti-Cu系阻燃钛合金. 但随着推重比的进一步提高,阻燃钛合金因重量较高已不能满足服役需求.因此,合适的阻燃涂层是提高钛合金抗燃烧性能的关键技术[10−13].
在阻燃涂层的研究中,主要集中在以下几类,一是具有良好隔热性能的涂层,如ZrO2等;二是由钇稳定二氧化锆(YSZ)的热障涂层与可磨耗封严面层构成的复合涂层;三是利用双层辉光等离子渗技术在表面渗入Cr、Cu、Mo等合金元素,形成Ti-Cr、Ti-Cu、Ti-Mo 等表面阻燃合金层等[14−16].因Cu、Cr和Ti在高温下有比较大的固溶度,常常作为复合阻燃涂层的底层,来防止熔点较低的第二层(Ni、Co、Ag 等)向基体扩散[16]. 在钛合金表面渗Cr时,Cr元素原子浓度在14%以上时,才可以实现抗烧蚀性能. 而双层辉光等离子渗Cr技术,其Cr元素呈梯度分布,最高原子浓度约为20%[15],其浓度受制于Cr元素在基体金属中的溶解度且制备成本较高. 相对而言,电镀硬Cr是一种工艺成熟的传统表面处理技术[1],不仅可以在钛合金表面制备纯Cr涂层,且具有成本低、工艺简单、适用于各种形状的零件等优点,因其具有优异的耐磨性及抗氧化性能已被广泛应用于钛合金零件的防护,如钛合金飞机起落架[17]及钛合金迫击炮身管[18]. 研究发现Ti-Cr-V系阻燃钛合金的阻燃机理是能形成致密的Cr的氧化膜而具有优良的抗燃烧性能[12],因此电镀Cr涂层也有利于提高钛合金抗燃性能,但还鲜有报道.
因此本文采用电镀硬Cr的方式制备了不同厚度Cr涂层的TC4钛合金,并通过富氧点燃试验(Promoted ignition-combustion test,PIC),分析了镀Cr后的TC4钛合金的抗燃烧性能,研究Cr层厚度对燃烧性能的影响规律. 同时,对镀Cr后的TC4钛合金的燃烧行为进行观察,采用氩气对正在燃烧的棒材进行强制熄灭[14],并对燃烧产物进行分析,探究电镀Cr层在燃烧过程中的作用,以期为未来进一步研究钛合金阻燃涂层及其机理问题起到一定的参考作用.
1 试验材料及方法
1.1 材料
本文采用商用TC4钛合金(退火态),化学成分如表1所示.
1.2 试验过程
1.2.1 镀 Cr工艺
商用 TC4 钛合金棒材尺寸为 ϕ3.2 mm×50 mm,按照以下流程进行镀Cr:清洗(除油、脱脂) →喷砂→酸洗+活化前处理→电镀硬Cr. 电镀硬Cr工艺及参数为:CrO3的浓度为 500 g∙L−1,浓 H2SO4为2.5 g∙L−1,温度为 25~30 ℃,电流密度为 30 A∙dm−2.沉积速率约为 30 μm∙h−1. 电镀完后的试样,在 1~2 h 内,放在 200 ℃ 的恒温鼓风干燥箱,保温 2 h,进行去氢处理. 通过控制电镀时间,来获取不同厚度的镀Cr层,如图1.
1.2.2 燃烧试验
采用金属材料富氧燃烧试验中应用最广的PIC实验,实验过程参考ASTM G124-10(Standardtest method for determining the combustion behavior of metallic materials in oxygen-enriched atmospheres)标准,采用自行设计的设备(图2),对尺寸为ϕ3.2 mm×50 mm 的 TC4 基体及镀有 15、30、60 μm Cr层的样品进行燃烧试验. 操作如下:将样品一端固定在样品架上,金属镁为引燃物,质量为0.05 g,抽真空至 0.01 MPa,充入氧气(体积纯度 99%)至所需压力,通过电阻丝加热引燃,在不同氧压下进行PIC实验. 用高速摄像机记录燃烧过程. 采集样品时,在0.15 MPa下,通入氩气强制熄灭,收集挥发颗粒,把样品打磨、抛光,抛光后用腐蚀液(HF、HNO3和H2O的体积比为1∶3∶6)对样品进行腐蚀,最后用扫描电镜(SEM)、X射线衍射(XRD)等方法进行观察分析.

表1 TC4 钛合金化学成分 (质量分数)Table 1 Chemical composition of TC4 titanium alloy(mass fraction) %

图1 电沉积时间与厚度的关系. (a)0.5 h;(b)1 h;(c)2 hFig.1 Diagram of plating time and thickness:(a) 0.5 h; (b) 1 h; (c) 2 h

图2 富氧点燃试验装置原理图[19]Fig.2 Schematic of the PIC test apparatus
2 试验结果
2.1 镀 Cr 后 TC4 燃烧过程观察
图3是对Cr层厚度为60 μm的 TC4棒材在0.2 MPa 氧压下燃烧过程的原位观察. 从图 3(b)和图3(c)中可以看出镁条引燃瞬间,发出耀眼白光,由于镁条燃烧释放大量热量,试样开始被引燃时,火光呈现亮白色. 随着燃烧的进行,燃烧热在燃烧端积聚,并出现熔池,火焰呈现橘黄色,熔池在重力的作用下滴落,在滴落的过程中,熔池仍在燃烧. 一旦燃烧开始,这一过程不断重复,直至样品被烧完,燃烧的过程中伴随飞溅和烟雾. 试验发现:氧压越低,熔池滴落的速度越慢,燃烧过程中飞溅现象越明显,产生的烟雾也越多. 这是因为在燃烧的过程中,燃烧速度越慢,单位时间内进入熔池的原料就越少,形成熔池及熔池滴落的速度也越慢,氧气有足够的时间进入熔池,随之燃烧越发充分,燃烧熔池的温度也就越高,而沸点较低的氧化物就会挥发,造成大量的飞溅及烟雾. 从燃烧现象的分析可知,Cr层并不能阻止TC4钛合金燃烧时的飞溅.
2.2 不同厚度的Cr层对TC4燃烧临界氧压的影响
影响燃烧临界氧压的因素主要有以下三类:(1)材料特征,主要包括化学成分、形状、尺寸等;(2)点燃特征,主要包括引燃物的种类、局部温度热量的输入等;(3)氧化剂特征,如总压力、氧分压等. 测试样品均在形状、尺寸及引燃物用量都确定的情况下,分析Cr层厚度对TC4燃烧临界氧压的影响. 图4为TC4基体、镀有15、30、60 μm 厚度Cr层的样品在富氧点燃工况下燃烧的临界氧压. 从图中可以看出,TC4钛合金在富氧点燃工况下的燃烧临界氧压为 0.07 MPa. 当 Cr层厚度为 15 μm 和30 μm时,对TC4燃烧的临界氧压影响不大. 但当涂层厚度为60 μm 时,TC4 的临界氧压升高到0.15 MPa,约为基体的2倍. 这说明Cr层较薄时,不会对TC4钛合金的临界氧压产生明显影响,Cr层越厚,对TC4钛合金临界氧压的影响越明显. 因此,镀层厚度是影响TC4钛合金临界氧压的主要因素.
2.3 不同厚度的 Cr 层对 TC4 燃烧速率的影响

图3 镀有 60 μm Cr层的 TC4 合金燃烧过程观察. (a)16.5 s;(b)16.9 s;(c)17.5 s;(d)18 s;(e)19.6 s;(f)20 s;(g)20.6 s;(h)22 sFig.3 Combustion process of TC4 alloy coated with 60 μm chromium layer:(a) 16.5 s; (b) 16.9 s; (c) 17.5 s; (d) 18 s; (e) 19.6 s; (f)20 s; (g) 20.6 s; (h)22 s

图4 Cr层厚度与 TC4 燃烧临界氧压的关系Fig.4 Relationship between the thickness of chromium layer and the threshold pressure of TC4 alloy

图5 Cr层厚度与燃烧速率之间的关系Fig.5 Combustion velocity-pressure relationship with different chromium layer thickness
燃烧速率指单位时间内熔体界面的运动速率.图5 为TC4 钛合金及镀有15、30、60 μm Cr层的样品的燃烧速率与氧压的关系图. 从图中可以看出氧压越高,镀Cr后的TC4钛合金燃烧速率越快. 同一氧压下,Cr层越厚,燃烧速率越慢. 当Cr层厚度为15 μm时,并不能明显降低TC4的燃烧速率. 当Cr层厚度为 60 μm 时,在 0.2 MPa的氧压下,可以将基体的燃烧速率降低约30%. 因此镀层厚度也是影响TC4钛合金在富氧环境中燃烧速率的重要因素.
2.4 燃烧后的形貌与成分分析
2.4.1 燃烧后的宏观形貌分析
图6为镀Cr层厚度为60 μm时,经氩气吹灭后样品的宏观形貌. 从图中可以发现,熔池的表层有一层较疏松、易脱落的红色氧化物. 说明燃烧只发生在熔池表层. 当红色疏松层脱落后,暴露出来的是黑色氧化层. 同时在热影响区与熔池的交界处,有一层黑色氧化物. 远离热影响区的基体,镀Cr层完好无损,说明在燃烧过程中,并不存在Cr层的脱落.

图6 镀Cr后的样品燃烧时被氩气吹灭后的宏观形貌Fig.6 Macroscopic morphology of chrome-plated samples after being blown away by argon
2.4.2 燃烧后的微观组织及成分分析

图7 TC4 基体氩气吹灭后的 SEM 图. (a)Ⅰ—氧化物区、Ⅱ—熔化区;(b)(a)的局部放大;(c)(a)的局部放大(Ⅱ—熔化区);(d)Ⅲ—熔化区、Ⅳ—过渡区、Ⅴ—热影响区Fig.7 SEM image of TC4 substrate being blown away by argon:(a) I—oxide zone, II—fusion zone; (b) partial enlargement of (a); (c) partial enlargement of (a) (II—fusion zone); (d) III—fusion zone, IV—transition zone, V—heat affected zone

表2 图 7 中各点 EDS 分析结果(原子数分数)Table 2 EDS analysis results of each point in Fig. 7 (atomic fraction) %
图7是TC4钛合金燃烧后的SEM图. 从图7中可看出,TC4燃烧后的组织主要包含Ⅰ—氧化物区、Ⅱ—熔化区、Ⅵ—过渡区、Ⅴ—热影响区(近过渡区一端)及未参与燃烧的基体(Ⅲ为熔化区近过渡区). 结合EDS元素分析(表2),氧化物区呈现深灰色,主要是Ti元素和O元素(点1),为Ti的氧化物. 熔化区呈现“瘤状”,包括浅灰色凸起相、浅白色析出相、黑色析出相及浅白色析出相上的白色网状物质. 其中浅灰色相和氧化区成分相同,是Ti元素和O元素,但是氧原子浓度稍低,约为15%,而黑色析出相是Al元素和O元素,为Al的氧化物(点2). 浅白色析出相与浅灰色相比较,氧原子浓度偏低(约7.5%),但是Al元素与V元素含量较高(点4),其上析出的白色相,Al、V含量更高(点 5). 从图 7(d)可以看出,在热影响区近过渡区一端(Ⅴ),存在Al元素的析出相(点6),这些析出相经过渡区,进入熔化区,形成富Ti、O相、富Al、V相、单独存在的Al元素及其氧化物.
图8是镀有60 μm Cr层的试样燃烧的SEM图.从图8中可以看出,含60 μm Cr层的试样燃烧后的组织依然包括Ⅰ—氧化物区、Ⅲ—熔化区、Ⅴ—过渡区、Ⅵ—热影响区(近过渡区一端)及未参与燃烧的基体(Ⅱ、Ⅳ为熔化区近氧化物区和熔化区近过渡区). 经EDS元素分析(表3),氧化物区呈深灰色,是Ti的氧化物(点1). 熔化区内主要是浅灰色凸起相、白色析出相及少量的黑色相.浅灰色相富Ti元素和O元素(点3),但其氧含量比氧化物区低,原子数分数约为6.5%. 白色相中Ti元素含量较低,Al元素原子数分数约为18%,Cr元素原子数分数约为25%,明显高于灰色相,V元素含量也比基体稍高,为富Cr、Al、V元素的析出相(点2). 黑色相是Al元素和O元素,为Al及其氧化物(点4). 从氧化物区到热影响区前端,Al的氧化物(黑色相)明显减少.
从图9中热影响区的外围一侧可以看出,在燃烧热和氧的共同作用下,在热影响区的外侧(横向),热影响区近过渡区一端,依次出现Ti-Cr固相扩散区、Ti-Cr熔化区和Ti的氧化区. 随着向基体区靠近(纵向),外侧Ti的氧化区逐渐消失,出现固相纯Cr区. 固相纯Cr区与Ti-Cr熔化区之间存在微观裂纹. 从图 10(a)~(c)中的元素线扫描结果来看,从热影响区到基体(纵向),Ti-Cr固相扩散区和Ti-Cr熔化区逐渐减小,直至消失,但Ti-Cr熔化区内的Cr元素原子数分数却在不断增加,但始终低于50%. 继续向基体区靠近,在熔化区消失以后,依然存在微裂纹. 裂纹左侧是Ti-Cr固相扩散区,但是从图10(c)中可以看出,裂纹左边Cr元素原子数分数最高只达到30%左右. 在裂纹右侧,Cr元素原子数分数从约60%逐渐升高到约90%,Ti元素原子数分数从约30%逐渐降低到0左右. 靠近裂纹处,Ti、Cr原子比约为 1∶2,为TiCr2金属间化合物. 因为Ti-Cr扩散是在高温极短的时间内进行的,金属间化合物的存在阻碍了元素之间的扩散,从而形成微裂纹. 继续向基体区靠近,由于温度的降低,Ti-Cr固相扩散区消失,TC4基体与Cr层之间依然存在着微裂纹,这是因为电镀Cr是Cr原子以物理结合的方式吸附在基体,放大倍数较高时,会看到微裂纹.

图8 60 μm Cr层的试样经氩气吹灭后的 SEM 图. (a) Ⅰ—氧化物区、Ⅱ—熔化区末端;(b)Ⅲ—熔化区;(c)Ⅵ—熔化区、Ⅴ—过渡区、Ⅵ—热影响区;(d)热影响区侧面Fig.8 SEM image of a 60 μm chromium layer sample being blown away by argon (a) I―oxide zone, II― fusion zone end; (b) III―fusion zone; (c)VI―fusion zone, V―transition zone, VI―heat affected zone; (d) side of heat affected zone
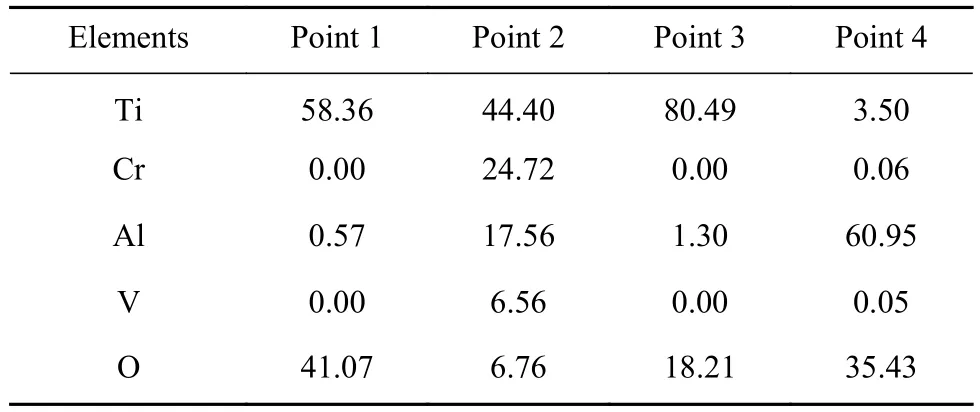
表3 图 8 中各点 EDS 分析结果(原子数分数)Table 3 EDS analysis results of each point in Fig. 8(atomic fraction) %
2.4.3 燃烧产物 XRD 分析
图11和图12分别是镀Cr前后燃烧时挥发烟雾和滴落残渣的XRD图谱. 从图11中可以看出,燃烧后挥发的烟雾主要成分是TiO2、Al2O3、V2O5和MgO(引燃物),还存在少量的Ti-Al,Al-V化合物. 镀Cr后,燃烧时挥发的烟雾的成分中并没有Cr元素及其氧化物,也说明Cr元素在燃烧的过程中并没有脱落或挥发. 从图12中可以看出,燃烧后滴落的残渣主要成分除了TiO2、Al2O3、V2O5等高价氧化物外,还存在Ti2O、TiO等中间价态的氧化物,说明即使在富氧环境中燃烧也是不充分. 而在镀Cr后的试样残渣中,还存在着少量的Cr的氧化物.
3 分析与讨论
从热力学的角度,TC4钛合金的燃烧与氧化相似,只是化学反应速率不同. 镀Cr后的TC4钛合金被镁条引燃后发出耀眼的白光,出现熔池,并伴随飞溅和烟雾的挥发,而整个过程中起到主要作用的是氧气扩散的速率和燃烧时放出的热量. 而燃烧时放出的热量的决定性因素是元素的种类和含量. 从表4中可以看出,镁条在燃烧时,放出大量热量,在一定氧压下,这些热量足以引燃TC4钛合金,被引燃后,Ti、Al等元素燃烧同样放出大量热量,足以维持TC4钛合金持续燃烧,所以TC4钛合金一旦燃烧,便不会停止,直至试样燃尽. 而Cr元素虽然在燃烧时也释放了较高的热量,但实验中发现镀Cr层并没有参与燃烧,同时降低了燃烧速率(见图5),这说明Cr层起到了阻燃作用,这可能与TC4中合金元素之间的相互作用有关.

图9 60 μm 铬层的试样经氩气吹灭后热影响区-基体 SEM 图. (a)热影响区近过渡区侧面;(b)热影响区近基体侧面;(c)基体区侧面Fig.9 SEM image of the heat-affected zone-substrate of the 60 μm chromium layer being blown away by argon (a) the side of the heat-affected zone near the transition zone; (b) the heat-affected zone near the side of the substrate; (c) the side of the matrix zone

图10 图 9 各线元素原子含量扫描结果. (a)线 1 各元素原子含量变化;(b)线 2 各元素原子含量变化;(c)线 3 各元素原子含量变化;(d)线 4 各元素原子含量变化Fig.10 EDS line scan corresponding to Fig. 9:(a) EDS line scan in line 1; (b) EDS line scan in line 2; (c) EDS line scan in line 3; (d) EDS line scan in line 4
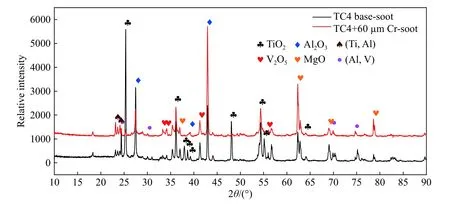
图11 TC4 基体和 60 μm Cr层的 TC4 燃烧时的挥发烟雾的 XRD 图谱Fig.11 XRD pattern of volatile for TC4 substrate and TC4 plated with 60 μm Cr layer

图12 TC4 基体和 60 μm Cr层的 TC4 燃烧后的滴落残渣的 XRD 图谱Fig.12 XRD pattern of combustion products for TC4 substrate and 60 μm Cr layer

表4 纯金属在常压下点燃时释放的热量[20]Table 4 Heat released by pure metal when ignited under normalpressure
燃烧时,影响氧气扩散速率的因素主要有氧在金属中的固溶度和氧化膜的完整性. 氧气很容易固溶到Ti、V等过渡元素中,而不易固溶到Cr、Mo等元素中. 随着温度的升高,金属的摩尔体积增加,溶解度增大,而且氧在不同相中的溶解度也不同,与相的化学稳定性有关[21]. 氧化膜的完整性取决于氧化物体积与氧化所消耗的金属体积之比γ. 当γ=1 时,氧化膜完整;γ<1 时,氧化膜不完整,没有保护性;γ>>1时,氧化物会产生很大的内应力,引起膜层开裂和剥落. 因此,氧化膜完整性的理想比值是稍大于 1. Al氧化膜γ=1.28,Ti氧化膜γ=1.95,Cr氧化膜γ=1.99[22]. 燃烧过程中,氧化膜的形成与金属氧化物自由焓有关,其决定了形成氧化物的先后顺序. 图 13 为 Ti、Cr、V、Al等金属氧化物自由焓 ∆G与温度T的关系图(数据来源于表5)[23−24],∆G的值越小,其代表的氧化物越稳定.从图中可以看出Al的氧化物的稳定性最高,合金及镀层中元素与O反应的顺序为Al、Ti、V、Cr.

图13 金属氧化物熔体界面上可能的化学反应的吉布斯自由能之间的比较Fig.13 Comparison among the Gibbs free energies of possible chemical reactions at the alloy-oxide melt interface
镀Cr前,在燃烧热与氧的共同作用下,TC4合金(图7)热影响区近过渡区一端,存在着Al元素的析出;在氧含量稍高的熔化区,由于Al元素优先与O结合,选择性氧化形成Al的氧化物(黑色相),还有一些Al元素熔于Ti中(浅白色相).Al的氧化膜γ=1.28,氧化铝膜结构紧密,具有较好的保护性,但是数量较少,无法阻止氧的扩散. 剩下的的Ti元素因O元素在其中的固溶度较高,形成富Ti、O相(凸起的浅灰色相). Ti的氧化膜在高温下会产生很大的内应力,导致膜破裂,为氧气向基体内扩散提供通道[25].
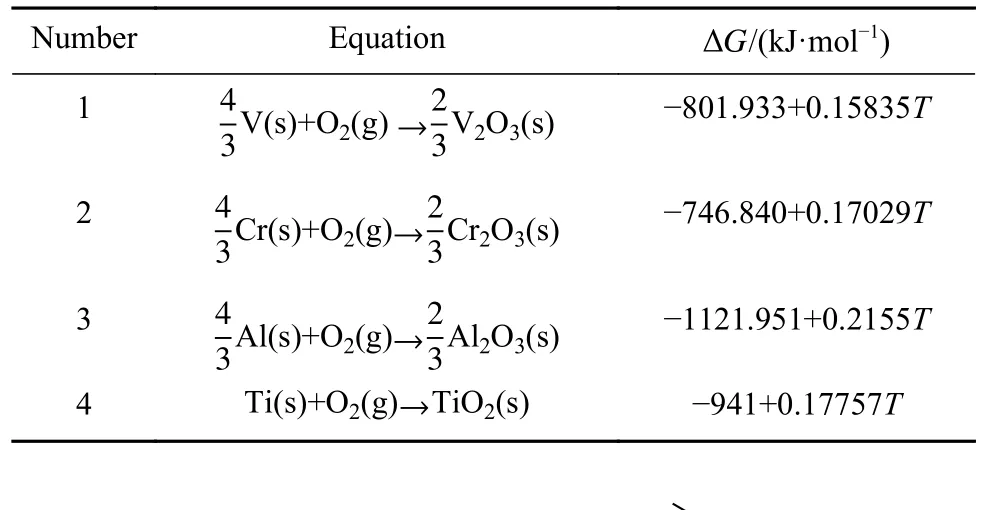
表5 金属单质生成氧化物的吉布斯自由能Table 5 Gibbs free energy of metametallic oxides

图14 热影响区一侧示意图Fig.14 Schematic diagram of the heat affected zone
镀Cr后,在燃烧热的影响下,表层Cr元素会向基体扩散,形成Ti-Cr固相区,如图14所示. 根据Ti-Cr二元相图[26],随着Cr含量的升高,固液相转变温度先降低,再升高. 在Cr原子数分数达到40%~50%之间,固液转变温度最低,为1410 ℃.随着扩散区Cr含量逐渐升高,其熔点降低. 故在Ti-Cr固相扩散区内部先出现Ti-Cr熔化区,且熔化区内Cr原子的原子数分数始终低于50%. 而熔点较高、Cr含量较低的扩散区及纯Cr区域始终保持固相. 由于热影响区横向一侧,接近火焰端(外部)导致温度较高,所以接近熔池一端,纯Cr熔化(如图 9). 随后,O原子通过液相向内扩散,Ti原子向外扩散,在Ti-Cr液相扩散区边缘形成Ti-O液相区,而未熔化的部分,阻止了侧壁的氧向Ti-Cr熔化区内的扩散,从而减缓了燃烧速率.Cr元素进入熔池,由于Al元素在Cr中的溶解度较高,Cr元素与Al、V元素共同析出,形成化学稳定性较好的富Cr、Al、V相(如图8),氧在此相中的固溶度较低,阻碍氧气向基体中扩散,并减少了Al与O的结合. 但是富Cr、Al、V相的弥散随机分布,并不能阻碍氧元素向固溶度较高的Ti中的扩散及富Ti、O的形成,所以并不能够阻止燃烧的进行,只能减缓燃烧的速率. 因此,镀Cr涂层的抗燃机理与Ti-Cr-V系阻燃钛合金的阻燃机理不同,其本质区别是Ti-Cr-V系阻燃钛合金的阻燃机理是利用燃烧产物与钛基体界面形成致密的Cr氧化膜来阻断氧气进入基体,而镀Cr涂层的抗燃机理是通过在熔池内与基体中的合金元素形成富Cr、Al、V元素相来阻碍氧气的扩散,O元素经熔池扩散到基体中的途径有两种(1)绕过富Cr、Al、V相,从富Ti、O相中扩散,此时扩散距离增加,速度减缓;(2)穿过熔化区的富 Cr、Al、V 相扩散到基体中. 由于富Cr、Al、V相有较高的化学稳定性和较低的氧气固溶度,因此能够减缓氧气的扩散,降低燃烧速率[12,27]. 从XRD的分析结果也可以说明在燃烧的过程中,以固相扩散或者熔化的方式进入熔池内的Cr元素并没有参与燃烧,只是形成了富Cr、Al、V的相进而阻碍了O元素的扩散,最后随着熔池滴落. 这也说明燃烧只发生在熔池的表层. 无论是Ti-Cr固相扩散或者是熔化都是吸热过程,说明整个燃烧过程中,Cr元素起到的都是阻燃的作用.
4 结论
(1)在富氧点燃条件下 Cr层厚度为 60 μm 时可以将TC4燃烧的临界氧压由0.07 MPa提高到0.15 MPa,约为基体的 2 倍. 氧压越高,镀 Cr后的TC4钛合金燃烧速率越快;同一氧压下,Cr层越厚,燃烧速率越慢. 在 0.2 MPa的氧压下,60 μm 厚的Cr层可以将基体的燃烧速率降低30%. 在燃烧过程中,镀层厚度是影响其燃烧性能的重要因素.
(2)在富氧环境中,镀Cr后的TC4钛合金燃烧只发生在熔池的表层,且燃烧不充分. 燃烧过程中镀Cr涂层并未发生脱落.
(3)涂层中的Cr元素并未参与燃烧,而是通过Ti-Cr固相扩散、Ti-Cr熔化及纯Cr熔化后的Ti、O的液相扩散等方式进入熔池. 在熔池内,与Al、V元素共同析出,形成富Cr、Al、V相,对O元素的扩散有阻碍作用,从而降低了燃烧速率.

