消化道肿瘤裸鼠碘-131标记短肽Tyr-GX1的显影特征
颜红英,丁鹏非,肖远红,贾莉
[1.重庆市开州区人民医院 核医学科,重庆 405400;2.重庆市梁平县人民医院 感染科,重庆 405200;3.云南省肿瘤医院(昆明医科大学第三附属医院),云南 昆明 650118]
胃肠道肿瘤是国内外常见的一类消化道恶性肿瘤,多数患者就诊时已处于肿瘤进展期或晚期,目前仍无确切有效的治疗方案,患者存活率较低[1-3]。因此,研究一种新型、更为高效的诊治方案尤为重要。GX1短肽是一种新型环状小肽,在体内外均具有肿瘤血管内皮细胞靶向性,可作为一种新型肿瘤血管标记配体,与其他抗肿瘤药物结合,在抗肿瘤血管生成方面发挥重要作用[4-7]。本实验通过合成酪氨酸修饰的血管靶向肽(Tyr-GX1)标记结肠癌和胃癌裸鼠,分析其体内显影特征,为消化道肿瘤的诊断和体位放射治疗的研究提供理论依据,进而研究碘-131(131I)标记短肽Tyr-GX1 作为肿瘤血管靶向诊断和治疗的潜在价值。
1 材料与方法
1.1 实验动物及细胞来源
32 只SPF 级健康雌性BALB/c 裸鼠,4 ~6 周,购自重庆医科大学实验动物中心,动物生产许可证号: SCXK(渝)2020-0001。人胃低分化腺癌细胞系SGC7901 与人结肠癌细胞LOVO 购自中国科学院上海细胞库。
1.2 主要试剂及仪器
Tyr-GX1(美国AAT Bioquest Inc 公司),碘-131化钠溶液(成都欣科医药有限公司),RPMI l640 培养基(美国Gibco 公司),SPECT 显像仪(德国西门子公司)。
1.3 实验方法
1.3.1 标记方法采用Iodogen 碘标法标记短肽Tyr-GX1,在包被管中加入Tyr-GX1(10μg/μl)与碘-131化钠溶液11.1 MBq,反应体系体积40μl。通过纸层析法检测标记产物放射化学纯度和标记率。在室温下,将131I 标记的短肽Tyr-GX1 分别混合新鲜人血清、乙二胺四乙酸、生理盐水、半胱氨酸,并分别在0、6、12 和24 h 检测标记率。
1.3.2 动物模型的复制将人胃低分化腺癌细胞系SGC7901 与人结肠癌细胞LOVO 置于含10%胎牛血清的RPMI 1640 培养基中,在37℃、5%二氧化碳饱和湿度培养箱中培养,取对数生长期的细胞。胰酶消化,细胞重悬,离心处理,调整细胞密度,用于建立荷胃癌与结肠癌裸鼠模型。常规消毒,4%水合氯醛0.10 ml/kg 腹腔注射麻醉裸鼠,将细胞悬液注射于裸鼠右后肢背侧。
1.3.3 荷瘤裸鼠体内标记肽生物学分布的检测荷结肠癌、胃癌裸鼠各16 只(分别设置为结肠癌组和胃癌组),均尾静脉注射131I 标记的短肽Tyr-GX1(7.4 MBq×200μl),行SPECT 检查。分批处死裸鼠,解剖并分别取肝、肾、心等不同脏器组织和血液样本,称重后检测裸鼠体内放射性计数,计算不同脏器的每克组织百分摄取率(%ID/g)、肿瘤与非肿瘤组织放射性摄取比值(T/NT)。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 131I 标记短肽Tyr-GX1 的标记率
纸层析法结果表明,131I 标记短肽Tyr-GX1 的标记率较高,为(95.67±0.79)%;放射化学纯度为(96.68±1.68)%。在室温下分别与人血清、乙二胺四乙酸、生理盐水、半胱氨酸混合24 h 后,其标记率仍然维持在90%以上,说明131I 标记短肽Tyr-GX1 在体内外有较好的稳定性。见表1。
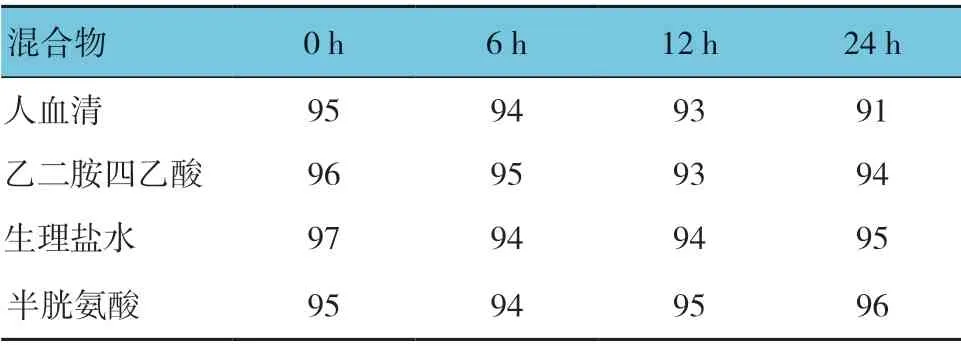
表1 不同时间点131I 标记短肽分别与人血清、乙二胺四乙酸、生理盐水、半胱氨酸混合后的标记率 %
2.2 131I 标记短肽Tyr-GX1 在结肠癌和胃癌裸鼠体内的显影特征
结肠癌组和胃癌组均在尾静脉注射131I 标记的Tyr-GX1 后8 h 开始裸鼠右后肢背侧荷瘤部位放射性浓聚较心血池本底升高,且随着标记时间延长而升高;结肠癌组16 h 时达峰值随后稍有降低,荷瘤部位和心血池本底T/NT 均>1;胃癌组荷瘤部位和心血池本底T/NT 随着时间延长而升高。两组8、12、16 和24 h131I 标记短肽Tyr-GX1 体内成像的T/NT 比较,采用重复测量设计的方差分析,结果: ①不同时间点131I 标记短肽Tyr-GX1 体内成像的T/NT 有差异(F=32.089,P=0.000);②结肠癌组与胃癌组131I 标记短肽Tyr-GX1 体内成像的T/NT 有差异(F=16.574,P=0.000);③两组131I 标记短肽Tyr-GX1 体内成像的T/NT 变化趋势有差异(F=7.675,P=0.003)。见表2。
表2 两组不同时间点131I 标记短肽Tyr-GX1 体内成像的T/NT 比较 (n =16,±s)

表2 两组不同时间点131I 标记短肽Tyr-GX1 体内成像的T/NT 比较 (n =16,±s)
注: †与结肠癌组比较,P <0.05。
组别 8 h 12 h 16 h 24 h结肠癌组 1.09±0.31 1.19±0.28 1.33±0.33 1.30±0.24胃癌组 0.85±0.19† 0.80±0.22† 0.84±0.17† 1.18±0.30†
2.3 131I 标记短肽Tyr-GX1 在荷结肠癌裸鼠肿瘤血管的靶向性
荷结肠癌裸鼠心、肺、肝、肾、胃、肌肉、肿瘤、血液和甲状腺组织在不同时间的Tyr-GX1 摄取率比较,经单因素方差分析,差异均有统计学意义(P<0.05);逐随着时间延长,荷结肠癌裸鼠心、肺、肝、肾、胃、肌肉、肿瘤、血液和甲状腺组织中Tyr-GX1摄取率逐渐降低(P<0.05),其中肝、肾组织均具有较高的放射性。1、6、12 和24 h 不同组织的Tyr-GX1 摄取率比较,经单因素方差分析,差异均有统计学意义(P<0.05);1、6、12 和24 h 肿瘤组织均高于心脏、甲状腺、胃和肌肉组织(P<0.05)。见表3。
表3 荷结肠癌裸鼠不同组织中各时间点的Tyr-GX1 摄取率 (%ID/g,±s)

表3 荷结肠癌裸鼠不同组织中各时间点的Tyr-GX1 摄取率 (%ID/g,±s)
注: ①与肝组织比较,P <0.05;②与肾组织比较,P <0.05。
组织 1 h 6 h 12 h 24 h F 值 P 值心1.14±0.08①② 0.47±0.08①② 0.30±0.07①② 0.20±0.06①② 80.703 0.000肺1.78±0.37①② 0.69±0.13①② 0.57±0.09①② 0.17±0.03①② 93.289 0.000 50.75±7.15② 25.86±2.85② 15.88±2.94 12.04±1.49 195.478 0.000肾33.84±3.84① 19.84±4.29① 14.85±2.04 10.83±1.84 132.774 0.000胃0.43±0.09①② 0.19±0.04①② 0.10±0.02①② 0.05±0.01①② 36.956 0.000肌肉 0.48±0.06①② 0.21±0.05①② 0.15±0.03①② 0.03±0.00①② 47.024 0.000肿瘤 1.45±0.12①② 0.84±0.16①② 0.75±0.04①② 0.39±0.07①② 57.816 0.000血液 4.03±0.19①② 1.02±0.09①② 0.92±0.13①② 0.13±0.03①② 98.368 0.000甲状腺 1.13±0.28①② 0.48±0.10①② 0.30±0.08①② 0.12±0.02①② 76.245 0.000 F 值 146.963 102.540 76.853 93.271 P 值 0.000 0.000 0.000 0.000肝
2.4 131I 标记短肽Tyr-GX1 在荷胃癌裸鼠肿瘤血管的靶向性
荷胃癌裸鼠心、肺、肝、肾、肠、肌肉、肿瘤、血液和甲状腺组织在不同时间的Tyr-GX1 摄取率比较,经单因素方差分析,差异均有统计学意义(P<0.05);随着时间延长,荷胃癌裸鼠心、肺、肝、肾、肠、肌肉、肿瘤、血液和甲状腺组织中Tyr-GX1 摄取率逐渐降低(P<0.05),其中肝、肾组织均具有较高的放射性。1、6、12 和24 h 不同组织的Tyr-GX1摄取率比较,经单因素方差分析,差异均有统计学意义(P<0.05);1、6、12 和24 h 肿瘤组织均高于心脏、肠、甲状腺和肌肉组织(P<0.05)。见表4。
表4 荷胃癌裸鼠不同组织中各时间点的Tyr-GX1 摄取率 (%ID/g,±s)

表4 荷胃癌裸鼠不同组织中各时间点的Tyr-GX1 摄取率 (%ID/g,±s)
注: ①与肝组织比较,P <0.05;②与肾组织比较,P <0.05。
组织 1 h 6 h 12 h 24 h F 值 P 值心1.02±0.13①② 0.39±0.08①② 0.27±0.07①② 0.20±0.04①② 76.845 0.000 1.83±0.39①② 0.66±0.14①② 0.46±0.12①② 0.13±0.03①② 60.838 0.000肝58.79±7.25② 31.76±3.19② 20.84±3.74 11.73±2.15 202.541 0.000肾33.28±1.94① 22.17±4.85① 18.14±3.90 10.48±2.27 154.848 0.000肠0.56±10.11①② 0.38±0.07①② 0.21±0.05①② 0.05±0.01①② 29.740 0.000肌肉 0.41±0.08①② 0.16±0.05①② 0.14±0.03①② 0.04±0.01①② 35.878 0.000肿瘤 1.38±0.13①② 0.98±0.07①② 0.93±0.04①② 0.49±0.06①② 65.489 0.000血液 4.09±0.68①② 1.01±0.20①② 0.82±0.15①② 0.24±0.07①② 102.483 0.000甲状腺 1.03±0.09①② 0.16±0.04①② 0.13±0.02①② 0.07±0.01①② 56.062 0.000 F 值 152.856 113.567 80.460 89.245 P 值 0.000 0.000 0.000 0.000肺
3 讨论
随着“新生血管形成诱导肿瘤生长”学说的提出,有关阻滞肿瘤新生血管形成的相关治疗方法的研究亦不断提出[8]。近年来,将放射性核素标记小分子多肽用于肿瘤疾病辅助显影逐渐增多,如放射性核素标记靶向性单抗、小肽进行放疗[9-10]。放射性靶向治疗是指将放射性核素标记配体作为示踪剂,与高表达的分子、受体结合,使肿瘤部位显影,同时根据其放射效应起到杀伤肿瘤细胞的作用[11-12]。同时,通过联合肿瘤导向治疗药物,可起到提高疗效、减轻机体其他部位药物毒性及减少不良反应的作用[13]。
本研究应用131I 标记短肽Tyr-GX1 后,分别经荷结肠癌、胃癌裸鼠尾静脉注入体内,对其24 h 内显影特征进行观察,分析标记短肽Tyr-GX1 在消化道恶性肿瘤血管的靶向性等。结肠癌组和胃癌组均在Tyr-GX1 标记后8 h 开始裸鼠右后肢背侧荷瘤部位放射性浓聚较心血池本底明显升高,且随着标记时间延长而升高;结肠癌组标记至18 h 时达峰值随后稍有降低,荷瘤部位与心血池本底T/NT 均>1;胃癌组荷瘤部位和心血池本底T/NT 随着时间延长而升高。结肠癌组与胃癌组T/NT 比值在不同时间、不同组间及变化趋势上有差异。结果提示,131I 标记短肽Tyr-GX1 与结肠癌、胃癌具有较高的结合率。
本实验中,结肠癌和胃癌示踪剂在不同脏器组织均出现快速清除,其中肝、肾组织具有较高的放射性,肿瘤组织亦存在较高的放射性,高于甲状腺和肌肉等;不同脏器组织早期放射性浓聚较高,并随着时间延长均逐渐降低,提示该标记肽具有良好的体内稳定性。采用131I 标记短肽Tyr-GX1 在荷结肠癌和胃癌裸鼠体内均具有良好的的肿瘤组织血管靶向性。活体内肿瘤血管的靶向性良好,生物分子进入动物或人体内之后不免与内环境因素相关联,如出现特异性的代谢特征、涉及被相关酶类分解的物质等,并且可能存在与体内部分分子结合而使原有生物学行为改变的情况[14-16]。所以,应基于生物学稳定性的角度研究良好的肿瘤血管导向性分子,才能保证该分子可从血液中迅速清除,从而减少与正常血管的结合,亦可提升与靶组织的结合率,最终可为肿瘤靶向治疗提供可靠的依据。
综上所述,131I 标记短肽Tyr-GX1 在荷结肠癌和胃癌裸鼠体内肿瘤血管靶向性较好,与恶性肿瘤组织具有较高的结合率,而结肠癌与胃癌的放射性浓聚和达峰时间有所不同;131I 标记短肽Tyr-GX1 可能在消化道恶性肿瘤血管靶向诊断和治疗方面具有潜在价值,但仍需进一步探究。

