慢性阻塞性肺疾病患者IL-8、LTB4、PGE2水平及与肺功能受损严重程度的相关性*
李霞,荣庆娜,江丽娟,王欢
(廊坊市人民医院 呼吸科,河北 廊坊 065000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续气流受限为主要特点的呼吸道疾病,死亡率较高[1]。COPD 常伴意识障碍、嗜睡等精神症状及咳嗽、哮喘等气道炎症反应,易引发肺源性心脏病、慢性呼吸衰竭等并发症,对患者生命健康构成极大威胁[2]。COPD 确切病因尚不清楚,普遍认为炎症细胞及其细胞因子在COPD 发生、发展中起重要作用[3]。白细胞介素-8(Interleukin 8,IL-8)是巨噬细胞和上皮细胞等分泌的细胞因子,除具有很强的促血管生成作用外还对炎症反应具有调节作用[4]。白三烯B4(leukotriene B4,LTB4)是一种由响应炎症介质的白细胞产生的白三烯类物质,与炎症反应密切相关[5]。前列腺素E2(prostaglandin E2,PGE2)是由花生四烯酸(arachidonic acid,AA)经环加氧酶(cyclooxygenase,COX)代谢产生的一种物质,具有扩张支气管和抑制炎症细胞的作用[6]。有研究发现IL-8、LTB4、PGE2 在COPD 患者中水平异常,但IL-8、LTB4、PGE2 与COPD病情相关性的研究较少[7-8]。因此本研究检测COPD 患者血清IL-8、LTB4、PGE2水平,探讨其与COPD 患者肺功能受损严重程度的相关性,为临床监测COPD 病情提供参考。
1 资料与方法
1.1 一般资料
前瞻性选择2018年5月—2019年5月廊坊市人民医院收治的98 例急性期COPD 患者作为病例组,另取同期本院健康体检者50 例作为对照组。病例组男性61 例,女性37 例;年龄41 ~75 岁,平均(65.15±5.68)岁;根据第1 秒用力呼气容积占预计值百分比(FEV1% pred)对肺功能受损严重程度进行分级[9]: Ⅰ级(FEVl% pred ≥80%)24 例,Ⅱ级(50%~<80%)29 例,Ⅲ级(30%~<50%)26 例,Ⅳ级(FEVl% pred<30%)19 例。对照组男性29 例,女性21 例;年龄42 ~77 岁,平均(66.38±5.19)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,批准号: 2015年科伦审第(59)号。
纳入标准: ①符合《慢性阻塞性肺疾病基层诊疗指南(2018年)》[10]中急性期COPD 诊断标准;②无高血压及糖尿病史;③无内分泌、神经系统疾病;④自愿签署知情同意书。排除标准: ①合并凝血功能异常;②合并免疫系统疾病;③合并肿瘤血液病;④合并心、肝、肾功能异常。
1.2 主要仪器及试剂
肺功能检测仪(珠海天创仪器有限公司,型号: M289608),离心机(北京东迅天地医疗仪器有限公司,型号: PPT10-SS),IL-8 检测试剂盒(上海信裕生物科技有限公司),LTB4 检测试剂盒(上海博湖生物科技发展有限公司),PGE2 检测试剂盒(上海继锦化学科技有限公司)。
1.3 方法
两组患者入院后记录年龄、性别等一般资料,采用肺功能检测仪检测FEVl% pred。采集患者晨起空腹静脉血5 ml,3 000 r/min 离心10 min,分离血清。采用酶联免疫吸附法(ELISA)检测血清IL-8、LTB4、PGE2 水平,所有操作由专业人士严格按照试剂盒说明书进行。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,方差分析的两两比较用SNK-q法;相关性分析用Spearman 法;影响因素的分析采用多因素Logistic 回归分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清IL-8、LTB4、PGE2 水平
病例组与对照组血清IL-8、LTB4、PGE2 水平比较,经t检验,差异有统计学意义(P<0.05),病例组高于对照组。见表1。
表1 两组血清IL-8、LTB4、PGE2 水平比较(ng/L,±s)
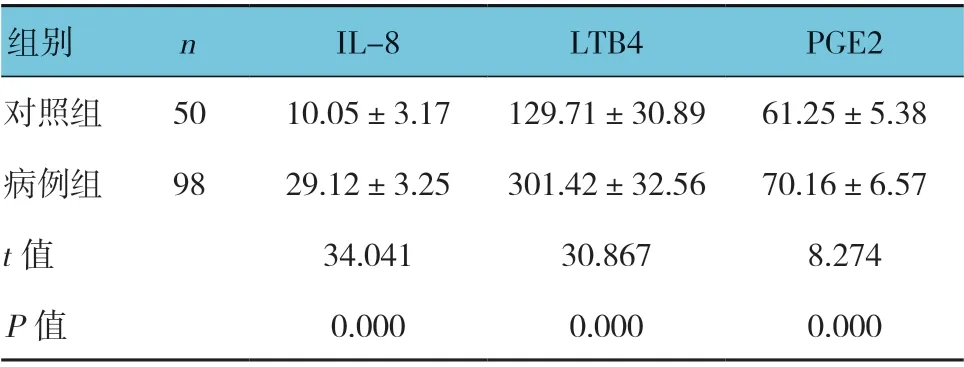
表1 两组血清IL-8、LTB4、PGE2 水平比较(ng/L,±s)
组别 n IL-8 LTB4 PGE2对照组 50 10.05±3.17 129.71±30.89 61.25±5.38病例组 98 29.12±3.25 301.42±32.56 70.16±6.57 t 值 34.041 30.867 8.274 P 值 0.000 0.000 0.000
2.2 不同肺功能受损严重程度患者血清IL-8、LTB4、PGE2 水平
不同肺功能受损严重程度患者血清IL-8、LTB4、PGE2 水平比较,经方差分析,差异有统计学意义(P<0.05);进一步组间两两比较均差异有统计学意义(P<0.05),Ⅳ级>Ⅲ级>Ⅱ级>Ⅰ级。见表2。
2.3 COPD 患者血清IL-8、LTB4、PGE2 水平与肺功能受损严重程度的相关性
COPD 患者血清IL-8、LTB4、PGE2 水平与肺功能受损严重程度均呈正相关(rs=0.712、0.561、0.476,均P=0.000)。
表2 不同分级肺功能受损严重程度患者血清IL-8、LTB4、PGE2 水平比较 (ng/L,±s)

表2 不同分级肺功能受损严重程度患者血清IL-8、LTB4、PGE2 水平比较 (ng/L,±s)
注: ①与Ⅰ级比较,P <0.05;②与Ⅱ级比较,P <0.05;③与Ⅲ级比较,P <0.05。
分级 n IL-8 LTB4 PGE2Ⅰ级 24 16.75±4.32 196.17±41.22 61.19±3.43Ⅱ级 29 25.08±5.30① 253.59±52.07① 65.24±4.25①Ⅲ级 26 33.78±6.13①② 338.94±58.76①② 69.88±5.36①②Ⅳ级 19 42.28±7.41①②③ 450.26±65.52①②③ 73.91±5.99①②③F 值 79.560 88.810 29.580 P 值 0.000 0.000 0.000
2.4 COPD 的影响因素
以是否患有COPD 为因变量(是=1,否=0),以性别(男=1,女=0)、年龄、IL-8、LTB4、PGE2 为自变量。多因素Logistic 回归分析结果表明血清IL-8、LTB4、PGE2 是COPD 的危险因素(P<0.05)。见表3。

表3 COPD 影响因素的多因素Logistic 回归分析参数
3 讨论
COPD 为一种进行性发展的慢性呼吸道疾病,病因尚不明确。以往研究报道,COPD 与肺部对有害气体或有害颗粒的异常炎症反应有关[11]。炎症细胞及细胞因子广泛参与COPD 发病,其中IL-8、LTB4、PGE2 较为常见,其对COPD 发病具有较高的特异性,受到诸多学者及临床医师的广泛关注[12]。
IL-8 是趋化因子家族的一种细胞因子,由巨噬细胞和上皮细胞等分泌产生,可参与调节人类排卵、黄体形成、子宫内膜增殖等生理过程,以及子宫内膜异位症、自然流产等病理过程,还可通过结合趋化因子受体IL-8 受体α(IL8RA)和IL-8 受体β(IL8RB)对中性粒细胞产生细胞趋化作用,从而实现对炎症反应的调节作用[13]。相关研究发现,IL-8 在毛细支气管炎患儿血清中高表达且与病情相关[14]。本研究结果显示,病例组血清IL-8 水平高于对照组,COPD 患者血清IL-8 水平随肺功能受损严重程度加重而升高,且Spearman 相关性分析显示COPD 患者血清IL-8 水平与肺功能受损严重程度呈正相关。由此提示IL-8 在COPD 患者血清中高表达,并与COPD 发生及肺功能受损严重程度相关。分析其原因,COPD 病理基础是气道的慢性非特异性炎症,管壁以T 淋巴细胞浸润为主,管腔内以中性粒细胞聚集为主,IL-8 能够趋化T淋巴细胞、中性粒细胞等聚集到炎症部位,促使炎症介质大量释放,从而破坏肺组织结构,因此IL-8 在COPD 患者血清中高表达。
LTB4 是一种与炎症反应有关的白三烯类物质,由响应炎症介质的白细胞产生,可引起中性粒细胞、淋巴细胞、嗜酸性粒细胞等炎症细胞趋化聚集,导致细胞因子分泌和免疫球蛋白E 合成,参与气道炎症反应。在中性粒细胞中,LTB4 也是一种强效化学诱导物,能够诱导形成活性氧和促进溶酶体中酶的释放[15]。有研究发现,COPD 患者呼出气冷凝液中的中性粒细胞趋化活性在LTB4 作用下增强[16]。本研究结果显示病例组血清LTB4 水平高于对照组,提示LTB4 在COPD患者血清中高表达;Spearman 相关性分析显示COPD患者血清LTB4 水平与肺功能受损严重程度呈正相关,提示血清LTB4 水平越高的COPD 患者其肺功能受损严重程度分级越高。
前列腺素(PG)是一类广泛分布于身体各组织和体液中有生理活性的不饱和脂肪酸。PG 与其特异性受体结合后可以介导细胞增殖、分化、凋亡等一系列细胞活动,并在调节心血管系统平衡、血小板聚集中发挥重要作用。此外PG 也可参与炎症反应[17]。PGE2 是由AA 经COX 代谢产生的一种物质,可抑制炎症细胞,保护支气管[18]。有研究发现,COPD 患者支气管上皮细胞培养上清液中PGE2 水平较健康体检者明显升高[19],这在本研究中也得到了证实。本研究结果显示,PGE2 在COPD 患者血清中高表达,并与患者肺功能受损严重程度呈正相关。进一步采用多因素Logistic 回归分析COPD 影响因素,发现血清IL-8、LTB4、PGE2 是COPD 的危险因素。分析其原因可能为吸烟、职业粉尘、有害气体等导致机体肺部炎症细胞活化,释放IL-8、LTB4、PGE2 等细胞因子,而趋化和调控中性粒细胞,使中性粒细胞在气道内募集和激活,引发气道、肺实质、肺血管等部位产生慢性炎症,最终导致COPD 发生。
综上所述,IL-8、LTB4、PGE2 在COPD 患者血清中高表达,与COPD 发生及肺功能受损严重程度相关,有望成为预测COPD 发生、发展的指标之一。

