新型N-取代邻苯二甲酰亚胺-4-甲酰胺衍生物的合成及抗癌活性
何华龙, 冯盏盏, 高添桃, 余洛汀*, 奉 强
(1. 四川大学 化学工程学院,四川 成都 610041; 2. 四川大学 生物治疗国家重点实验室,四川 成都 610041; 3. 成都师范学院 化学与生命科学学院,四川 成都 611130)
癌症是当前世界上最严重的社会健康问题之一[1]。合成致死是一种非常好的癌症治疗策略[2]。2014年,FDA批准Olapaib用于治疗既往接受过两次以上治疗且携带种系BRCA突变的晚期卵巢癌患者,它是一种靶向聚ADP核糖聚合酶(Poly ADP-ribose Polymerase)的癌症疗法,也是第一种成功利用合成致死(Synthetic Lethality)概念获得批准在临床使用的抗癌药物[3]。PARP-1主要的生物功能是参与单链DNA断裂(single-strand DNA breaks,SSBs)的损伤修复过程[4-8],Brca1/2主要的生物功能是参与双链DNA断裂(double-strandDNA breaks, DSBs)的损伤修复过程[9]。而当两个修复过程均被抑制时,DNA修复过程会受到阻滞从而积累更多的断裂DNA,从而导致染色体畸变最终引起细胞死亡。
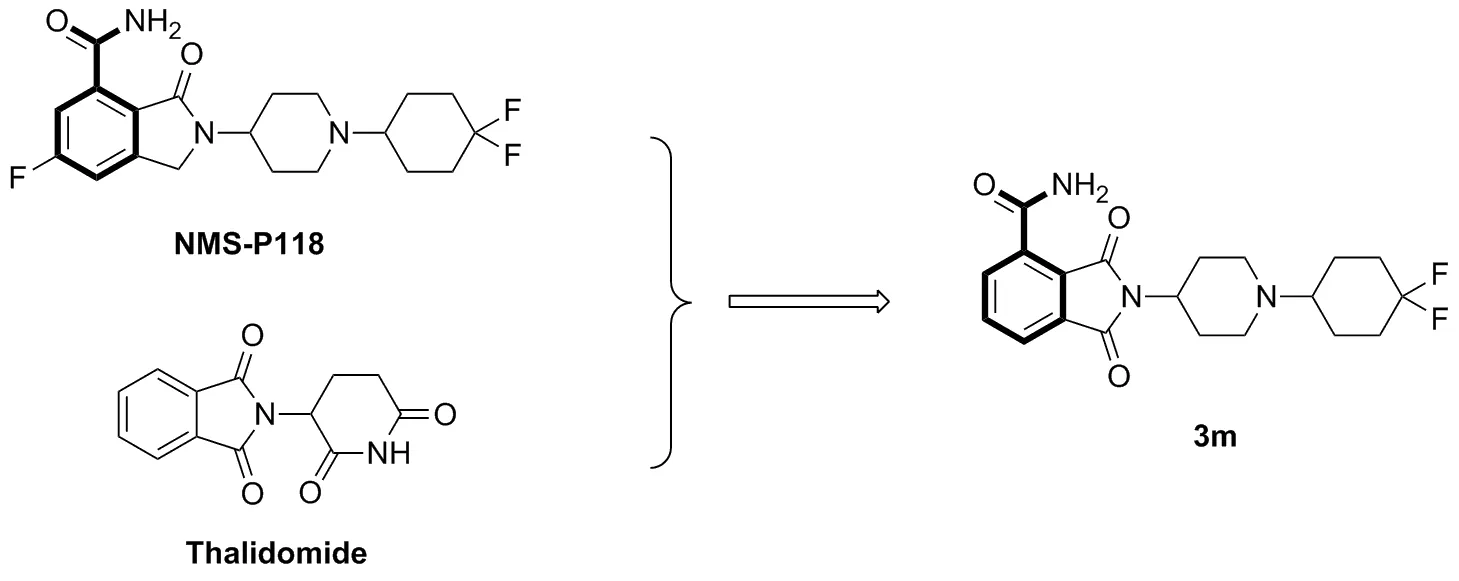
Chart 1
Scheme 1
邻苯二甲酰亚胺衍生物通常呈现多样的生物活性,因此近年来针对邻苯二甲酰亚胺分子的结构修饰被广泛研究[10-13]。酰亚胺氮上取代的衍生物是邻苯二甲酸酐与伯胺类化合物的缩合分子,他们可以作为新生血管生成抑制剂[14]和免疫调节剂[15-16]。PARP-1抑制剂通常是胺甲酰化苯并杂环衍生物,芳环甲酰胺是抑制该酶必不可少的活性结构[17]。 NMS-P118是一种有效的、具有口服活性、高度选择性的PARP-1抑制剂,具有良好的药物吸收和药物动力学特性,对PARP-1的选择性比对PARP-2高150倍[18]。因此,我们基于PARP-1抑制剂NMS-P118设计以N-取代邻苯二甲酰亚胺-4-甲酰胺为母核(Chart 1)的一系列化合物。
Brca1/2突变型的癌细胞系会对PARP-1抑制剂非常敏感,这是因为Brca1/2缺陷时同时抑制PARP-1会引起合成致死[3],导致癌细胞死亡。因此本文采用Brca2突变型胰腺癌细胞系Capan-1对化合物的活性进行测试,同时选取三阴性乳腺癌细胞系MDA-BA-231作为阳性对照。
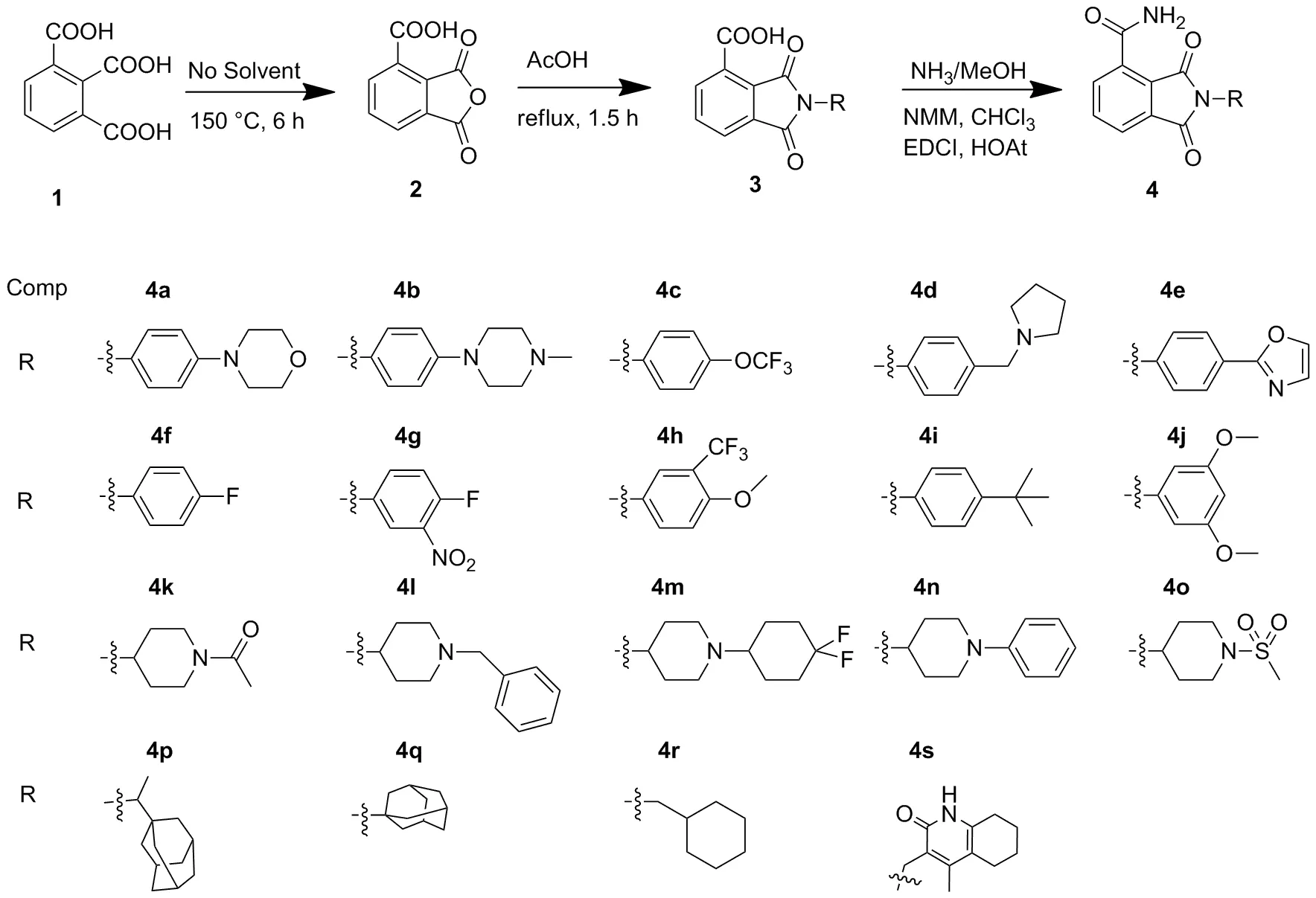
N-取代邻苯二甲酰亚胺-4-甲酰胺母核是作为PARP-1抑制剂一类全新的骨架。以1,2,3-苯三甲酸(1)为原料,在加热条件下进行分子内脱水得到3-羧酸邻苯二甲酸酐(2);2分别与不同取代伯胺胺解,得到N-取代邻苯二甲酰亚胺-4-羧酸衍生物(3a~3s); 后者再与氨发生酰胺缩合反应得到N-取代邻苯二甲酸亚胺-4-甲酰胺(4a~4s),其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。采用MTT法研究了4对胰腺癌细胞系Capan-1和乳腺癌细胞系MDA-MB-231的抗癌活性。
1 实验部分
1.1 仪器与试剂
Bruker-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); MicroTMQ-TOF型高分辨质谱仪。
中间体2按文献[19]方法制备; 其余所用溶剂均为分析纯。
1.2 合成
(1)3a~3s的合成(以3a为例)
取21.92 g(10 mmol)、醋酸钾(10 mmol)、 4-(4-吗啉基)苯胺1.96 g(11 mmol)溶解于15 mL乙酸中, 120 ℃回流反应1.5 h(TLC监测)。倒入30 mL冰水中,有固体析出,过滤,滤饼用甲醇回流2 h。趁热过滤,干燥得棕色固体3a0.98 g,收率27%;1H NMR(400 MHz, DMSO-d6)δ: 7.71~7.61(m, 2H), 7.52(dd,J=6.7 Hz, 2.1 Hz, 1H), 7.25~7.19(m, 2H), 7.08~7.01(m, 2H), 3.76(t,J=4.8 Hz, 4H), 3.17(t,J=4.8 Hz, 4H)。
(2)4a~4s的合成(以4a为例)
取3a0.35 g(1 mmol), EDCI 0.34 g(1.8 mmol), HOAt 0.24 g(1.8 mmol), NMM 0.5 g(5 mmol)溶解于20 mL 氯仿中,反应1 h,加入7 M氨的甲醇溶液1 mL,继续搅拌5 h(TLC监测)。反应液加水30 mL,搅拌15 min后分液,水相用二氯甲烷(2×20 mL)萃取,合并有机相,依次用水50 mL,饱和食盐水50 mL洗涤,无水硫酸钠干燥,减压蒸除溶剂得化合物4a粗品,经硅胶柱层析(洗脱剂:DCM/MeOH=15/1,V/V)纯化得橘黄色固体4a0.12g,收率34.3%。
用类似方法合成4b~4s。
2-(4-吗啉基苯基)-1,3-二氧代异吲哚-4-甲酰胺(4a): 橘黄色固体,收率34.3%;1H NMR(400 MHz, DMSO-d6)δ: 8.51(s, 1H), 8.10(d,J=7.7 Hz, 1H), 8.03(d,J=7.2 Hz, 1H), 7.94(t,J=7.6 Hz, 1H), 7.87(s, 1H), 7.31~7.21(m, 2H), 7.10~7.00(m, 2H), 3.76(t,J=4.7 Hz, 4H), 3.18(t,J=4.8 Hz, 4H);13C NMR(101 MHz, DMSO-d6)δ:168.21, 167.08, 166.80, 138.41, 135.15, 134.55, 134.22, 134.09, 133.61, 130.14, 129.48, 125.22, 120.54, 60.54, 53.92; HR-MS(ESI-TOF)m/z: Calcd for C19H17N3O4{[M+H]+}352.1292, found 352.1230。
2-[4-(4-甲基哌嗪-1-基)苯基]-1,3-二氧代异吲哚-4-甲酰胺(4b): 白色固体,收率39.2%;1H NMR(400 MHz, Chloroform-d)δ: 9.98(s, 1H), 8.76(dd,J=8.0 Hz, 1.2 Hz, 1H), 8.13(dd,J=7.3 Hz, 1.2 Hz, 1H), 7.92(t,J=7.7 Hz, 1H), 7.27(d,J=6.9 Hz, 2H), 7.07~7.00(d,J=8.9 Hz, 2H), 6.00(s, 1H), 3.29(t,J=5.1 Hz, 4H), 2.61~2.56(m, 4H), 2.37(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 168.11, 167.08, 166.88, 138.55, 135.21, 134.57, 134.41, 134.21, 133.68, 130.24, 129.51, 125.42, 120.77, 57.54, 53.92, 44.32; HR-MS(ESI-TOF)m/z: Calcd for C20H20N4O3{[M+H]+}365.1608, found 365.1610。
2-[4-(三氟甲氧基)苯基] -1,3-二氧代异吲哚-4-甲酰胺(4c): 亮黄色固体,收率47.3%;1H NMR(400 MHz, DMSO-d6)δ:8.91(s, 1H), 8.21(d,J=7.7 Hz, 1H), 8.01(d,J=7.3 Hz, 1H), 7.76(t,J=7.6 Hz, 1H), 7.55(s, 1H), 7.49(dd,J=8.9 Hz, 5.1 Hz, 2H), 7.39(dd,J=8.9 Hz, 2H);13C NMR(101 MHz, DMSO-d6)δ: 167.48, 166.79, 166.15, 160.83, 146.27, 135.21, 134.39, 132.29, 130.11, 129.98, 129.69, 128.28, 128.11, 125.65, 116.82, 116.39; HR-MS(ESI-TOF)m/z: Calcd for C16H9N2O4F3{[M+Na]+}373.0412, found 373.0416。
2-[4-(吡咯烷-1-基甲基)苯基]-1,3-二氧代异吲哚-4-甲酰胺(4d): 黄色固体,收率31.5%;1H NMR(400 MHz, DMSO-d6)δ: 10.89(s, 1H), 8.08(d,J=7.3 Hz, 1H), 7.97(t,J=6.9 Hz, 1H), 7.92(d,J=7.5 Hz, 1H), 7.68(d,J=8.1 Hz, 2H), 7.35(d,J=8.2 Hz, 2H), 3.70(s, 2H), 2.61~2.57(m, 4H), 1.75(q,J=3.8 Hz, 3.3 Hz, 4H);13C NMR(101 MHz, DMSO-d6)δ: 169.64, 169.00, 163.26, 138.26, 134.94, 134.55, 134.11, 134.07, 133.45, 129.74, 129.48, 125.05, 119.93, 59.24, 53.79, 23.49; HR-MS(ESI-TOF)m/z: Calcd for C20H19N3O3{[M+H]+}350.1499, found 350.1508。
2-[4-(恶唑-2-基)苯基]-1,3-二氧代异吲哚-4-甲酰胺(4e): 黄色固体,收率31.1%;1H NMR(400 MHz, DMSO-d6)δ: 8.50(s, 1H), 8.42(d,J=3.9 Hz, 1H), 8.11(dd,J=7.7 Hz, 1.1 Hz, 1H), 8.07(dd,J=7.5 Hz, 1.1 Hz, 1H), 7.97(t,J=7.6 Hz, 1H), 7.90(d,J=8.6 Hz, 2H), 7.78(s, 1H), 7.58(d,J=8.6 Hz, 2H);13C NMR(101 MHz, DMSO-d6)δ: 167.11, 166.58, 166.20, 152.67, 150.37, 135.17, 135.13, 134.55, 132.38, 132.14, 128.46, 128.14, 127.58, 125.30, 125.03, 123.27; HR-MS(ESI-TOF)m/z: Calcd for C18H11N3O4{[M+Na]+}356.0642, found 356.0648。
2-(4-氟苯基)-1,3-二氧代异吲哚-4-甲酰胺(4f): 白色固体,收率45.2%;1H NMR(400 MHz, DMSO-d6)δ: 8.45(s, 1H), 8.11(d,J=7.7 Hz, 1H), 8.06(d,J=7.3 Hz, 1H), 7.96(t,J=7.6 Hz, 1H), 7.89(s, 1H), 7.51(dd,J=8.7 Hz, 5.1 Hz, 2H), 7.39(t,J=8.7 Hz, 2H);13C NMR(101 MHz, DMSO-d6)δ: 167.31, 166.69, 166.11, 163.18, 160.74, 135.13, 134.44, 132.42, 130.23, 130.14, 128.39, 128.17, 125.31, 116.46, 116.23; HR-MS(ESI-TOF)m/z: Calcd for C15H9N2O3F{[M+Na]+}307.0495, found 307.054 7。
2-(4-氟-3-硝基苯)-1,3-二氧代异吲哚-4-甲酰胺(4g): 白色固体,收率25.9%;1H NMR(400 MHz, DMSO-d6)δ: 11.62(s, 1H), 11.20(s, 1H), 8.71~8.58(m, 1H), 8.06(d,J=7.4 Hz, 1H), 7.98(dt,J=10.9 Hz, 5.5 Hz, 3H), 7.64(t,J=10.1 Hz, 1H);13C NMR(101 MHz, DMSO-d6)δ: 169.11, 168.81, 164.18, 152.56, 149.98, 136.90, 135.88, 135.11, 134.24, 133.41, 129.55, 127.43, 125.34, 119.50, 116.48; HR-MS(ESI-TOF)m/z: Calcd for C18H8O5F3{[M+K]+}368.0085, found 368.0117。
2-[4-甲氧基-3-(三氟甲基)苯基]-1,3-二氧代异吲哚-4-甲酰胺(4h): 黄色固体,收率32.9%;1H NMR(400 MHz, DMSO-d6)δ: 8.45(s, 1H), 8.12(d,J=7.7 Hz, 1H), 8.06(d,J=7.3 Hz, 1H), 7.96(t,J=7.6 Hz, 1H), 7.90(s, 1H), 7.74(d,J=15.4 Hz, 2H), 7.45(d,J=8.8 Hz, 1H), 3.97(s, 3H);13C NMR(101 MHz, DMSO-d6)δ: 167.40, 166.73, 166.07, 157.19, 135.15, 135.12, 134.38, 133.94, 132.47, 128.20, 126.63, 126.58, 125.32, 125.08, 124.33, 114.01, 57.0; HR-MS(ESI-TOF)m/z: Calcd for C17H11N2O4F3{[M+Na]+}387.0569, found 387.0568。
2-[4-(叔丁基)苯基]-1,3-二氧代异吲哚-4-甲酰胺(4i): 白色固体,收率42.1%;1H NMR(400 MHz, DMSO-d6)δ: 8.47(s, 1H), 8.13~8.07(m, 1H), 8.05(dd,J=7.5 Hz, 1.2 Hz, 1H), 7.95(t,J=7.6 Hz, 1H), 7.88(s, 1H), 7.61~7.52(m, 2H), 7.40~7.33(m, 2H), 1.34(s, 9H);13C NMR(101 MHz, DMSO-d6)δ: 167.45, 166.85, 166.17, 151.29, 135.08, 135.06, 134.42, 132.42, 129.51, 128.18, 127.47, 126.19, 125.24, 34.97, 31.56; HR-MS(ESI-TOF)m/z: Calcd for C19H18N2O3{[M+Na]+}345. 1215, found 345.1211。
2-(3,5-二甲氧基苯基)-1,3-二氧代异吲哚-4-甲酰胺(4j): 白色固体,收率40.4%;1H NMR(400 MHz, DMSO-d6)δ: 8.45(s, 1H), 8.10(d,J=7.7 Hz, 1H), 8.05(d,J=7.3 Hz, 1H), 7.95(t,J=7.6 Hz, 1H), 7.88(s, 1H), 6.67~6.57(m, 3H), 3.77(s, 6H);13C NMR(101 MHz, DMSO-d6)δ: 167.15, 166.53, 166.14, 160.87, 135.09, 134.45, 133.75, 132.39, 128.10, 125.26, 106.56, 100.66, 55.96; HR-MS(ESI-TOF)m/z: Calcd for C17H14N2O5{[M+Na]+}349.0800, found 349.0800。
2-(1-乙酰基哌啶-4-基)-1,3-二氧代异吲哚-4-甲酰胺(4k): 白色固体,收率43.4%;1H NMR(400 MHz, DMSO-d6)δ: 8.47(s, 1H), 8.03(dd,J=7.7 Hz, 1.2 Hz, 1H), 7.94(dd,J=7.5 Hz, 1.3 Hz, 1H), 7.90~7.82(m, 2H), 4.59~4.45(m, 1H), 4.28(tt,J=12.2 Hz, 4.1 Hz, 1H), 4.00~3.86(m, 1H), 3.13(dd,J=13.7 Hz, 2.6 Hz, 1H), 2.60(td,J=13.0 Hz, 2.7 Hz, 1H), 2.21(qd,J=12.5 Hz, 4.3 Hz, 1H), 2.04(m, 4H), 1.81~1.66(m, 2H);13C NMR(101 MHz, DMSO-d6)δ: 168.52, 168.01, 167.42, 166.14, 134.84, 134.79, 134.09, 132.28, 127.99, 124.83, 48.89, 45.72, 40.87, 29.50, 28.75, 21.73; HR-MS(ESI-TOF)m/z: Calcd for C16H17N4O4{[M+Na]+}338.1192, found 338.1117。
2-(1-苄基哌啶-4-基)-1,3-二氧代异吲哚-4-甲酰胺(4l): 白色固体,收率40.4%;1H NMR(400 MHz, DMSO-d6)δ: 8.49(s, 1H), 8.04(d,J=7.6 Hz, 1H), 7.94(d,J=7.3 Hz, 1H), 7.90~7.83(m, 2H), 7.44~7.18(m, 5H), 4.02(t,J=12.1 Hz, 1H), 3.53(s, 2H), 2.94(d,J=11.3 Hz, 2H), 2.34(tt,J=12.7 Hz, 7.3 Hz, 2H), 2.06(t,J=11.8 Hz, 2H), 1.72~1.54(m, 2H);13C NMR(101 MHz, DMSO-d6)δ: 168.09, 167.49, 166.14, 138.94, 134.82, 134.75, 134.05, 132.29, 129.21, 128.65, 127.97, 127.37, 124.79, 62.32, 53.09, 49.42, 28.85; HR-MS(ESI-TOF)m/z: Calcd for C21H21N3O3{[M+H]+}364.1656, found 364.1661。
2-[1-(4,4-二氟环己基)哌啶-4-基]-1,3-二氧代异吲哚-4-甲酰胺(4m): 白色固体,收率46.3%;1H NMR(400 MHz, DMSO-d6)δ: 8.49(s, 1H), 8.03(dd,J=7.7 Hz, 1.3 Hz, 1H), 7.93(dd,J=7.4 Hz, 1.3 Hz, 1H), 7.90~7.81(m, 2H), 3.97(ddd,J=15.8 Hz, 9.6 Hz, 4.1 Hz, 1H), 2.94(d,J=9.0 Hz, 2H), 2.47~2.55(m, 1H), 2.38~2.17(m, 4H), 2.04(q,J=10.9 Hz, 9.5 Hz, 2H), 1.91~1.72(m, 4H), 1.71~1.61(m, 2H), 1.61~1.46(m, 2H);13C NMR (101 MHz, DMSO-d6)δ: 168.10, 167.50, 166.14, 134.82, 134.75, 134.04, 132.31, 127.98, 124.79, 60.21, 49.73, 49.02, 32.71, 32.47, 32.24, 29.34, 24.63, 24.54; HR-MS(ESI-TOF)m/z: Calcd for C20H23N3O3F2{[M+H]+}392.1780, found 392.1785。
2-(1-苯基哌啶-4-基)-1,3-二氧代异吲哚-4-甲酰胺(4n): 白色固体,收率42.1%;1H NMR(400 MHz, DMSO-d6)δ: 8.48(s, 1H), 8.04(d,J=7.5 Hz, 1H), 7.95(d,J=6.9 Hz, 1H), 7.90~7.86(m, 1H), 7.85(s, 1H), 7.27~7.14(m, 2H), 6.98(d,J=8.2 Hz, 2H), 6.77(t,J=7.3 Hz, 1H), 4.21(tt,J=12.1 Hz, 3.8 Hz, 1H), 3.84(d,J=12.5 Hz, 2H), 2.84~2.73(m, 2H), 2.41(qd,J=12.7 Hz, 4.0 Hz, 2H), 1.82~1.69(m, 2H);13C NMR(101 MHz, DMSO-d6)δ: 168.22, 167.55, 166.21, 139.23, 134.91, 134.81, 134.15, 132.40, 129.61, 128.77, 130.01, 127.66, 124.97, 53.16, 49.62, 28.91; HR-MS(ESI-TOF)m/z: Calcd for C20H19N3O3{[M+H]+}349.1499, found 350.1571。
2-[(1-甲基磺酰基)哌啶-4-基]-1,3-二氧代异吲哚-4-甲酰胺(4o): 白色固体,收率32.7%;1H NMR(400 MHz, DMSO-d6)δ: 8.48(s, 1H), 8.05(d,J=7.6 Hz, 1H), 7.95(d,J=7.3 Hz, 1H), 7.92~7.83(m, 2H), 4.18(tt,J=12.4 Hz, 4.0 Hz, 1H), 3.76~3.63(m, 2H), 2.95~2.82(m, 5H), 2.33(qd,J=12.8 Hz, 4.4 Hz, 2H), 1.83(dd,J=13.3 Hz, 3.9 Hz, 2H);13C NMR(101 MHz, DMSO-d6)δ: 167.98, 167.40, 166.12, 134.86, 134.80, 134.07, 132.29, 127.99, 124.86, 48.22, 45.67, 35.15, 28.40; HR-MS(ESI-TOF)m/z: Calcd for C15H17N3O5S{[M+Na]+}374.0787, found 374.0860。
2-{(1R)-1-[(1R,3R,5S)-金刚烷-1-基]基}-1,3-二氧代异吲哚-4-甲酰胺(4p): 白色固体,收率35.6%;1H NMR(400 MHz, DMSO-d6)δ: 8.52(d,J=19.7 Hz, 1H), 8.03(dd,J=7.1 Hz, 4.8 Hz, 1H), 7.89(ddt,J=19.8 Hz, 17.0 Hz, 10.0 Hz, 3H), 3.92(qd,J=7.3 Hz, 3.9 Hz, 1H), 1.93(s, 4H), 1.60(m, 12H), 1.42(d,J=7.3 Hz, 3H);13C NMR(101 MHz, DMSO-d6)δ: 169.07, 168.46, 166.34, 134.90, 134.68, 134.10, 132.47, 128.19, 124.84, 56.76, 39.36, 37.72, 36.78, 28.27, 11.79; HR-MS(ESI-TOF)m/z: Calcd for C21H24N2O3{[M+Na]+}375.1685, found 375.1685。
2-[(1R,3R,5S)-金刚烷-1-基]-1,3-二氧代异吲哚-4-甲酰胺(4q): 白色固体,收率37.6%;1H NMR(400 MHz, DMSO-d6)δ: 11.58(s, 1H), 8.87(s, 1H), 8.06(m, 1H), 7.89(dd,J=7.5 Hz, 1H), 7.85(d,J=7.4 Hz, 1H), 2.12~2.02(m, 9H), 1.68(d,J=2.8 Hz, 6H);13C NMR(101 MHz, DMSO-d6)δ: 170.42, 168.98, 162.95, 135.01, 134.77, 134.66, 133.52, 129.23, 124.78, 52.17, 41.18, 36.53, 29.30; HR-MS(ESI-TOF)m/z: Calcd for C19H20N2O3{[M+Na]+}347.1372, found 347.1376。
2-(环己基甲基)-1,3-二氧代异吲哚-4-甲酰胺(4r): 白色固体,收率47.2%;1H NMR(400 MHz, Chloroform-d)δ: 10.01(s, 1H), 8.69(dd,J=8.1 Hz, 1.2 Hz, 1H), 8.03(dd,J=7.3 Hz, 1.2 Hz, 1H), 7.86(t,J=7.7 Hz, 1H), 6.07(s, 1H), 3.58(d,J=7.2 Hz, 2H), 1.88~1.60(m, 6H), 1.31~1.13(m, 3H), 1.12~0.96(m, 2H);13C NMR(101 MHz, Chloroform-d)δ: 170.47, 167.28, 164.31, 137.82, 134.31, 132.44, 131.30, 128.34, 126.47, 44.71, 36.91, 30.79, 26.15, 25.61; HR-MS(ESI-TOF)m/z: Calcd for C16H18N2O3{[M+Na]+}309.1287, found 309.1215。
2-[(4-甲基-2-氧-1,2,5,6,7,8-六氢喹啉-3-基)甲基]-二氧代异吲哚-4-甲酰胺(4s): 白色固体,收率27.2%;1H NMR(400 MHz, DMSO-d6)δ: 11.14(s, 1H), 8.62(s, 1H), 8.05(dt,J=7.6 Hz, 1.7 Hz, 1H), 7.92(dd,J=7.5 Hz, 1.2 Hz, 1H), 7.89~7.84(m, 1H), 7.84(s, 1H), 3.57(s, 2H), 2.42(d,J=5.4 Hz, 2H), 2.35(q,J=6.1 Hz, 2H), 2.13(s, 3H), 1.64(dd,J=8.1 Hz, 4.7 Hz, 4H);13C NMR(101 MHz, DMSO-d6)δ: 168.03, 166.98, 165.95, 161.40, 150.55, 141.28, 134.88, 134.71, 133.81, 132.55, 128.00, 124.91, 120.05, 112.32, 35.35, 26.96, 24.33, 22.75, 21.45, 15.86; HR-MS(ESI-TOF)m/z: Calcd for C20H19N3O4{[M+Na]+}388.1273, found 388.1277。
1.3 体外抗癌活性测试
采用MTT法测试了化合物4a~4s对Brca2缺陷型胰腺癌细胞系Capan-1和乳腺癌细胞系MDA-MB-231增殖抑制实验。收集处于对数生长期的细胞,将细胞重悬成浓度为6×103个/mL的细胞悬液,按着每孔100 μL细胞悬液将细胞接种到96孔板中,并置于37 ℃、 5%的CO2细胞孵箱中孵育过夜。24 h后,按60 μM、 20 μM、 6.66 μM、 2.22 μM、 0.74 μM和0.24 μM 6个浓度将化合物用细胞培养基梯度3倍稀释,稀释后的药物按每孔100μL药液加入到96孔板中,每个浓度设置3个复孔。并用含有0.1%的DMSO培养基处理细胞作为空白对照。将细胞培养板在细胞孵箱中继续孵育6 d, 3 d换一次药。每孔加入20 μL MTT溶液(5 mg/mL)后,在孵箱中继续培养2~4 h后终止培养,小心吸弃上清液; 每孔加入150 μL二甲亚砜溶剂,在摇床上轻摇15~20 min,使蓝色结晶物充分溶解; 设定波长为570 nm,利用酶标仪测定每孔的光吸收值,记录结果。实验重复3次以上,计算平均值和标准差。
2 结果与讨论
2.1 合成
(1)2的合成
根据文献[19],这里选择无溶剂反应。所购原料为颗粒状,也有部分结成块,反应前需用研钵研均匀。反应从毫克级到克级均很稳定,副产物仅为水,无需进一步后处理,收率基本为100%。
(2)2的结构
从1,2,3-苯三甲酸到中间体2仅脱了一分子水,1H NMR发现原料与产物谱图类似,同时重水交换后发现羧酸并不显活性氢,无法明确判断二者区别,这一结论与文献[19]一致。因此我们进一步表征了13C NMR,发现1,2,3-苯三甲酸的羰基碳仅在δ169.74处出峰,而反应后羰基碳的峰有δ169.92和169.07两处。
(3)3的合成[20-22]
参考文献方法,反应仅有一个副产物,即N,2-双(4-吗啉基苯基)-1,3-二氧代异吲哚-4-甲酰胺(其他化合物类似),甲醇回流搅洗即可将其与目标产物分离,整体收率为30%~50%。
(4)4的合成
经典的伯酰胺合成方法有很多,我们首先选择了比较温和的反应条件:CDI/浓氨水。结果发现N-取代酰亚胺会在浓碱的水溶液中开环,破坏反应物原有的结构,因此涉及到浓氨水的反应我们均不考虑。后期又尝试了HATU/DIEA/NH4Cl、 EDCI/HOAt/NMM/氨甲醇等体系,发现以EDCI和HOAt为缩合剂时效果较好,主副产物更易分离,收率为20%~50%。
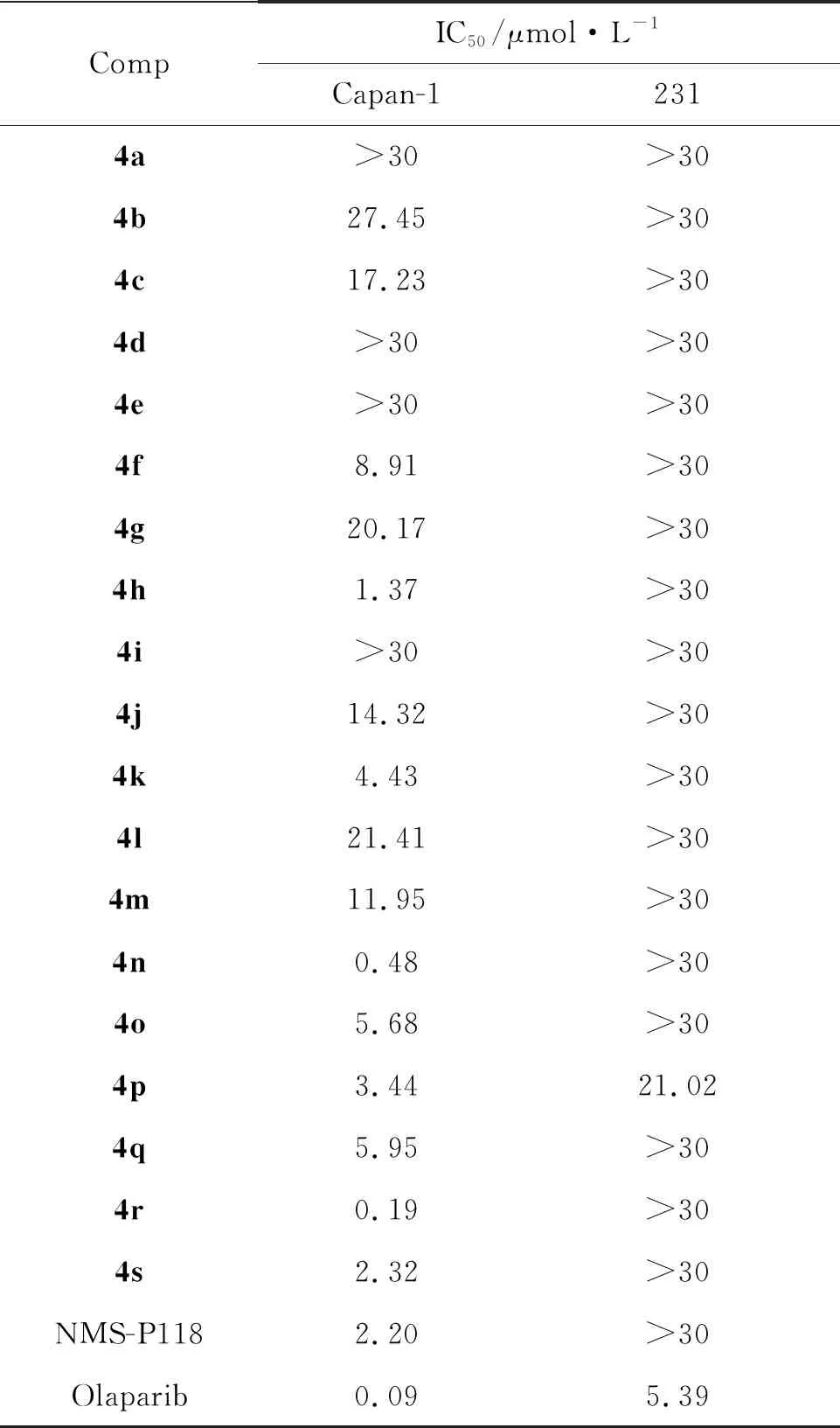
表1 化合物的体外抗肿瘤活性
2.2 体外抗癌活性
以MTT法测定化合物4a~4s体外对Brca2缺陷型细胞系Capan-1和乳腺癌细胞系231的增殖抑制实验,其IC50结果见表1。
由表1可知,当酰亚胺氮上的取代基为苯环时,4f、4h和4j对Capan-1细胞有较好的增殖抑制活性,最高达到1.37 μM(化合物4h); 当酰亚胺氮上的取代基为哌啶基时,4k、4m、4n和4o对Capan-1细胞有较好的增殖抑制活性,最高达到0.48 μM(4n); 哌啶基取代整体上活性比苯基取代好。
考虑到金刚烷胺有一定的体外抗癌活性的活性[23],用金刚烷乙胺和金刚烷胺片段与3-甲酰胺邻苯二甲酰亚胺母核结合得到化合物4p和4q,发现其对Capan-1细胞有着较好的活性(3.44 μM和5.95 μM),但此活性是因为母核还是金刚烷胺片段我们无法判断,因此我们将金刚烷乙胺结构简化,在母核上接上了环己基乙胺的结构(4r),发现对Capan-1活性有着15倍提升(0.19 μM),推测可能是化合物的空间位阻减小所致。
该系列化合物对Brca2缺失型胰腺癌细胞系Capan-1有良好的体外增殖抑制活性,最好活性(0.19 μM),比模板化合物NMS-P118活性好,与阳性化合物olaparib(0.09 μM)相当。但对无Brca1/2突变型的乳腺癌细胞系231基本无增殖抑制活性,从侧面说明了该结构可能与NAD+竞争性抑制聚腺苷二磷酸核糖聚合酶。
本文合成了19个全新的以邻苯二甲酰亚胺为母核腺苷二磷酸核糖聚合酶-1(PARP-1)抑制剂,主要分为N-苯基取代、N-4-哌啶基取代和N-饱和烷烃取代3类。最终得到了化合物4r, Capan-1半数抑制浓度为0.19 μM,活性比NMS-P118好,与Olaparib相当。该系列化合物同时表现了对Brca2突变型细胞系的抑制作用也表明其作为PARP-1抑制剂具有进一步的开发的价值。

