氟伐他汀钠对皮肤鳞状细胞癌细胞增殖、凋亡及PI3K/AKT/mTOR通路的影响
(中国医科大学附属第一医院皮肤科,沈阳 110001)
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是世界上第二常见的皮肤癌,发病率不断升高[1]。近年来,我国CSCC的发病率也逐年升高,发病年龄呈现年轻化趋势。CSCC严重影响患者的生活质量,给患者带来了沉重的身心负担[2]。他汀类是治疗中老年人群高脂血症的常用药物。近年来,随着他汀类药物的广泛应用和对其作用机制的深入研究,其抗肿瘤的作用受到广泛关注[3-4]。在肺癌[5]、肝癌[6]、结直肠癌[7]、乳腺癌[8]等方面相关研究取得了一定进展,但他汀类药物在皮肤肿瘤方面的研究国内鲜有报道。本研究以培养的人CSCC SCL-1细胞为研究对象,观察氟伐他汀钠对SCL-1细胞的增殖、凋亡的影响,并探讨其可能的分子机制。
1 材料与方法
1.1 主要材料和试剂
人CSCC细胞株 SCL-1由德国柏林自由大学本杰明·富兰克林医学中心惠赠。主要试剂包括氟伐他汀钠(上海源叶生物科技有限公司)、DMEM细胞培养液(美国Hyclone公司)、胎牛血清(美国Bioscience公司)、噻唑蓝(北京索莱宝公司)、二甲基亚砜(美国Sigma公司)、Annexin V/PI凋亡试剂盒(上海优宁维有限公司)、Trizol试剂(美国Invitrogen公司)、反转录试剂盒(日本Toyobo公司)、实时qPCR试剂盒(日本Toyobo公司)。
1.2 方法
1.2.1 氟伐他汀钠储存液及工作液配制:用DMSO将氟伐他汀钠充分溶解,配制成800 μmol/L浓度的母液(DMSO 终浓度≤0.01%),22 μm滤器过滤,4 ℃避光保存;用含10%胎牛血清的DMEM培养液稀释成含氟伐他汀钠10、20、50、100 μmol/L的工作液。
1.2.2 细胞培养:将 SCL-1细胞培养于含10% 胎牛血清的DMEM培养液中,置于37 ℃、5% CO2饱和湿度的培养箱中。观察培养基清亮,细胞呈贴壁生长,形态良好,细胞铺满瓶壁 70%~80%可以传代。
1.2.3 MTT检测细胞增殖抑制率:收集处于对数生长期的SCL-1细胞,以5×104/mL的细胞密度接种于96孔板。每孔加入100 μL细胞悬液,继续培养24 h;吸去96孔板中的培养液,实验组分别加入10、20、50、100 μmol/L工作液;设空白组(只加入培养液无细胞)和对照组(加入与实验组等量培养基),每组各设 6个复孔。置于5%CO2、37 ℃培养箱中继续培养24、48、72 h。在预定时间前4 h以MTT法在酶联免疫检测仪上测定各孔的吸光度(optical density,OD),实验重复3次。细胞增殖抑制率=(1-OD实验组/ OD对照组)×100%。
1.2.4 流式细胞术Annexin V-FITC/PI双标记检测细胞凋亡:收集处于对数生长期的SCL-1细胞,分别加入10、20、50、100 μmol/L的氟伐他汀钠培养24 h、48 h后离心收集细胞。用400 μL 1×结合缓冲液使细胞悬浮,调整细胞浓度约为1×106/mL,1 000 r/min离心5 min,沉淀细胞,孵育缓冲液洗1次,加入5 μL AnnexinV-FITC,混匀后于2~8 ℃避光孵育15 min。加入10 μLPI混匀后2~8 ℃ 避光孵育5 min,在1 h内流式细胞仪检测细胞凋亡率。在双变量流式细胞仪的散点图上,以左下象限显示活细胞,为(FITC-/PI-);右上象限为非活细胞,即晚期凋亡细胞和死细胞,为(FITC+/PI+);右下象限表示早期凋亡细胞,显现(FITC+/PI-)。实验重复3次,统计早期凋亡率。
1.2.5 实时qPCR法检测磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinases,PI3K)、蛋白激酶B(protein kinase B,PKB,又称AKT)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)mRNA相对表达量:将细胞生长状态良好的SCL-1细胞接种于6孔板内并培养过夜,分别加入10、20、50、100 μmol/L的氟伐他汀钠培养24 h,按照Trizol试剂说明书的方法行总RNA提取,采用分光光度计检测RNA质量。使用反转录试剂盒将RNA转录为cDNA,而后使用实时qPCR试剂盒进行扩增,扩增基因包括PI3K、AKT、mTOR,内参基因为GAPDH,根据Genebank公布的序列,采用Oligo6设计所需引物,引物序列见表1。以空白对照组的表达量定义为1,采用2-△△Ct法进行相对定量,实验重复3次。
1.3 统计学分析
2 结果
2.1 氟伐他汀钠对SCL-1细胞增殖的影响
结果显示,用10、20、50、100 μmol/L氟伐他汀钠干预SCL-1细胞后,相同时间随着氟伐他汀钠浓度增加SCL-1细胞抑制率上升(P<0.01);同浓度氟伐他汀钠对SCL-1细胞分别干预24、48、72 h后,细胞增殖的抑制率随干预时间增加而上升(P<0.01),见表2。氟伐他汀钠在48 h对SCL-1的IC50为10.70 μmol/L。
2.2 氟伐他汀钠对SCL-1细胞早期凋亡的影响
结果显示,不同浓度处理SCL-1细胞早期凋亡率随氟伐他汀钠的浓度增加而上升,呈现浓度依赖性(P<0.01);相同浓度下,48 h早期凋亡率高于24 h,差异有统计学意义(P<0.01)。见表3,图1、2。

表2 不同浓度氟伐他汀钠作用下SCL-1细胞抑制率(%)Tab.2 Inhibition rate of SCL-1 cells treated with different concentrations of fluvastatin sodium(%)
2.3 不同浓度氟伐他汀钠对PI3K、Akt、mTOR mRNA表达的影响
结果显示,不同浓度的氟伐他汀钠培养SCL-1细胞24 h后PI3K、AKT、mTORmRNA相对表达量随着药物浓度的升高而降低(P<0.01)。见表4。

表3 不同浓度氟伐他汀钠作用下SCL-1细胞早期凋亡率(%)Tab.3 Early apoptotic rate of SCL-1 cells treated with different concentrations of fluvastatin sodium(%)
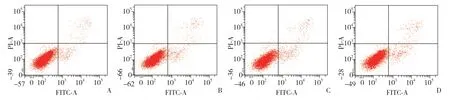
图1 各组24 h 时Annexin V-FITC/PI 双染流式细胞分析散点图Fig.1 Annexin V-FITC/PI double staining flow cytometry scatter plots of SCL-1 cells after 24 h treatment with different concentrations of fluvastatin sodium

图2 各组48 h时 Annexin V-FITC/PI双染流式细胞分析散点图Fig.2 Annexin V-FITC/PI double staining flow cytometry scatter plots of SCL-1 cells after 48 h treatment with different concentrations of fluvastatin sodium
3 讨论
他汀类药物是3-羟基-3-甲基戊二酰辅酶A(3-hydroxy3-methylglutaryl coenzyme A,HMG-CoA)还原酶具有高度专一性的竞争性强力抑制剂。自20世纪80年代问世以来,普遍应用于临床高脂血症的治疗[9-10]。HMG-CoA参与甲羟戊酸代谢途径,他汀类药物作为该酶的抑制剂抑制了甲羟戊酸以及下游产物的生成,从而抑制肿瘤细胞的生长、侵袭、转移、细胞增殖和分化,调控细胞周期[11-12]。他汀类药物能发挥多效细胞作用,其潜在机制包括:(1)洛伐他汀在SCC9、SCC25细胞系中可以损害线粒体功能并降低细胞ADP/ATP比率,触发了LKB1/AMPK通路活化,从而影响肿瘤蛋白的翻译[13];(2)Hippo通路是一条经典的致癌通路,TAZ是该通路的下游效应物,有研究[14]发现他汀类对TAZ高表达的肝癌细胞具有抗增殖和诱导凋亡作用;(3)辛伐他汀抑制了DNA与NF-κB转录因子结合,抑制抗凋亡蛋白BCLXL表达,增加PTEN转录,从而发挥诱导细胞凋亡的作用[15]。

表4 24 h时不同浓度氟伐他汀钠作用下SCL-1细胞PI3K、AKT、mTOR mRNA相对表达量(%)Tab.4 Relative mRNA expression levels of PI3K,AKT,and mTOR after 24 h treatment of SCL-1 cells with different concentrations of fluvastatin sodium
CSCC是一种常见的皮肤肿瘤,治疗方式多样,其中以手术切除为佳。然而由于手术治疗易引起组织缺损且容易留下瘢痕,又因局部外用药物及放射治疗方法存在局限性,较易复发,临床应用受限[16]。因此探寻新的治疗药物来抑制CSCC的发生发展具有很高的临床价值。他汀类药物在多种肿瘤中表现了显著的生物学效应,本研究采用了临床常用的氟伐他汀钠处理SCL-1细胞,实验结果表明氟伐他汀钠以浓度依赖性和时间依赖性的方式抑制SCL-1细胞增殖。流式细胞术Annexin V-FITC/PI双标法结果显示氟伐他汀钠的浓度越高、作用时间越长,SCL-1细胞凋亡率越高,由此可推测氟伐他汀钠可以抑制SCL-1细胞的增殖,促进其凋亡。
PI3K介导的Akt/mTOR通路是一条经典的促存活和抗凋亡的信号转导通路,在上皮源性恶性肿瘤的发生、发展、转归中具有重要作用[17]。本研究在明确氟伐他汀钠能够诱导SCL-1凋亡后,进一步对可能发挥作用的分子机制进行分析,结果显示,氟伐他汀钠可以降低PI3K、AKT、mTORmRNA相对表达量,且随着药物浓度的增加抑制作用明显增强。这表明氟伐他汀钠可以抑制SCL-1细胞内PI3K/Akt/mTOR通路。
综上所述,氟伐他汀钠具有抑制人CSCC增殖并诱导其凋亡的作用,推测其机制之一可能与抑制PI3K/Akt/mTOR通路有关,本研究为CSCC的药物治疗开拓了新的方向。

