长链非编码RNA RUNX1-IT1对口腔鳞状细胞癌增殖、迁移的影响及其作用机制
王雪,李琳,张红,张雪,王振华
(中国医科大学 1.生命科学学院生理学教研室,沈阳 110122;2.附属口腔医院干诊科,沈阳 110002)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是具有高转移率和高复发率的恶性肿瘤,约占口腔癌的90%[1]。目前手术仍为主要治疗方式,但患者术后易发生转移和复发,5年生存率仅为50%[2]。因此,寻找OSCC的发病和转移机制十分重要。长链非编码RNA(long non-coding RNA,lncRNA)是一种没有编码蛋白能力的RNA。越来越多的证据表明lncRNA在OSCC的进展中发挥调控作用[3-5]。lncRNA RUNX1-IT1位于染色体21q22.12区域,长约1 502个核苷酸,研究[6-7]表明它在结直肠癌和胃癌中发挥调控作用,然而lncRNA RUNX1-IT1在OSCC中的功能和机制尚未明确。本研究通过体外实验探讨lncRNA RUNX1-IT1对OSCC增殖、迁移的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 标本来源:收集2018年5月至2019年2月期间中国医科大学附属口腔医院颌面外科手术切除的47例OSCC癌组织和癌旁正常组织,OSCC的诊断依据组织病理学确定。标本收集前经中国医科大学附属口腔医院伦理委员会批准,并经患者知情同意。
1.1.2 细胞培养:OSCC细胞系CAL27、SCC25均购于美国ATCC细胞库。HaCaT购于中国典型培养物保藏中心细胞库。CAL27、HaCaT以DMEM高糖培养基(含有10%的胎牛血清)培养,SCC25以DMEM/F12培养基培养,培养液中加入10%胎牛血清,400 ng/mL氢化可的松,0.5 mmol/mL丙酮酸钠。细胞于37 ℃,5%CO2培养箱中培养。
1.2 方法
1.2.1 实时qPCR:用Trizol法提取组织和细胞RNA。采用PrimeScriptTMRT reagent Kit试剂盒进行反转录。利用SYBRPremix Ex Taq Ⅱ在LightCycler480Ⅱ实时 PCR仪上进行实时定量PCR反应。引物序列:lncRNA RUNX1-IT1,上游引物5’-GGACACGCAGAGGAAGT CAA-3’,下游引物5’-GTTCTTGAGGTTGGCGGAGA-3’;GAPDH,上游引物5’-CGGATTTGGTCGTATTGGG-3’,下游引物5’-CTGGAAGATGGTGATGGGATT-3’。以2-ΔΔCt法计算结果。
1.2.2 载体构建和细胞转染:过表达慢病毒载体购于上海吉玛基因公司,当CAL27细胞密度达到70%~80%时进行转染。取CAL27分为LV5组(对照组)和LV-RUNX1-IT1组(实验组),用1 μg/mL嘌呤霉素构建稳定细胞系。SiRNA 购于广州锐博公司,采用Lipofectamine 2000进行转染。转染空白载体细胞为si-NC组,转染lncRNA RUNX1-IT1沉默载体细胞为si-RUNX1-IT1组。
1.2.3 细胞增殖:细胞增殖能力用CCK8检测。常规胰酶消化细胞后在96孔板内接种100 μL对照组和实验组细胞悬液,含2 000个细胞。在37 ℃孵箱内孵育24、48、72、96 h。每孔加入10 μL CCK8试剂孵育1 h,在450 nm波长处测定吸光度。
1.2.4 细胞周期:细胞消化后用PBS洗涤细胞(2 000 r/min,5 min)并收集,加入70%冷乙醇固定4 ℃过夜。根据细胞周期试剂盒说明书加入500 μL PI/RNaseA染色,室温避光30~60 min后流式细胞仪采集数据并分析。
1.2.5 Transwell实验:向Transwell小室上方加入含1×105个细胞的200 μL无血清培养基,下室加入600 μL含10%胎牛血清的培养液,37 ℃孵育48 h。弃掉培养基,将上室置于甲醇固定1 min,苏木素染色3 min和伊红染色15~30 s。倒置显微镜随机取图并计数。
1.2.6 Western blotting:采用全蛋白试剂盒提取细胞总蛋白,SDS-PAGE凝胶电泳后,常规转膜。加入一抗(E-cadherin、N-cadherin、β-catenin、Vimentin、PCNA、Cyclin D1、MMP2、β-actin)孵育4 ℃过夜,然后加入二抗,孵育1.5 h。利用凝胶成像仪采集图像。
1.3 统计学分析
运用SPSS 20.0统计软件进行数据分析。采用非参数检验方法分析lncRNA RUNX1-IT1表达水平和OSCC患者临床病理资料的相关性。计量资料以表示,2组比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA RUNX1-IT1在OSCC 中的表达
利用实时qPCR检测47例OSCC患者lncRNA RUNX1-IT1的表达,结果显示,38例(81%)OSCC癌组织lncRNA RUNX1-IT1表达(6.03±2.73)显著高于癌旁正常组织(7.04±2.75,P<0.001)。lncRNA RUNX1-IT1在OSCC细胞系CAL27(13.19±0.92)、SCC25(8.55±1.17)表达显著高于正常细胞系HaCaT(1.00±0.00,P<0.01)。lncRNA RUNX1-IT1相对表达水平和淋巴结转移相关(P<0.05),见表1。这些结果说明lncRNA RUNX1-IT1的高表达可能在OSCC转移过程中发挥重要作用。
2.2 lncRNA RUNX1-IT1对CAL27细胞增殖的影响
过表达和沉默lncRNA RUNX1-IT1后实时qPCR检测转染效率。结果显示,与LV5组(1.00±0.00)比较,LV-RUNX1-IT1组(48.44±7.33)中lncRNA RUNX1-IT1表达水平显著增高(P<0.01);与si-NC组(1.00±0.00)比较,si-RUNX1-IT1组(0.24±0.06)lncRNA RUNX1-IT1表达水平显著降低(P<0.01)。
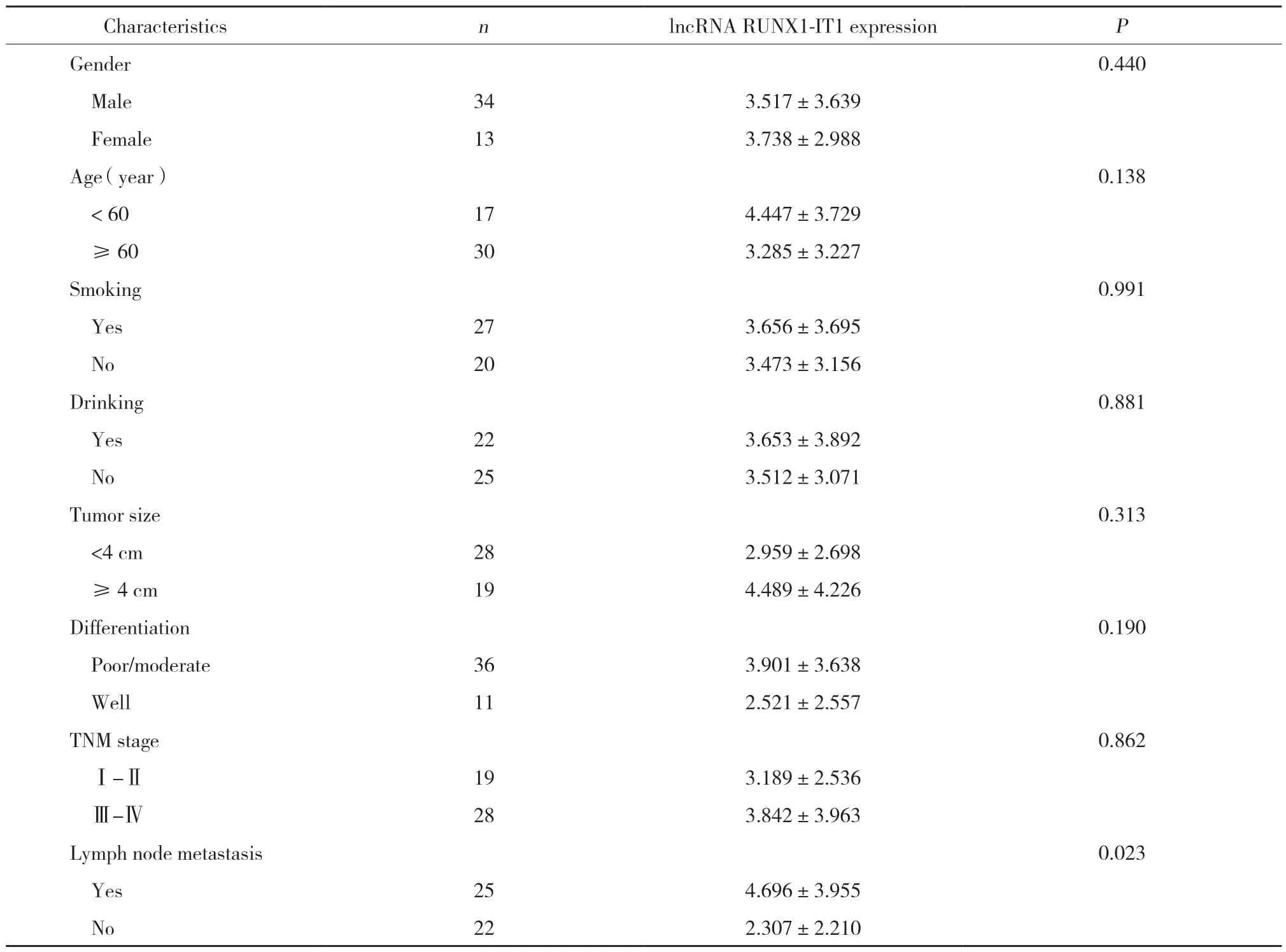
表1 lncRNA RUNX1-IT1表达和OSCC患者临床指标的相关分析Tab.1 Correlation between lncRNA RUNX1-IT1 expression and clinicopathological characteristics in OSCC patients
CCK8实验结果显示,与LV5组比较,LV-RUNX1-IT1组在72、96 h OD值明显增高(P<0.05),细胞增殖活性显著增强(图1A);lncRNA RUNX1-IT1沉默后,si-RUNX1-IT1组在72、96 h OD值明显降低(P<0.05),细胞增殖活性显著减弱(图1B)。
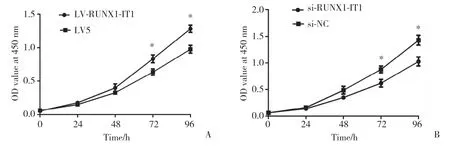
图1 lncRNA RUNX1-IT1对CAL27细胞增殖的影响Fig.1 Effect of CAL27 cell proliferation on lncRNA RUNX1-IT1
流式细胞术检测结果显示,与LV5组比较,LVRUNX1-IT1组G1期细胞显著减少,S期细胞显著增加;而沉默lncRNA RUNX1-IT1后细胞阻滞在G1期,G1期细胞显著增加,S期细胞显著减少,见图2。
2.3 lncRNA RUNX1-IT1对CAL27细胞迁移的影响
Transwell结果显示,LV5组、LV-RUNX1-IT1组、si-NC组、si-RUNX1-IT1组细胞迁移数量分别为110±14、214±10、109±9、54±5。与LV5组比较,LVRUNX1-IT1组CAL27细胞迁移数量增多(P<0.01),提示过表达lncRNA RUNX1-IT1后细胞迁移能力显著增强;与si-NC组比较,si-RUNX1-IT1组CAL27细胞迁移数量显著减少(P<0.01),提示沉默lncRNA RUNX1-IT1后细胞迁移能力显著减弱,见图3。
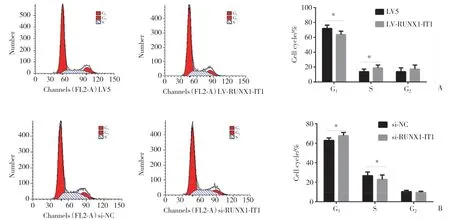
图2 流式细胞术细胞周期分析结果Fig.2 Results of cell cycle analysis by flow cytometry
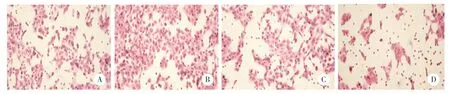
图3 lncRNA RUNX1-IT1对CAL27细胞迁移的影响×200Fig.3 Effect of CAL27 cell migration on lncRNA RUNX1-IT1 ×200
2.4 过表达的lncRNA RUNX1-IT1促进CAL27细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)
Western blotting检测EMT相关标志物结果显示,过表达lncRNA RUNX1-IT1后,与LV5组比较,LV-RUNX1-IT1组上皮标志物E-cadherin显著减少(P<0.01),而间充质标志物N-cadherin、β-catenin、Vimentin(均P<0.05)显著增多,促进了上皮细胞向间质细胞转换;沉默lncRNA RUNX1-IT1后发现结果与之相反,抑制了上皮细胞向间质细胞转化。PCNA、Cyclin D1和MMP2蛋白水平均在lncRNA RUNX1-IT1过表达后显著上调;在lncRNA RUNX1-IT1沉默后显著下调。以上结果表明lncRNA RUNX1-IT1可能通过调控EMT促进CAL27细胞增殖和迁移,见表2、图4。
3 讨论
近年来,研究[8-10]表明,lncRNA的异常表达可能与癌症(胃癌、卵巢癌和乳腺癌等)的预后和转移相关。本研究结果显示lncRNA RUNX1-IT1在OSCC组织和细胞中高表达,lncRNA RUNX1-IT1的表达和淋巴结转移显著相关,这说明lncRNA RUNX1-IT1高表达可能参与OSCC的转移过程。

表2 各组EMT相关蛋白表达比较Tab.2 EMT-related proteins expression levels in all groups

图4 各组EMT相关蛋白表达结果Fig.4 Expression of EMT-related proteins in all groups
已有研究[11]显示,lncRNA生长特异抑制物5(growth arrest-specific 5,GAS5)过表达通过激活PTEN/AKT轴抑制OSCC细胞的增殖和侵袭。lncRNA母系表达基因3(maternally expressed gene 3,MEG3)吸附miR-548d-3p调节JAK-STAT通路抑制OSCC的迁移并促进凋亡[12]。本研究结果发现过表达lncRNA RUNX1-IT1促进CAL27细胞的增殖和迁移,加快细胞从G1期向S期分化;而沉默lncRNA RUNX1-IT1抑制CAL27细胞的增殖和迁移,使细胞阻滞在G1期。
已有研究[13]认为EMT是细胞骨架重组、上皮细胞逐渐向间质细胞转化的过程,其特点在于细胞形态学的变化。在这个过程中,上皮标志物(E-cadherin)减少而间充质标志物(N-cadherin、Vimentin)增加,使细胞具有更强的迁移和运动能力。转录因子Snail可以诱导EMT的发生,通过降解MMP2和介导靶基因Cyclin D1转录,调节膀胱癌细胞增殖、凋亡、侵袭和迁移[14]。lncRNA肝癌高表达转录本(highly upregulated in liver cancer,HULC)在OSCC中高表达,敲除HULC后抑制了EMT过程,从而影响癌细胞的增殖和侵袭[15]。本研究结果显示过表达lncRNA RUNX1-IT1后 E-cadherin显著减少,而N-cadherin、β-catenin、Vimentin显著增多;沉默lncRNA RUNX1-IT1后结果与之相反。PCNA是细胞增殖相关的蛋白。细胞周期从G1期向S期分化时,Cyclin D1的水平发生了改变。MMP2作为MMP家族的一员在细胞发生侵袭和迁移时发挥重要作用。PCNA、Cyclin D1和MMP2的表达水平均在lncRNA RUNX1-IT1过表达后显著上调,在lncRNA RUNX1-IT1沉默后显著下调。以上结果提示lncRNA RUNX1-IT1诱导CAL27细胞EMT的发生。
综上所述,本研究首次发现lncRNA RUNX1-IT1在OSCC组织和CAL27、SCC25细胞中显著高表达,lncRNA RUNX1-IT1高表达可以促进细胞增殖、加快细胞从G1期向S期分化,促进细胞迁移和EMT等恶性生物学行为,这为OSCC的研究提供了新的方向。

