顶空气相色谱法测定眼氨肽制剂中乙醇残留量
覃婷婷,伏圣青,黄哲甦
(天津市药品检验研究院,天津 300070)
眼氨肽制剂包括眼氨肽注射液和眼氨肽滴眼液,二者均以牛或猪的动物眼球为原料,经高浓度的乙醇提取等工艺制得眼氨肽提取液后,进一步灭菌或加抑菌剂经无菌操作制得注射液或滴眼液,该类制剂主要用于治疗角膜炎、视力疲劳及青少年假性近视[1-3],临床上也用于治疗角膜上皮持续性缺损、干眼症等眼科疾病[4-6]。眼氨肽制剂作为多组分提取药物成分复杂,不仅含有多种氨基酸和多肽[7],同时药物中还可能残留大分子蛋白[8]等容易引起过敏反应的物质,笔者前期均进行了深入分析。此外,眼氨肽制剂的生产工艺采用高浓度的乙醇进行提取,提取液中会有乙醇残留,另外部分眼氨肽滴眼液产品中加入的羟苯酯类抑菌剂使用乙醇作为溶剂,也可能使眼氨肽滴眼液终产品中残留乙醇。乙醇残留可导致急性中毒,因此,有必要控制眼氨肽制剂中乙醇的残留量。目前眼氨肽注射液和眼氨肽滴眼液质量标准均收载在《国家药品标准化学药品地方标准上升国家标准》第九册中,均未对乙醇残留量进行控制,存在着较大的风险隐患,且目前尚未见测定眼氨肽制剂中乙醇残留量的相关报道。此次,笔者参考相应文献[9-13],采用顶空气相色谱法并对其参数加以优化,建立眼氨肽滴眼液、注射液中乙醇残留量的测定方法,并对部分市售样品进行监测分析,以期为该类制剂的质量监管提供新的技术支撑,有助于推进眼氨肽制剂整体质量评价标准体系的完善。
1 仪器与试药
7980A气相色谱仪(美国Agilent公司);XS-204万分之一电子分析天平(瑞士Mettler-Toledo公司)。眼氨肽滴眼液(A 公司,批号 160601、180201;B 公司,批号161001、161102、171004);眼氨肽注射液(C 公司,批号57170701、58170703、57190301);无水乙醇(天津康科德科技有限公司,色谱纯,批号181226);正丙醇(天津康科德科技有限公司,色谱纯,批号170425),水为纯化水。
2 方法与结果
2.1 色谱条件 色谱柱为CP-WAX 52 CB FS(50 m×0.32 mm,5 μm)毛细管柱;升温程序:起始温度为 70℃,维持8 min,以40℃/min速率升温至200℃,维持10 min;进样口温度为200℃;检测器为火焰离子化检测器(FID);检测温度为220℃;载气为氮气;流速为1.5 ml/min;分流比为 20∶1;顶空进样量为 1 ml;顶空平衡温度为85℃;顶空平衡时间为20 min。
2.2 溶液的制备
2.2.1 内标溶液 取正丙醇对照品适量,精密称定,置内盛水的量瓶中,并加水稀释制成每1 ml含0.1 mg的溶液作为内标溶液。
2.2.2 对照品溶液 取无水乙醇对照品适量,精密称定,置内盛水的量瓶中,并加水稀释制成每1 ml含1mg的溶液作为对照品贮备液。精密量取1 ml,置内盛水的50 ml量瓶中,精密加入内标溶液5 ml,加水稀释至刻度,摇匀,作为对照品溶液。
2.2.3 供试品溶液 精密量取本品5 ml,置内盛水的50 ml量瓶中,精密加入内标溶液5 ml,加水稀释至刻度,摇匀,作为供试品溶液。
2.2.4 阴性对照溶液 以水作为阴性对照溶液。
2.3 系统适用性试验 分别精密量取阴性对照溶液、对照品溶液和供试品溶液5 ml至20 ml顶空瓶中加盖密封,按“2.1”项下色谱条件进样分析,结果阴性对照无干扰,乙醇和正丙醇分离度大于1.5。见图1。

图1 对照品(A)供试品(B)阴性对照(C)GC色谱图
2.4 线性关系考查 分别精密量取乙醇对照品贮备液 0.002、0.01、0.05、0.1、0.2、0.5、0.8、1.0、1.2 和 1.5 ml至内盛水的50 ml量瓶中,精密加入内标溶液5 ml,加水稀释至刻度,摇匀,作为标准曲线溶液,分别精密量取上述溶液5 ml至20 ml顶空进样瓶中,加盖密塞,按“2.1”项下色谱条件进样分析,以乙醇浓度为横坐标,乙醇与正丙醇峰面积比值为纵坐标绘制标准曲线。结果在0.4~303.4 μg/ml浓度范围内,乙醇与内标峰面积比值与乙醇浓度呈良好线性关系,线性方程为Y=0.005 4X-0.005 7(r=0.999 9)。
2.5 精密度试验 精密量取对照品溶液5 ml至20 ml顶空瓶中加盖密封,同法制备6份,按“2.1”项下色谱条件连续进样分析,记录乙醇与正丙醇峰面积比值,RSD为1.35%。
2.6 重复性试验 取同一批供试品(批号160601)照“2.2.3”项下方法平行制备6份供试品溶液,分别精密量取上述溶液5 ml至20 ml顶空瓶中,按“2.1”项下色谱条件进样分析进样分析,乙醇平均残留量为0.81 mg/ml,RSD为0.53%。
2.7 加样回收率试验 取同一批供试品(批号160601),精密量取供试品2.5 ml,置内盛水的50 ml量瓶中,平行制备9份,分别精密加入对照品贮备液0.15、0.20和0.25 ml各3份,再精密加入内标溶液5 ml,加水稀释至刻度,摇匀,作为加样回收溶液。分别精密量取上述溶液5 ml至20 ml顶空瓶中,按“2.1”项下色谱条件进样分析,结果乙醇平均回收率为100.28%,RSD为1.80%。见表1。

表1 加样回收率试验结果(n=9)
2.8 检出限和定量限试验 精密量取乙醇对照品贮备液用水逐步稀释,精密量取上述溶液5 ml至20 ml顶空进样瓶中,加盖密塞,按“2.1”项下色谱条件进样分析,当信噪比为3∶1时,检出限为0.1 μg/ml;当信噪比为 10∶1 时,定量限为 0.4 μg/ml。
2.9 样品中乙醇残留量测定 取5批眼氨肽滴眼液和3批眼氨肽注射液照“2.2.3”项下方法制备供试品溶液,精密量取供试品溶液5 ml至20 ml顶空瓶中,按“2.1”项下色谱条件进样分析,记录峰面积,以内标法计算样品中乙醇残留量,结果见表2。
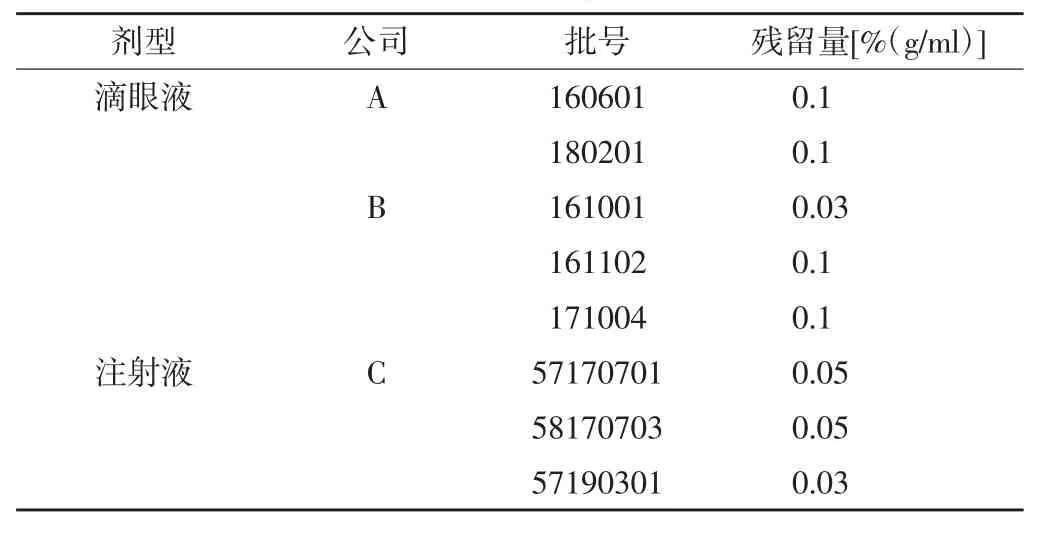
表2 样品中乙醇残留量测定结果
3 讨论
3.1 方法的选择 眼氨肽制剂为多组分生化药物,成分复杂,如选择溶液直接进样法测定乙醇,可能会对测定造成干扰,且对仪器进样口和色谱柱造成损害,故本研究采用顶空进样法,只测定挥发性成分,干扰少,分离度好。
3.2 顶空温度的选择 本研究分别考查了75、80、85和90℃的顶空平衡温度,结果显示,随着温度的上升,乙醇和正丙醇的峰面积均增大,样品在上述温度的顶空条件下,乙醇峰面积与正丙醇峰面积比值变化不大,在85℃时比值达最大值,因此选择85℃作为顶空平衡温度。
3.3 顶空平衡时间的选择 本试验分别考查了10、20和30 min的顶空平衡时间,结果显示,乙醇峰面积与正丙醇峰面积比值在10 min后变化不大,在20 min时,乙醇峰面积与正丙醇峰面积均达到最大值,故选择20 min作为顶空平衡时间。
3.4 乙醇残留量监测的意义 按照《中国药典》2015年版通则[14]0861残留溶剂测定法的要求,乙醇为第三类溶剂,应按药品GMP或其他质量要求加以限制使用,并将其限量定为0.5%。本文建立了简便、准确的方法用于测定眼氨肽制剂的乙醇残留量,并对市售的5批眼氨肽滴眼液和3批眼氨肽注射液样品进行了检测,结果均检出乙醇,测定结果在0.03%~0.1%之间,未超过0.5%,符合《中国药典》要求。不过,本次检测样品数量较为有限,考虑到乙醇残留可导致急性中毒,建议企业及药检部门有必要在日常工作中重视对眼氨肽制剂中乙醇残留量的监测与控制。

