阴生和阳生环境下空心莲子草叶片快速叶绿素荧光诱导动力学的比较
胡文海,李海超,周 兵
阴生和阳生环境下空心莲子草叶片快速叶绿素荧光诱导动力学的比较
*胡文海1,2,李海超1,周 兵1,2
(1.井冈山大学生命科学学院,江西,吉安 343009;2.江西省生物多样性与生态工程重点实验室,江西,吉安 343009)
为了探究空心莲子草对阳生和阴生环境的适应性,对两种光环境下空心莲子草叶片快速叶绿素荧光诱导动力学进行了分析。结果表明,两种光环境下的空心莲子草叶片快速叶绿素荧光诱导动力学曲线(OJIP曲线)存在明显差异,但其PIABS却无差异。阳生环境下的空心莲子草具有相对较高的Sm、ψo、φDo、φRo、ETo/RC、DIo/RC和REo/RC。而阴生环境下的空心莲子草则具有相较高的TRo/RC、RC/CS、ABS/CS和TRo/CS。这表明,阳生环境下的空心莲子草可通过增大PQ库容量和PSI活性来提高光合电子传递链的电子传递效率,并增强热耗散能力以消耗过量吸收光能,从而防御了强光对光合机构的伤害;而阴生环境下,空心莲子草可通过增加单位面积中反应中心数量来增强对弱光的吸收与利用能力。
空心莲子草;阴生环境;阳生环境;快速叶绿素荧光诱导动力学曲线
空心莲子草()是苋科(Amaranthaceae)莲子草属(sp.)多年生宿根草本植物,原产于南美洲巴西等国[1]。由于空心莲子草对环境的适应性强,常能排挤本土植物而形成单一优势群落,危害当地生态多样性,成为我国危害最严重的外来入侵物种之一[2-3]。研究表明空心莲子草具有很强的形态和生理可塑性来适应不同的环境[4]。例如,干旱条件下空心莲子草表现出将更多的生物量分配到根,而较少分配到茎叶,并且其叶绿素含量也显著低于湿生和水生环境下的植株[5-6]。干旱还导致根和叶的组织细胞变小,并诱导合成丰富的抗氧化酶类和抗氧化物质来适应干旱胁迫[7]。氮素的增加有利于空心莲子草对光照反应可塑性的增加,从而使得种群有向贫瘠土壤和弱光环境拓展的风险[8]。半水淹条件下空心莲子草仍保持较高的叶绿素含量和净光合速率,只有在全淹处理下其光合能力才显著减小,但诱导了抗氧化酶活性,因此空心莲子草具有较强的生理可塑性以适应水淹环境[9]。通过与本地近缘种莲子草的比较,空心莲子草具有较快的主茎生长速率、较宽的温度适应范围,以及较高的光合能力,从而使得其具有比本地种更强的竞争力[10]。
空心莲子草具有喜光耐阴的特性,在全光照和阴生条件下均具有良好的生长势,光照强度是影响种群生存与维持、生长和成功入侵的重要因子[11-12]。研究表明,空心莲子草对光照强度具有很强的可塑性,但其基本的空间生长格局特征具有相对稳定性[13-14]。强光下的空心莲子草具有较高的光合速率和光饱和点,而弱光下的空心莲子草则具有相对较大而薄的叶面积[15]。虽然空心莲子草的形态可塑性和光合作用对不同光环境的响应已有一定研究,但不同光环境下空心莲子草光合机构对光能吸收利用的响应与其光环境适应间的关系仍不清楚。植物光合作用由原初反应、电子传递与光合磷酸化和碳同化等生理过程组成,对光温极为敏感[16]。在生物膜能量流动理论基础上建立的快速叶绿素荧光诱导分析技术为深入研究光合作用原初反应,探究PSII供体侧和受体侧电子传递提供了便捷的有力工具[17-18]。为此,我们对全光照和阴生两种光环境下空心莲子草叶片的快速叶绿素荧光诱导动力学曲线和JIP-test参数进行了比较,探索空心莲子草对不同光环境的适应性及其响应机制,以期从光合生理方面理解空心莲子草的入侵机制。
1 材料与方法
1.1 实验材料及地点
实验于2019年10月在井冈山大学进行,实验地点为校园内第一食堂后的情人坡,实验期间为连续晴天。分别选择5株阳生环境(植株完全处于太阳光下,午间最大光强为44500 Lux)和阴生环境(植株完全生长于树荫下,午间最大光强为4700 Lux)的空心莲子草为材料,从生长正常的植株上选择形态学顶端数第三轮至第六轮无病虫斑的健康成熟叶1片,于晴天中午12时测定其快速叶绿素荧光诱导动力学曲线。
1.2 研究方法
1.2.1 快速叶绿素荧光诱导动力学曲线的测定和JIP-test参数的计算
快速叶绿素荧光诱导动力学曲线(OJIP曲线)采用Handy-PEA(Hansatech,英国)进行测定。叶片充分暗适应30min后,OJIP曲线由2000μmol·m-2·s-1红光诱导,测定时间为2 s。
JIP-test参数的计算方法和含义参见李鹏民等[17]文献,文中涉及到的参数包括PIABS:以吸收光能为基础的性能指数;Mo:PSII的原初电子受体QA被还原的最大速率;VJ:J点时的相对可变荧光强度;VI:I点时的相对可变荧光强度;Sm:标准化后的OJIP荧光诱导曲线及y轴围成的面积;ψo:反应中心捕获的激子中用来推动电子传递到电子传递链中超过QA的其它电子受体的激子占用来推动QA还原激子的比率;φEo:用于电子传递的量子产额;φDo:用于热耗散的量子比率;φRo:用于还原PSI受体侧末端电子受体的量子产额;ABS/RC:单位反应中心吸收的光能;TRo/RC:单位反应中心捕获的用于还原QA的能量;ETo/RC:单位反应中心捕获的用于电子传递的能量;DIo/RC:单位反应中心热耗散的能量;REo/RC:单位反应中心电子传递到PSI最终电子受体的能量;RC/CS:单位面积内有活性反应中心的数量;ABS/CS:单位面积吸收的光能;TRo/CS:单位面积捕获的光能;ETo/CS:单位面积电子传递到电子传递链QA下游其他电子受体的能量;DIo/CS:单位面积的热耗散;REo/CS:单位面积电子传递到PSI最终电子受体的能量。
1.2.2 数据处理
利用Origin9.0软件进行实验数据的统计检验。采用one-way ANVOA Tukey检验分析不同处理间的差异性,当< 0.05时认为差异显著。论文中所列数据均为平均值±标准误差,= 5。图表中不同字母表示在5%水平上处理间具有显著性差异。
2 结果与分析
2.1 对叶片OJIP曲线和性能指数的影响
由图1可知,阳生环境下空心莲子草叶片的叶绿素荧光值明显低于阴生环境下的植株,两者间的OJIP曲线存在显著差异;然而两者间的PIABS却无差异。

图1 阴生和阳生环境下空心莲子草叶片OJIP曲线和性能指数的比较
2.2 对PSII受体侧的影响
两种光环境下的空心莲子草Mo和φEo没有差异,但阳生环境下植株具有更高的Sm、ψo、φDo和φRo,以及较低的VJ和VI(表1)。
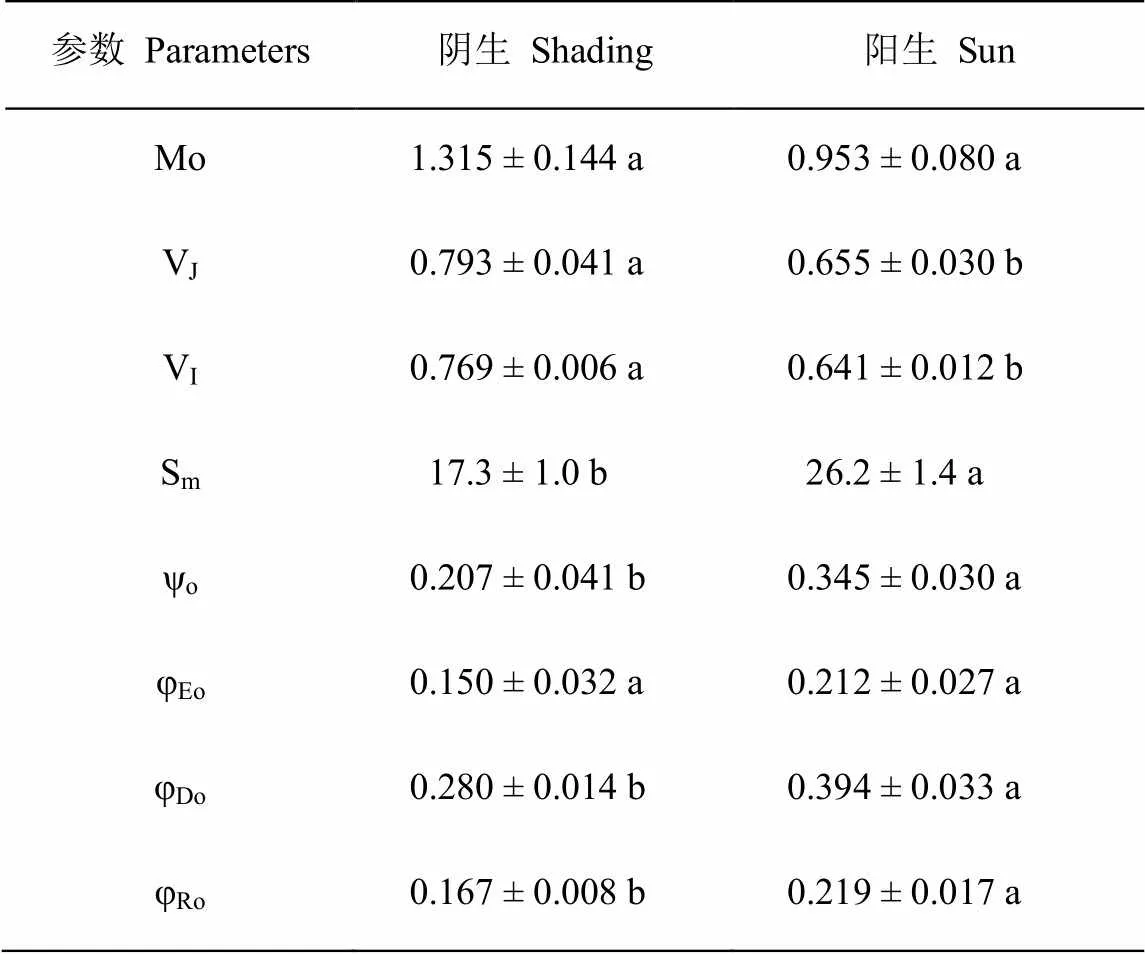
表1 阴生和阳生环境下空心莲子草叶片Mo、VJ、VI、Sm、ψo、φEo、φDo和φRo的比较
2.3 对PSII反应中心和叶片比活性的影响
对于单位有活性的PSII反应中心而言,两种光环境下空心莲子草叶片的ABS/RC并没有明显区别,但阳生环境下空心莲子草叶片具有比阴生环境下植株更高的ETo/RC、DIo/RC和REo/RC,而阴生环境下的空心莲子草则具有较高的TRo/RC(图2A)。对于单位叶片面积而言,阴生环境下的空心莲子草具有比阳生环境下植株更高的RC/CS、ABS/CS和TRo/CS,但两种光环境下空心莲子草的ETo/CS、DIo/CS和REo/CS无差异(图2B)。
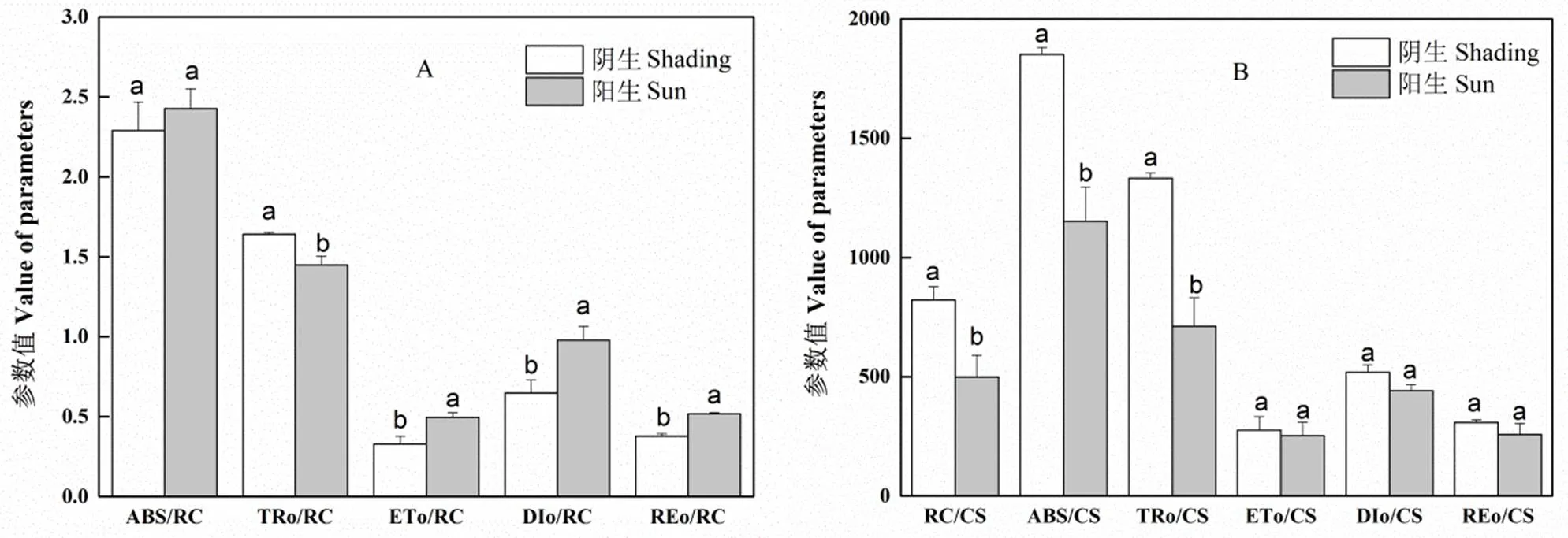
图2 阴生和阳生环境下空心莲子草叶片比活性参数的比较
3 讨论
空心莲子草作为一种入侵性极强的入侵植物,其对各种环境均具有较强的适应性。本研究中生长于阴生和阳生环境下的空心莲子草叶片OJIP曲线存在明显差异,但其光合性能指数(PIABS)却无差异。植物OJIP曲线中包含着大量关于PSII反应中心原初光化学反应的信息[17],这表明空心莲子草的原初反应对光环境极为敏感,并能够通过原初反应的可塑性来适应不同的光环境。
就植物对光环境的适应而言,阳生环境下植物主要是防御强光伤害。依照能量流动模型,天线色素吸收的能量大部分被反应中心所捕获并转化为还原能,通过PSII反应中心受体侧的电子传递体氧化还原进行能量传递,从而产生电子传递[17-18]。本实验中,两种光环境下空心莲子草PSII的原初电子受体QA被还原的最大速率(Mo)和用于电子传递的量子产额(φEo)并没有差异,这说明PSII所捕获的光能转化为还原能并驱动PSII受体侧电子传递能力并没有差异[17,19]。然而,阳生环境下空心莲子草叶片具有较高的电子传递到电子传递链中QA-下游的电子受体的概率(ψo)[19],这表明PSII受体侧的电子传递能够顺利进行,即空心莲子草能够较好地适应强光环境。进一步分析发现,阳生环境下空心莲子草叶片具有较大的PQ库(Sm)和PSI受体侧末端电子受体的量子产额(φRo)[17,19],这意味着阳生环境下的空心莲子草可以通过增大PQ库容量和PSI活性来保障强光下叶片光合电子传递的顺利进行。而阳生环境下空心莲子草具有相对较低的VJ和VI则进一步佐证了这一点。VJ和VI反映了在J点和I点关闭的反应中心数量,即QA-的积累量[20]。VJ值越高则表明PSII受体侧QA向次级醌受体QB电子传递越受到阻碍,VI增高则表明PQ库接受电子的能力下降[21-22]。
事实上,虽然阳生环境下空心莲子草单位叶面积有活性的反应中心数量(RC/CS)低于阴生环境,但其有活性的反应中心的电子传递效率明显高于阴生环境,表现为单位反应中心捕获的用于电子传递的能量(ETo/RC)[17]相对较高。另一方面,阳生环境下的空心莲子草单位反应中心捕获的用于热耗散的能量(DIo/RC)和吸收光能中用于热耗散的量子比率(φDo)[17]也明显高于阴生环境下植株,这说明空心莲子草可以通过增强热耗散能力以消耗吸收光能。因此,阳生环境下空心莲子草可通过提高光合电子传递链的电子传递效率和热耗散效率来提高能量的利用与耗散,从而减轻了强光对光合机构的伤害。
植物适应弱光环境则主要是提高对弱光的利用能力。在本研究中,两种光环境下空心莲子草叶片的ABS/RC和TRo/RC也没有明显区别,这说明两种光环境下单位有活性的反应中心对光能的吸收能力和捕获能力并没有差异[17-19]。但是,阴生环境下的空心莲子草具有较阳生环境下更高的RC/CS、ABS/CS和TRo/CS。RC/CS、ABS/CS和TRo/CS分别代表了单位面积上反应中心的数量、单位面积吸收的光能和捕获的光能[17,19]。这表明阴生环境下的空心莲子草单位面积叶片具有更多有活性的反应中心数量,这将有利于空心莲子草在弱光下吸收更多的光能并转化为还原能,提高了空心莲子草对弱光的利用能力。杨永清等的研究也表明,空心莲子草叶片叶绿素含量随着光照降低而显著增加[5]。然而,由于阴生环境下空心莲子草单位有活性的反应中心的电子传递能力(ETo/RC)和热耗散(DIo/RC)能力低于阳生环境下植株,从而导致两种光环境下空心莲子草单位面积上的电子传递(ETo/CS)和热耗散能力(DIo/CS)[17]并无明显差异。因此,空心莲子草主要是通过增加单位面积中反应中心的数量来增强对弱光的吸收与利用能力。
综上所述,空心莲子草可通过增大PQ库和PSI活性来提高光合电子传递链的电子传递效率,并通过增强热耗散能力以消耗过量光能,从而防御了强光对光合机构的伤害。而弱光环境下,空心莲子草可通过增加单位面积中反应中心数量来增强对弱光的吸收与利用能力。
[1] 周兵,陈洁,马胜平,等. 空心莲子草致病菌链格孢菌不同菌株的致病性及培养条件[J]. 西南农业学报,2016, 29(2): 321-326.
[2] 吕晓倩,韩翠敏,奚道国,等. 克隆整合有利于喜旱莲子草入侵本地植物种群[J]. 江西农业大学学报,2019, 41(6): 1093-1102.
[3] 王瑞,周忠实,张国良,等. 重大外来入侵杂草在我国的分布危害格局与可持续治理[J]. 生物安全学报,2018,27(4): 317-320.
[4] 吴昊,张辰,代文魁. 气候变暖和物种多样性交互效应对空心莲子草入侵的影响[J]. 草业学报,2020,29(3): 38-48.
[5] 杨永清,张学江. 不同生态型喜旱莲子草对干旱的生理生态反应[J]. 湖北农业科学,2010,49(8): 1890-1893.
[6] 曹裕松,肖宜安,周兵,等. 不同水分生境中空心莲子草自然种群的表型可塑性[J]. 井冈山大学学报:自然科学版,2012,33(3): 102-106.
[7] 肖强,高建明,罗立廷,等. 干旱胁迫对空心莲子草抗氧化酶活性和组织学的影响[J]. 生物技术通报,2006,17(4): 556-559.
[8] 杨永清,龙富波,张伟,等. 入侵植物喜旱莲子草对光、氮及其互作的表型可塑性反应[J]. 贵州农业科学,2011,39(4): 38-41.
[9] 张乖乖,简敏菲,余厚平,等. 水淹胁迫下空心莲子草的光合和荧光特征及其生理和生态响应[J]. 湿地科学,2018,16(1): 73-78.
[10] 张彩云,刘卫,徐志防,等. 入侵种喜旱莲子草和莲子草的营养生长和光合作用对温度的响应[J]. 热带亚热带植物学报,2006,14(4): 333-339.
[11] Longstreth D J,Mason CB. The effect of light on growth and dry matter allocation patterns of(Mart.) Griseb [J]. Botanical Gazette,1984, 145(1): 105-109.
[12] 许凯扬,叶万辉,李国民,等. 入侵种喜旱莲子草对光照强度的表型可塑性反应[J]. 武汉植物学研究,2005, 23(6): 560-563.
[13] 陈中义,王府京,王英英,等. 光照强度对2种来源的空心莲子草生长的影响[J]. 长江大学学报(自科版)农学卷,2007,4(1): 68-71.
[14] 张紫妍,张致杰,潘晓云. 喜旱莲子草对遮荫的可塑性反应:入侵地与原产地种群的比较[J]. 生物多样性,2015,23(1): 18-22.
[15] Longstreth D J, Bolanos J A, Goddard R H. Photosynthetic rate and mesophyll surface area in expanding leaves ofgrowth at two light levels [J]. American Journal of Botany, 1985, 72(1): 14-19.
[16] Nelson N, Yocum C F. Structure and function of photosystem I and II [J]. Annual Review of Plant Biology, 2006, 57, 521-565.
[17] 李鹏民,高辉远,Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理学与分子生物学学报,2005,31(6): 559-566.
[18] Tsimilli-Michael M. Revisiting JIP-test: An educative review on concepts, assumptions, approximations, definitions and terminology [J]. Photosynthetica, 2019, 57(SI), 90-107.
[19] 苏晓琼,王美月,束胜,等. 外源亚精胺对高温胁迫下番茄幼苗快速叶绿素荧光诱导动务学特性的影响[J]. 园艺学报,2013,40(12): 2409-2418.
[20] 原佳乐,马超,冯雅岚,等.不同抗旱性小麦快速叶绿素荧光诱导动力学曲线对干旱及复水的响应[J].植物生理学报,2018,54(6): 1119-1129.
[21] Strasser R J, Srivastava A, Govindjee. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria [J]. Photochemistry and Photobiology, 1995, 61(1):32-42.
[22] Henmi T, Miyao M, Yamamoto Y. Release and reactive-oxygen-mediated damage of the oxygen- evolving complex subunits of PSII during photoinhibition [J]. Plant and Cell Physiology, 2004, 45(2):243-250.
COMPARISON OF CHLOROPHYLL FLUORESCENE TRANSIENT IN LEAVES OFUNDER SHADING AND SUN ENVIRONMENT
*HU Wen-Hai1,2, LI Hai-Cao1, ZHOU Bing1,2
(1. School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China; 2. Key Laboratory for Biodiversity Science and Ecological Engineering, Ji’an, Jiangxi 343009, China)
In order toexplore the adaptability ofto the shading and sun environment, the chlorophyll fluorescence transient in leaves ofunder shading and sun environment was studied. The results showed that there was significant difference in OJIP curve between the leaves ofunder the two light condition, however, there was no difference in PIABS. Under sun environment,possessed higher Sm, ψo, φDo, φRo, ETo/RC, DIo/RC and REo/RC. However, there were higher TRo/RC、RC/CS、ABS/CS和TRo/CS in the leaves ofunder shading environment. These results indicated thatunder sun environment can improve the electron transfer efficiency by increasing the PQ pool capacity and PSI activity, and consume excessive light energy by enhancing the heat dissipation ability, which can prevent the damage of high light to photosynthetic apparatus. Under shading environment,can increase the number of reaction centers per unit leaf area to enhancing the capacity of absorption and utilization of low light.
; shading environment; sun environment; chlorophyll fluorescence transient
S642.2
A
10.3969/j.issn.1674-8085.2020.04.008
1674-8085(2020)04-0038-05
2020-03-12;
2020-05-16
江西省高等学校科技落地计划项目(KJLD12079)
*胡文海(1973-),男,江西吉安人,教授,博士,主要从事植物逆境生理方面的研究(Email:huwenhai@jgsu.edu.cn);
李海超(1998-),女,内蒙古赤峰人,井冈山大学生命科学学院生物科学专业2016级本科生(E-mail:1047025512@qq.com);
周 兵(1977-),男,湖北黄梅人,副教授,博士,主要从事植物生态学方面的研究(Email: zhoubing113@126.com).

