溶瘤病毒在乳腺癌治疗中的研究进展
马海燕 综述 王欣 审校
乳腺癌是女性常见的恶性肿瘤之一,具有增殖快、耐药性高和易发生转移等特点,发病率和死亡率逐年升高,严重威胁女性生命健康[1]。手术、放化疗和内分泌治疗是乳腺癌的主要治疗手段,尽管现有治疗手段对乳腺癌的治疗效果已有较大改善,但仍存在一定的局限性[2],因此需要探索新的治疗方式。随着基因工程的高速发展和精准医疗理念的提出,免疫治疗成为肿瘤治疗的研究热点[3],其中能在肿瘤细胞内大量复制并最终杀死肿瘤的溶瘤病毒(onco⁃lytic viruses,OVs)成为肿瘤治疗中最有潜力和应用前景的治疗手段之一[4]。本文将就OVs 作用机制及目前应用于乳腺癌中的OVs研究进行综述。
1 OVs的分类及发展过程
OVs是天然存在或经基因编辑后,具有肿瘤特异性复制能力并导致肿瘤细胞溶解和死亡的病毒,根据OVs基因组遗传物质的不同可分为DNA病毒和RNA病毒。常见的DNA病毒包括溶瘤腺病毒(oncolytic adenoviruse,oAd)、溶瘤单纯疱疹病毒(oncolytic herpes simplex virus,oHSV)、溶瘤痘苗病毒(oncolytic vaccinia virus,oVV)等,常见的RNA病毒包括呼肠孤病毒(reovirus,REOV)、柯萨奇病毒(Coxsackie virus,CV)和新城疫病毒等。20世纪初,科学家偶然发现宫颈癌患者在感染狂犬病毒后肿瘤消失,初次意识到某些病毒或许能够治疗肿瘤,OVs疗法的概念即被提出。OVs治疗方法发展过程见表1。
2 OVs作用机制
OVs 通过包括靶向转导、靶向转录、靶向翻译和靶向促凋亡的靶向机制,选择性进入肿瘤细胞,主要集中在细胞质及细胞核内[6]。OVs 利用宿主细胞的能量与原料进行大量复制,裂解肿瘤细胞,释放子代病毒,进一步扩散感染周围的肿瘤细胞。OVs杀伤肿瘤细胞的作用机制如下:1)直接杀伤肿瘤细胞:被编辑的OVs 可表达胞嘧啶脱氨酶(cytosine deaminase,CD),该酶可使无毒的前体药物转化为有生物活性的核苷酸类似物药物[7],抑制肿瘤细胞DNA 的复制过程,直接杀伤肿瘤细胞。2)抑制血管生成:肿瘤的浸润和转移有赖于血管的生成,内皮抑制素和血管抑制素是两种内源性广谱血管生成抑制剂,可抑制血管生成,但无法在肿瘤微环境中持续性表达。OVs可促进两种抑制剂的表达,也可通过感染直接破坏血管内皮细胞及基质细胞,显著减低血管密度[8],抑制肿瘤血管生成。3)调节肿瘤微环境:实体瘤中的细胞外基质(extracellular matrix,ECM)使肿瘤细胞处于免疫抑制性微环境中,导致癌细胞对多种抗肿瘤疗法耐药。利用重组的OVs 表达基质金属蛋白酶(ma⁃trix metalloproteinase,MMP),可降解ECM,加强病毒扩散能力,提高病毒在肿瘤细胞内的浓度,起到抗肿瘤作用[9]。4)促进抗肿瘤免疫:OVs在进入肿瘤细胞后,除直接杀伤肿瘤细胞外,还可激活机体抗肿瘤免疫反应。通过释放病毒病原体相关分子模式(patho⁃gen associated molecular patterns,PAMPs)和细胞损伤相关分子模式(damage associated molecular patterns,DAMPs),激活免疫系统释放炎性因子(干扰素、白细胞介素、肿瘤坏死因子等),诱导抗肿瘤免疫反应。肿瘤微环境中T淋巴细胞的活化,可增强T细胞对肿瘤的浸润,使细胞毒性T淋巴细胞识别并杀伤表面及远端肿瘤细胞[10]。
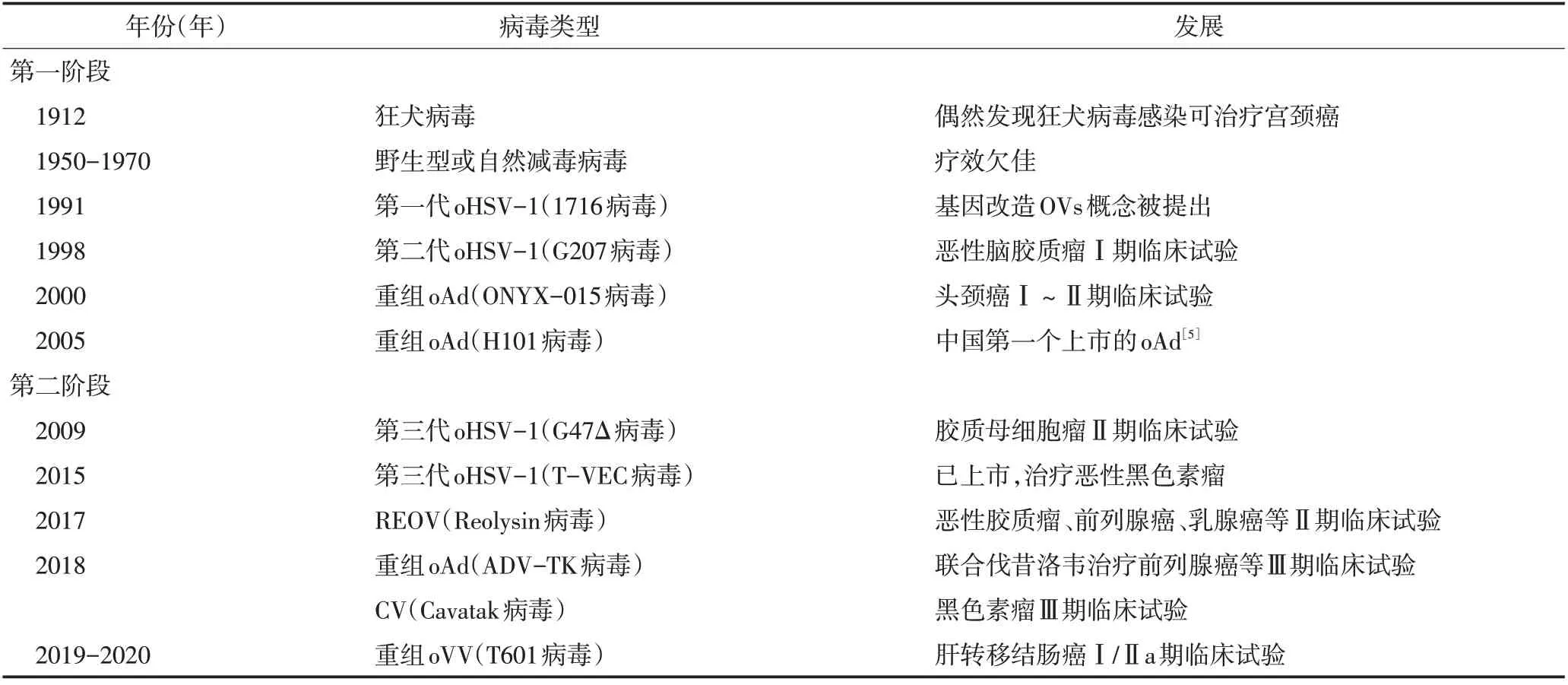
表1 OVs治疗方法的发展过程
3 乳腺癌治疗中的OVs疗法
3.1 oAd对乳腺癌的治疗
oAd 又称条件复制型腺病毒,为线性双链DNA病毒,基因组大小约36 kb,含有较多复制非必须基因(E3区),易于体外培养,产量高,生物学稳定,是OVs疗法研究领域的热点[11]。Ang 等[12]设计一条含有9个三阴性乳腺癌(triple negative breast cancer,TNBC)致癌性miRNAs(oncogenic miRNAs,OncomiRs)互补结合序列的干扰性长链非编码RNA(long non-cod⁃ing,LncRNA),插入到E3 区后,LncRNA 能在Survivin蛋白表达阳性的乳腺癌细胞中高度复制,从而破坏OncomiRs 功能,抑制TNBC 细胞的上皮间质转化,抑制率最高达73.84%,达到肿瘤的靶向干预疗效。王炜川等[13]为提高OVs靶向性,构建由人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)启动子驱动的oAd,该重组OVs可特异性地靶向和杀死具有阳性端粒酶活性的乳腺癌MCF-7细胞和干细胞样细胞,同时抑制裸鼠移植瘤的生长,抑制率达84.5%,发挥抗肿瘤作用。以上研究均表明,oAd是治疗乳腺癌有效的抗肿瘤药物。
3.2 oHSV对乳腺癌的治疗
oHSV 是一类安全性较高、目前临床使用最广泛的OVs。相比于其他OVs,oHSV病毒宿主广泛,基因组庞大(152 kb)。李俊杰等[14]利用第三代oHSV(G47Δ 病毒)感染人原代乳腺癌细胞,发现该oHSV在感染负数(multiplicity of infection,MOI)为0.01 时可杀灭91%以上癌细胞,且对正常乳腺细胞无杀伤毒性,说明对于部分乳腺癌晚期患者,该oHSV 是一种潜在的治疗选择。研究还发现G47Δ 病毒可通过诱导HER-2 蛋白降解,诱导乳腺癌MCF-7 细胞凋亡,起到靶向抗肿瘤作用[15]。
3.3 oVV对乳腺癌的治疗
oVV 是一类基因组较复杂的线形双链DNA 病毒,几乎可以感染所有细胞系,是肿瘤免疫治疗的潜在优势载体。与其他OVs相比,oVV有天然的肿瘤趋向性,可在血液中远距离传播,有效地感染肿瘤组织。刘超等[16]通过敲除N1L 基因改造oVV,并插入IL-21 细胞因子,构建出新型oVV。该研究发现对小鼠JC 乳腺癌细胞有较高的杀伤能力,并在上清中检测出高表达的IL-21蛋白,有较好的抗肿瘤趋势。除此之外,Choi 等[17]还发现,重组副痘病毒属的CF189病毒能够在4 种TNBC 细胞中诱导出细胞毒性,且在较低剂量(MOI为0.01)时就具有有效的抗肿瘤作用,说明该类OVs 的免疫调节性质为TNBC 患者可能带来新型的治疗方法。
3.4 REOV对乳腺癌的治疗
REOV 是一类分节段的双链RNA 病毒,能够感染几乎所有哺乳动物,人感染后多数不引起临床反应,少数有轻微的呼吸道或胃肠道症状。野生型的REOV可在肿瘤细胞中选择性复制,对多种肿瘤细胞有溶瘤能力[18],是一种有前景的癌症治疗新途径。REOV可参与调控Ras信号通路,活化蛋白激酶R,抑制肿瘤细胞RNA 的合成与翻译,最终诱导细胞凋亡[19]。朱敬之等[20]证明,REOV 可裂解乳腺癌组织,并对乳腺癌干细胞具有杀伤作用,防止乳腺癌转移。目前,以哺乳动物REOV 为基础开发的Reolysin病毒已被证明可用于转移性乳腺癌治疗,对乳腺癌的靶向治疗具有重大意义。
3.5 OVs联合其他免疫疗法对乳腺癌的治疗
免疫疗法对乳腺癌有快速和确切的疗效,最初OVs作为单一药物进行研究,发现与现有免疫疗法相结合,OVs 可改变抗肿瘤免疫应答,增强治疗疗效。Liikanen等[21]构建编码曲妥珠单抗重、轻链基因的血清型oAd,在感染的癌细胞中有明显的抗体表达,且抗体的浓度明显高于常规给药后的浓度(P<0.001),说明OVs增强曲妥珠单抗对HER-2阳性乳腺癌的作用。Bourgeois-Daigneault 等[22]通过对TNBC 小鼠模型的研究发现,将Maraba 弹状病毒与检查点抑制剂结合,可在mRNA 水平和蛋白水平上,上调PD-L1表达,这种新型组合对于TNBC小鼠模型的治愈率高达90%,说明OVs 使肿瘤对免疫检查点抑制剂更加敏感。常见的乳腺癌免疫治疗分类见表2。
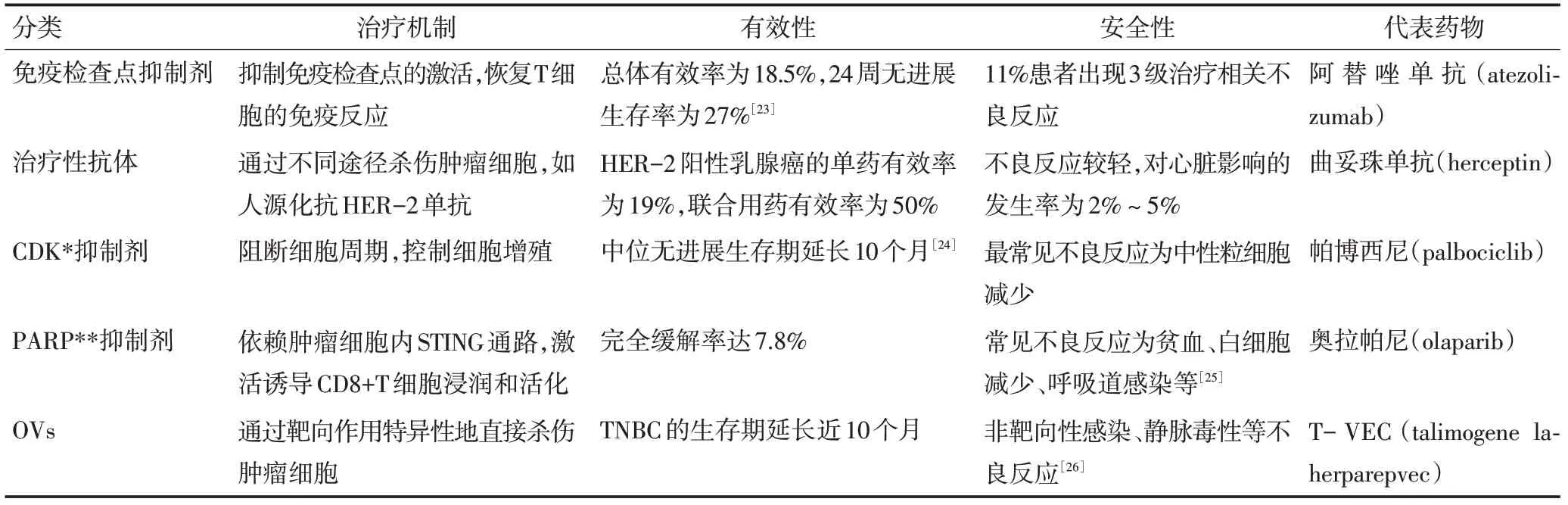
表2 OVs治疗方法与其他免疫疗法对比
4 结语
OVs 特异性感染肿瘤细胞并诱导免疫应答发挥抗肿瘤的特性,使其成为乳腺癌免疫治疗的一种新型治疗方法。OVs 疗法对几乎无免疫原性或免疫抑制性的实体肿瘤的疗效欠佳,因此有一定的局限性,且OVs 自身免疫原性较高,易被识别为病原体,导致机体产生强烈的免疫反应。目前,OVs 主要以瘤内注射为主,静脉注射存在宿主免疫系统清除病毒、非靶向性感染、静脉毒性等问题。大多数OVs疗法仍处于前期研究阶段,与真正意义上的临床应用仍有较大的距离。如何保证OVs 的有效性,提高安全性,优化给药途径是目前研究的主要任务,期待OVs疗法早日突破乳腺癌治疗难题,实现个体化、精准化免疫治疗。

