进展期胃癌新辅助治疗后病理完全缓解相关因素分析及风险预测模型建立*
田园 杨沛刚 李勇 范立侨 张志栋 王冬 赵雪峰 赵群
胃癌是全球最常见的消化系统恶性肿瘤疾病之一,其发病率约9%,死亡率高达8.8%,分别位居全球恶性肿瘤疾病中的第4位和第2位[1]。基于胃癌的高发病率及死亡率,治疗模式由单一的手术治疗逐步发展到以手术为主的综合治疗,其中新辅助治疗受到越来越多的关注,临床上多使用世界卫生组织(WHO)标准和RECIST 1.1标准来衡量肿瘤长径的变化或比较化疗前后肿瘤T、N、M 分期的变化,用以评估新辅助化疗疗效[2],但其准确性有待商榷[3]。病理退缩分级是目前最准确判断新辅助治疗有效性的方式,本研究对影响进展期胃癌新辅助治疗后病理缓解率的因素进行探讨。
1 材料与方法
1.1 病例资料
回顾性分析2011年6月至2018年3月河北医科大学第四医院收治的452例局部进展期胃或食管-胃结合部腺癌患者临床资料。纳入标准:1)经CT、胃镜或超声胃镜证实临床分期为cT3~4N+~M0,腹腔镜探查未见种植转移,腹腔游离细胞学阴性;2)KPS评分>80分;ECOG评分:0~1 分;3)根据RECIST 1.1 标准具有可测量病灶;4)筛选前7天内(包括7天),实验室检测数据:中性粒细胞计数≥1.5×109/L、血小板计数≥100×109/L、血红蛋白≥90 g/L、肝功能<1.5 倍正常上限值、血清胆红素≤1.0 μmol/L、血清肌酐<1.5 μmol/L、PT-INR/PTT<1.7倍正常上限值。排除标准:1)伴有肝肾、心血管系统等重要脏器严重疾病,影响化疗或手术的情况;2)对化疗药物及其辅料过敏者;3)入组前接受过任何形式的化疗或者其他研究药物;4)育龄期妇女,不同意采取避孕方法,妊娠或哺乳期妇女;5)伴有吞咽困难、活动性消化道溃疡、完全或不全肠梗阻、消化道活动性出血、穿孔等致口服卡培他滨有困难者;6)合并其他肿瘤。
1.2 方法
1.2.1 新辅助治疗方案 SOX方案新辅助化疗:奥沙利铂130 mg/m2,静脉注射,2 h,d1(加入5%葡萄糖溶液500 mL 中静脉点滴);替吉奥40 mg/m2,2 次/d,口服。连续14 天,每3 周重复1 次。术前进行2 个周期,每2个周期评价疗效,术后行6个周期。
XELOX方案新辅助化疗:奥沙利铂130 mg/m2,静脉注射,2 h,d1(加入5%葡萄糖溶液500 mL中静脉点滴);卡培他滨1 000 mg/m2,2次/d,口服。连续14天,每3周重复1次。术前进行2~4个周期,每2个周期评价疗效,术后行4~6个周期。
DOX 方案新辅助化疗:多西他赛60 mg/m2,静脉注射,2 h,d1;奥沙利铂130 mg/m2,静脉注射,2 h,d1;卡培他滨1 000 mg/m2,2 次/d,口服。连续14 天,每3周重复1 次。术前进行4 个周期,每2 个周期评价疗效,术后行4个周期。
同步放化疗:患者取仰卧位,固定体膜,饮水800~1 000 mL充盈胃腔,行增强CT扫描定位,根据CT定位以厚度>5 mm的管壁勾画GTV-t,并参照上消化道钡餐造影、食管/胃镜和MRI等结果综合确定;上沿食管方向外扩2.0 cm,下沿胃体方向外扩1.5~2.0 cm,轴向外扩0.8 cm为CTV-t;CTV-nd依据CT/MRI等影像学检查结果进行勾画;CTV-nd包括CTV-nd和转移淋巴结受累区域;将CTV-t与CTV-nd融合为CTV,外扩0.8~1.0 cm定义为PTV。调强放疗剂量为45 Gy/25次,1.8 Gy/d,5次/周。同步行2个周期XELOX方案化疗,术后行6个周期XELOX方案化疗。
同步放化疗加靶向治疗:上述同步放化疗方案期间,HER-2阳性患者静脉输注赫赛汀初始负荷剂量为8 mg/kg,随后6 mg/kg;HER-2阴性患者口服甲磺酸阿帕替尼:剂量为250 mg/d,餐后服用,1次/d。术后6个周期单药口服卡培他滨1 000 mg/m2,2次/d,口服。连续14天,每3周重复1次。
1.2.2 病理评估标准 病理检查的报告描述应包括肿瘤最长径、浸润深度、淋巴结转移数、切除标本上下切缘及环周切缘是否有瘤细胞浸润、HER-2 表达情况以及肿瘤退缩分级。
2011年版美国国立综合癌症网络(NCCN)指南中肿瘤退缩分级:0级(完全缓解),无癌细胞;1级(部分缓解),单个或小灶癌细胞残留;2 级(疗效小),残留癌灶伴纤维增生;3 级(疗效差),疗效微小或无疗效,广泛残余癌细胞。
1.2.3 随访 在治疗完成后第1年,每3个月复查1次,第2、3年每6个月复查1次,第4、5年每1年复查1次,期间如果有特殊不适随时复诊。常规复查内容为血常规、生化全项、肿瘤标记物、全腹CT,术后1年复查胃镜。随访截至2020年3月,两组患者随访时间为17~93个月,平均随访时间为43个月。
1.3 统计学分析
采用SPSS 20.0 软件进行统计学分析,符合正态分布的计量资料用表示,两组间比较采用独立样本的t检验,计数资料采用χ2检验或者Fisher 精确检验。新辅助治疗后病理完全缓解(pathological com⁃plete response,pCR)的多因素分析采用Logistic 二分类多因素回归分析,Log-Rank 检验比较组间生存曲线间的差异。以P<0.05为差异具有统计学意义。
2 结果
2011年6月至2018年3月共2 416例胃癌患者于本院接受手术治疗,504 例(20.9%)局部进展期胃及食管-胃结合部癌患者接受新辅助治疗及手术,最终452例(89.7%)接受了R0切除的患者纳入研究,其中44例(9.7%)患者术后病理未见癌细胞被定义为pCR组,408 例(90.3%)患者术后病理有癌细胞残留被定义为非pCR组。
pCR组11例接受SOX方案2个周期新辅助化疗,6例接受XELOX 方案2 个周期新辅助化疗,2 例接受XELOX方案4个周期新辅助化疗,6例接受DOX方案4个周期新辅助化疗,10例接受同步放化疗,9例接受同步放化疗加靶向治疗。非pCR组133例接受SOX方案2个周期新辅助化疗,130例接受XELOX方案2个周期新辅助化疗,43例接受XELOX方案4个周期新辅助化疗,28例接受DOX方案4个周期新辅助化疗,55例接受同步放化疗,19例接受同步放化疗加靶向治疗。
2.1 胃癌新辅助治疗后pCR单因素分析
胃癌新辅助治疗后pCR与以下因素无相关:患者性别(P=0.584)、年龄(P=0.127)、ECOG评分(P=0.825)、吸烟史(P=0.157)、饮酒史(P=0.416)、病理类型(P=0.782)、Borrmann 分型(P=0.153)、治疗前N 分期(P=0.193)、肿瘤部位(P=0.828)、HER-2表达(P=0.909)、治疗期间严重不良反应发生(P=0.260)。
治疗前T分期为T3期(P<0.001)、肿瘤最长径<4 cm(P<0.001)、治疗前CA199≤30 U/mL(P=0.033)、治疗结束与手术时间间隔≥6周(P=0.029)、同步放化疗或联合靶向治疗方案(P<0.001)和局部进展期胃癌新辅助治疗后高pCR率有关(表1)。
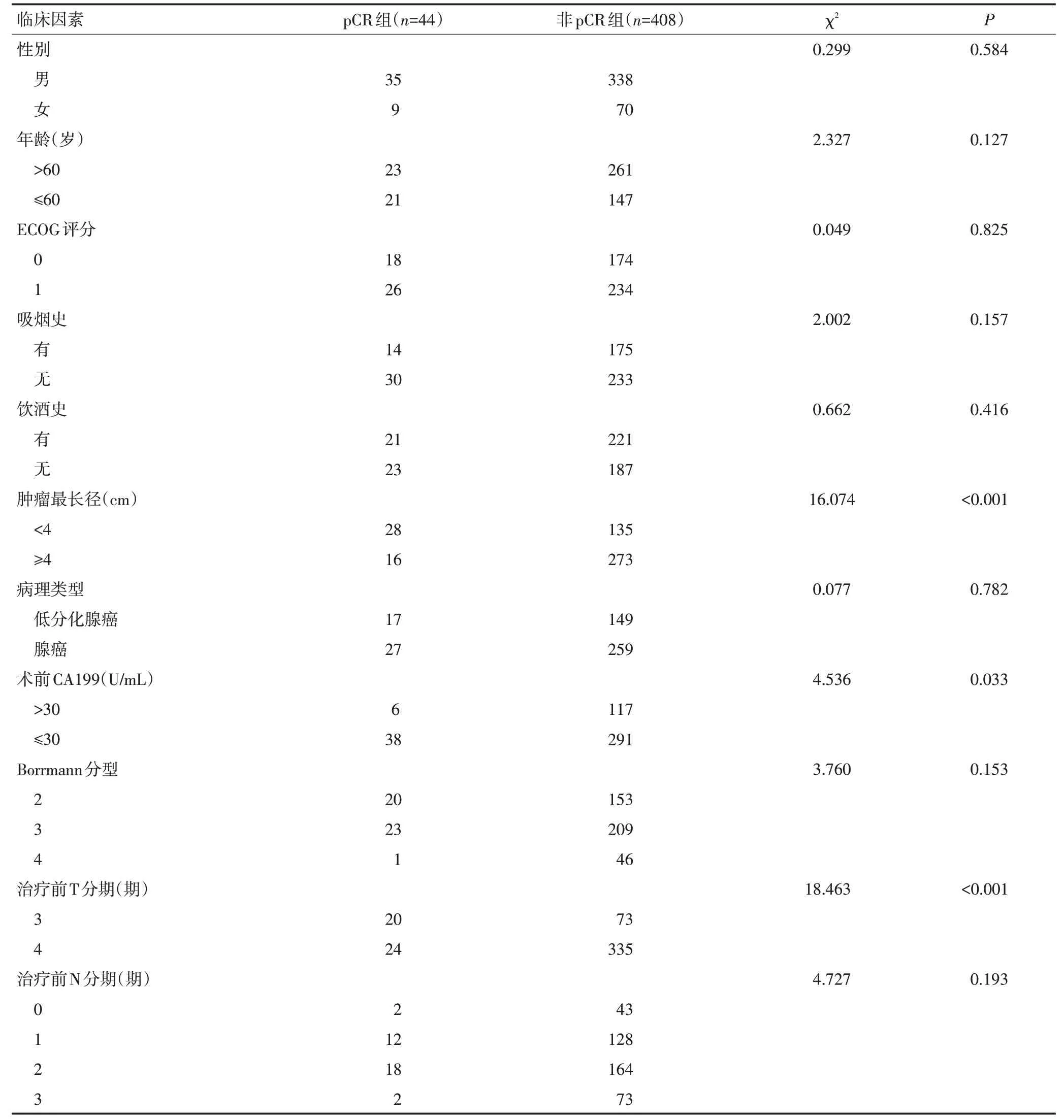
表1 进展期胃癌患者新辅助治疗后pCR单因素分析 例
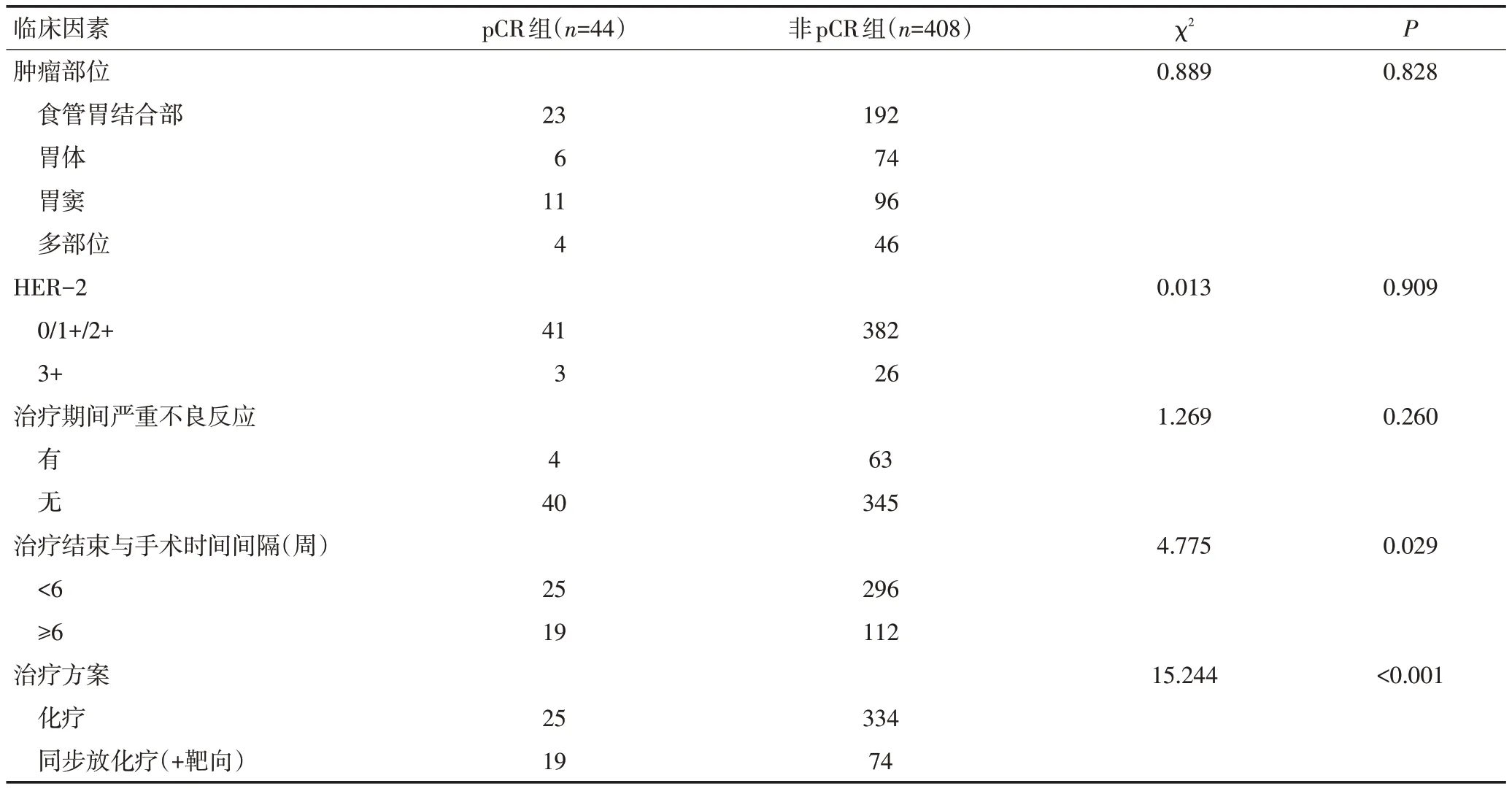
表1 进展期胃癌患者新辅助治疗后pCR单因素分析 例(续表1)
2.2 进展期胃癌新辅助治疗后pCR 的多因素Logis⁃tic回归分析结果
患者治疗前T 分期为T3 期、CA199≤30 U/mL、肿瘤最长径<4 cm、新辅助同步放化疗或联合靶向治疗是影响进展期胃癌新辅助治疗后出现pCR 的独立因素(均P<0.05,表2)。
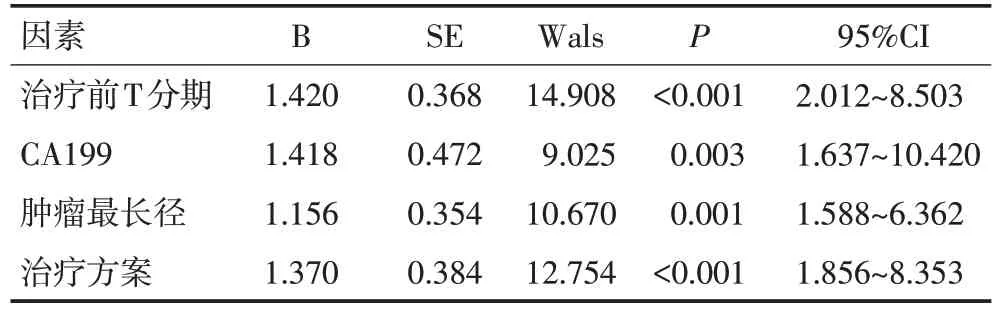
表2 452 例进展期胃癌患者新辅助治疗后pCR 的多因素Logistic回归分析
2.3 风险预测评分模型的建立及验证
根据多因素Logistic 回归结果建立风险预测方程:P=-4.860+1.420×X1+1.370×X2+1.156×X3+1.418×X4,采用Hosmer-Lemeshow 检验检测回归方程的拟合优度(P=0.988)。采用ROC 曲线评价回归方程的区分度,曲线下面积为0.825(95%CI:0.767~0.884,P=0.000,图1)。根据多因素Logistic回归方程的回归系数对影响新辅助治疗后pCR 的相关因素进行评分建立参数模型(表3)。患者治疗前T 分期为T3 期、CA199≤30 U/mL、肿瘤最长径<4 cm、新辅助同步放化疗或联合靶向治疗等指标出现pCR 的预测评分均为1 分。评分>2 分患者出现pCR 的概率为34.48%,评分≤2分患者出现pCR的概率为6.09%。
2.4 生存分析
两组患者随访时间为17~93 个月,平均随访时间为43 个月,pCR 组在无复发生存期(relapse free survival,RFS)和总生存期(overall survival,OS)上均明显高于非pCR 组患者,pCR 组的中位RFS 为48 个月,非pCR组为35个月(χ2=17.322,P=0.001),pCR组的中位OS 为61 个月,非pCR 组为45 个月(χ2=7.848,P=0.005,图2,3)。
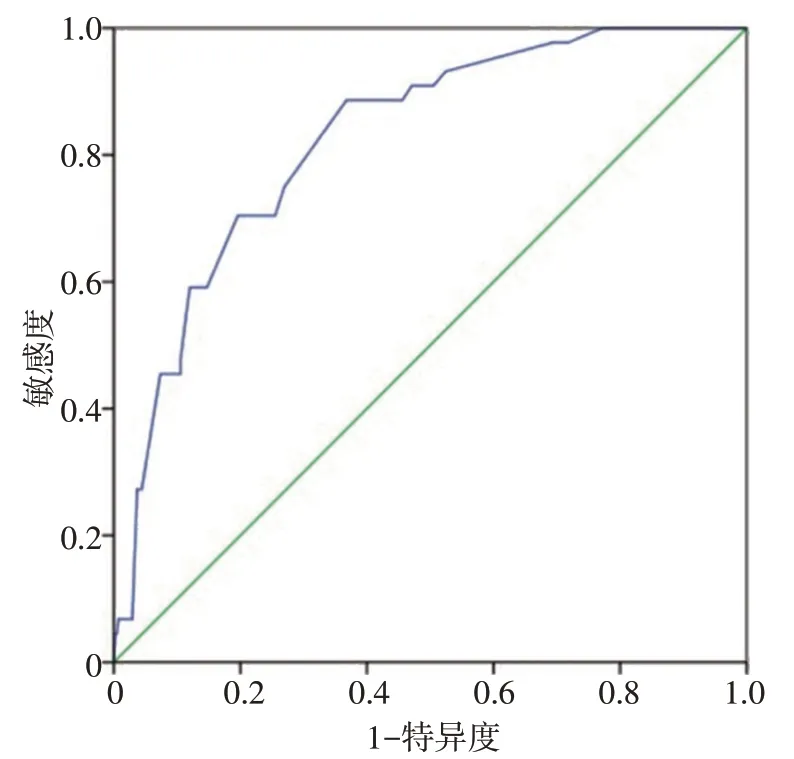
图1 进展期胃癌患者新辅助治疗后pCR相关影响因素预测模型曲线
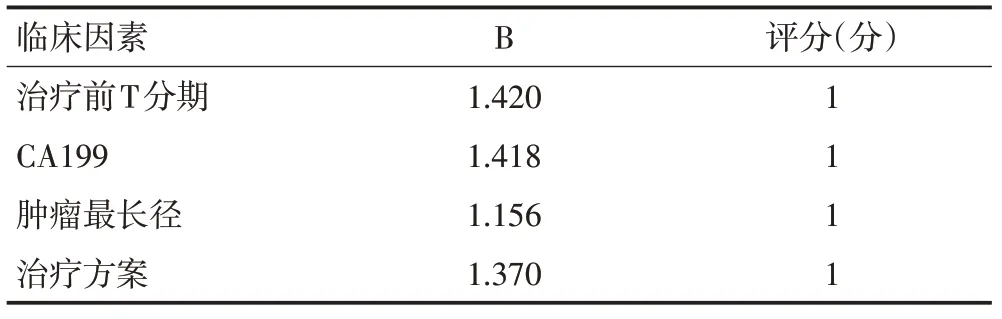
表3 进展期胃癌患者新辅助治疗后pCR影响因素评分表
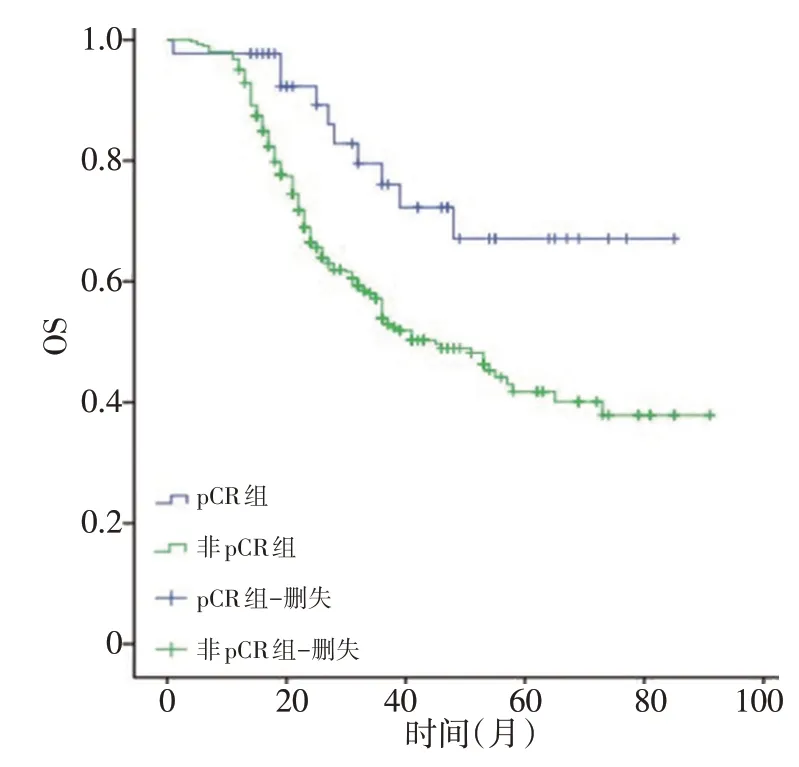
图2 两组患者的OS生存曲线
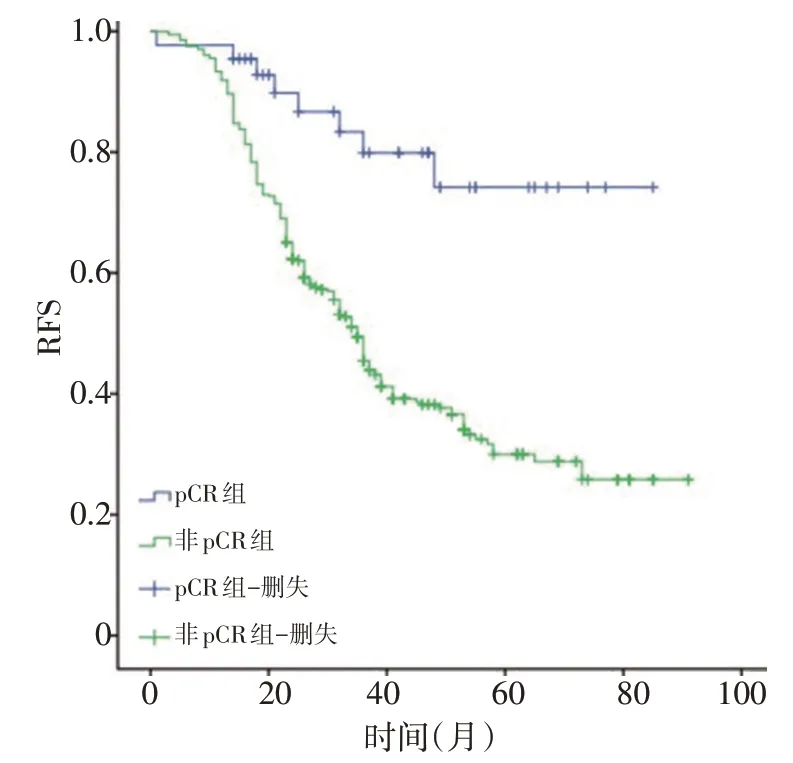
图3 两组患者的RFS生存曲线
3 讨论
随着新辅助化疗在临床中的普及和应用,R0 切除已经不再是难以达到的目标,然而即便获得R0 切除,仍然有相当比例的患者并未从中获得更大的生存获益。进一步发现相对于R0 切除,病理缓解率对进展期胃癌的预后改善似乎具有更大的意义[4-5]。
NeoFLOT试验[6]结果显示进展期胃癌应用FLOT方案新辅助化疗的pCR 率为20%。AIO 研究[7]中DCX 方案新辅助化疗的pCR 率为13.7%。FLOT4-AIO 研 究[8]中FLOT4 与ECF/ECX 的pCR率分别为16%和6%。POET研究[9]中新辅助同步放化疗的pCR率为14.3%。本研究的整体pCR率为9.7%,与既往临床研究的结果基本一致。通过既往的研究可以看出不同研究人群、不同研究方案所获得的pCR 率各不相同,因此本研究从不同人群中找到其个体化的治疗方案,以期达到更好的pCR率,针对不同人群给予不同方案的新辅助治疗,以寻找影响进展期胃癌新辅助治疗pCR率的临床因素。Becker等[4]对480例进展期胃癌患者的临床资料进行分析,发现年龄、性别与新辅助化疗疗效无关,肿瘤位于胃部上1/3以及肠型胃癌更易获得良好的疗效。另外有研究结果[10]显示,肿瘤体积及肿瘤分化程度与进展期胃癌新辅助治疗疗效密切相关。本研究结果显示患者性别、年龄、ECOG 评分、吸烟饮酒史、病理类型、Borrmann 分型、治疗前N分期、肿瘤部位HER-2表达及治疗期间严重不良反应发生情况均与化疗疗效并无显著关系,而治疗前T 分期、肿瘤最长径、治疗前CA199、治疗结束与手术时间间隔、治疗方案和局部进展期胃癌新辅助治疗后高pCR 率相关。由此可见,病灶越小、病期越早的患者易出现pCR,这与食管癌的根治性放疗理念相一致。欧洲一项关于食管-胃结合部癌同步放化疗后手术间隔时间对pCR 率及手术相关安全性的研究[11]中显示,3 091 例患者中有906 例(29%)获得pCR,提示pCR率主要与病理类型、手术、同步放化疗间隔时间长短和cT 分期有关,该研究发现腺癌、手术与同步放化疗间隔时间大于13周、cT分期较早的患者更容易出现高pCR 率。同时发现间隔时间在10~12 周和15 周以上组患者住院30 天的死亡率显著增高。本研究同样显示手术间隔时间较长会出现较高的pCR率,同样有研究[12-15]显示时间间隔超过6~8 周会获得更高的pCR 率,本研究显示间隔时间>6 周增加pCR 发生几率,与上述研究结果一致。这可能与肿瘤生物学特性、治疗对肿瘤细胞杀伤周期有关[13]。
不同治疗模式获得不同的pCR 率已在既往的临床研究中有所体现,同步放化疗联合或不联合靶向治疗的pCR率高于单纯化疗,铂类、氟尿嘧啶类联合紫杉醇类较不联合紫杉醇类更容易出现pCR,然而此类问题应个体化对待,如由于胃是空腔脏器及其容受舒张功能,导致饱腹与空腹时胃体与胃窦的位置变化较大,同步放化疗靶区勾画受到极大限制,故同步放化疗多应用于食管-胃结合部癌患者。亚洲与欧美人群身体素质存在一定差异,铂类、氟尿嘧啶类联合紫杉醇类的三药化疗方案在亚洲人群应尽可能选择年龄小、身体状况较好的患者,以期治疗后仍能较好的耐受手术。本研究从预后结果来看,pCR组患者不论在OS还是RFS上均较非pCR组患者有明显延长,由此可见,pCR 不仅是新辅助治疗短期疗效好的有效指标,也能较好地判断患者复发转移及生存。该结论与既往临床研究[15-16]相一致。
综上所述,治疗前病灶越小、浸润深度越浅、CA199 正常及接受复合治疗模式的进展期胃癌患者更加容易达到新辅助治疗后的pCR,同时需要灵活掌握、因人施策,真正的达到个体化治疗,让更多的患者在新辅助治疗过程中达到最大的获益。

