CSF-ctDNA与TIF-ctDNA检测在脑胶质瘤中的临床应用研究*
禹金良 盛致远 高玉帅 闫兆月 孙勇 步星耀
胶质瘤是颅内最常见的原发性恶性肿瘤,病死率高,易复发,经过外科精准手术联合放、化疗治疗后效果仍不理想[1]。随着近年肿瘤精准医疗的发展,肿瘤的治疗逐渐进入个体化精准诊疗时代,根据不同分子表型制定特定的治疗方案可提高治疗效果使患者获益。据报道[2]美国食品药品监督管理局(FDA)批准的许多分子靶向疗法在多种恶性肿瘤(乳腺癌、白血病、结肠直肠癌、肺癌和卵巢癌)的治疗中已有显著的临床疗效。对胶质瘤进行精准个体化治疗必须对其进行精准分子学分型。肿瘤发生和复发的过程,也是肿瘤基因组改变的动态过程[3],大多数肿瘤在放、化疗后会造成新的基因突变[4],导致肿瘤耐药,单次的组织分子病理信息不能代表肿瘤演变及基因组变化的过程,临床上更需要能够连续追踪胶质瘤基因组改变更有价值的诊断方法。近年研究脑脊液(cerebrospinal fluid,CSF)中发现了CSF-ctDNA,并可以追踪胶质瘤的演变[5],比来自血液循环的循环肿瘤DNA(circulating tumor DNA,ctDNA)更能代表肿瘤的基因改变[6],而且相对肿瘤组织学基因检测更全面、更有意义[7]。肿瘤间质液(tumor interstitial fluid,TIF)是浸润肿瘤和基质细胞(包括免疫细胞)的组织间液,潜在的生物标志物将以高浓度局部出现在TIF中,并最终在CSF 中被稀释,可靠地反映出局部肿瘤微环境TIF的使用,能够鉴定可用于疾病的早期检测和监测的物质[8]。目前国内外鲜见采用TIF-ctDNA检测辅助实体肿瘤诊疗的研究。本研究采用二代基因测序(next generation sequencing,NGS)技术,探讨CSF-ctDNA 与TIF-ctDNA 检测在脑胶质瘤中的诊断、复发监测、肿瘤标志物及靶向药物筛选等方面的应用价值。
1 材料与方法
1.1 病例资料
1.1.1 入组标准 选取2019年1月至12月河南省人民医院收治的12例胶质瘤患者。入组标准:年龄18~80岁,Karnofsky评分(KPS)≥60分;无肺、心、肝、肾等重要脏器功能障碍,血红蛋白(HGB)≥100 g/L,白细胞计数(WBC)>4×109/L,血小板计数(PLT)≥100×109/L;术后肿瘤全切,病理结果证实为脑胶质瘤;术后无颅内血肿、颅内感染等严重并发症;在本院接受替莫唑胺口服联合瘤腔局部化疗、术中置入Ommaya储液囊的患者。排除标准:曾接受血管表皮生长因子等靶向治疗;原发灶术前曾接受过化疗或免疫治疗;曾患其他系统恶性肿瘤。本研究获得患者知情同意,并签署书面知情同意书,且经过本院伦理委员会批准。
1.1.2 病例特征 本研究共收集12例脑胶质瘤患者的CSF与TIF配对标本。其中男性4例,女性8例;年龄15~65岁,平均年龄(48.1±13.9)岁。根据WHO中枢神经系统肿瘤分类,胶质母细胞瘤(WHOⅣ级)7例(58.3%),少突星形细胞瘤(WHOⅡ级)1例(8.3%),间变星形细胞瘤(WHOⅢ级)1例(8.3%),间变少突细胞瘤(WHOⅢ级)1例(8.3%),星形细胞瘤(WHOⅡ级)1例(8.3%),室管膜瘤(WHOⅡ级)1例(8.3%)。根据检测结果,1例少突星形细胞瘤与1例间变星形细胞瘤未在CSF中未发现ctDNA突变,1例室管膜瘤在对应标本中未检测到CSFctDNA与TIF-ctDNA阳性突变,其他患者均在对应标本中检测到ctDNA突变。
1.2 方法
1.2.1 治疗方案 术中采用多模态影像融合神经导航和功能定位检测技术,最大范围安全切除肿瘤组织,将Ommaya 储液囊植入,连接管端放置肿瘤残腔中,储液囊端固定于帽状腱膜下。依据中国中枢神经系统胶质瘤诊断与治疗指南(2015 版),对于低级别胶质瘤术后采用放疗(高危患者)联合替莫唑胺同步和辅助化疗;高级别胶质瘤在标准的STUPP 治疗方案基础上,瘤腔局部化疗。
1.2.2 标本获取 手术结束3 个月后开始收集患者CSF与TIF标本,于当月次化疗周期开始前1天收集,同时取患者CSF 标本8.0~12.0 mL、TIF 标本0.5~1.0 mL、血液标本5.0 mL,并存入-80°冰箱。血液标本取自周围静脉血。CSF 标本通过腰穿获取(图1)。TIF 标本获取(图2)操作步骤:剔除Ommaya 储液囊周围毛发,酒精纱布擦拭储液囊周围,除去油脂等杂质,碘伏消毒3 遍,消毒范围为储液囊周围3.0~5.0 cm;戴无菌手套固定穿刺点,用1.0 mL 注射器经皮穿刺Ommaya储液囊,缓慢抽出储液囊内或肿瘤残腔的液体0.5~1.0 mL,抽针,棉球按压止血2 min。
1.2.3 ctDNA的提取 所有临床收集的CSF样本、TIF样本及血液样本均使用NGS技术进行检测,CSF、TIF测序深度为20 000X,对照血液白细胞测序深度为250X。样本在EDTA管中用13 000 r/min离心机,离心10 min,沉淀颗粒-80℃冻存。而上清则以12 000 r/min离心机,离心10 min,TIF测序深度为20 000X,转移至超低温管-80℃保存。上清液采用MagMAXTMCellFree DNA分离试剂盒(Thermo Fisher Scientific,美国)提取cfDNA(cellfree DNA)。最后使用Qubit dsDNA HS分析试剂盒(Life Technologies,美国),Qubit 2.0荧光仪对所有分离的DNA进行量化分析。
1.2.4 基因文库的构建及测序 利用Covaris M220聚焦超声检测仪(Covaris,美国)将基因组DNA 剪切成150~200 bp 片段,采用KAPA Hyper 文库准备试剂盒(KK8504,Illumina 平台,美国)对ctDNA 进行文库构建,连接可供测序仪识别的接头序列,以及用于区分于不同样本的标签序列;使用SureSelectQXT Re⁃agent试剂盒(G96838,美国)进行文库的捕获,并富集目的片段,得到足量的测序文库,进行qRCR(实时荧光定量核酸扩增检测系统)检测确定有效浓度,按照测序数量比例混合为1 个pooling 文库运用NovaSeq 6000 S4 Reagent 试剂盒(300 cycles,Illumina 平台,美国)上机测序,获得下机数据进行生物信息学分析。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。使用秩和检验,以P<0.05为差异具有统计学意义。

图1 采用腰穿收集脑胶质瘤患者的CSF标本
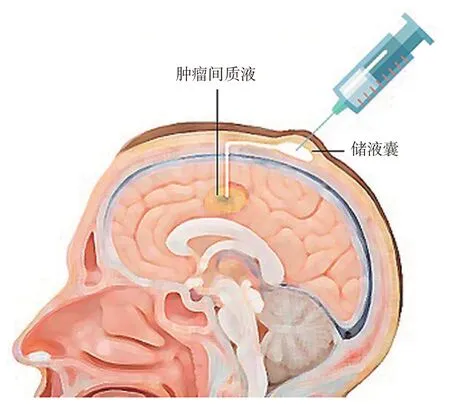
图2 经皮Ommaya储液囊穿刺获取患者的TIF标本
2 结果
2.1 基因检测结果
12例胶质瘤患者中共检测到57种不同类别的变异基因共209 个,样本总平均突变数为8.7 个,CSFctDNA 平均突变数为4.3 个,TIF-ctDNA 平均突变数为13 个。CSF-ctDNA 样本中3 例未检测出阳性结果,阳性率为75.0%(9 例);TIF-ctDNA 样本中1 例未检测出阳性结果,阳性率为91.6%(11 例)。TIF-ctD⁃NA中共检测到55种类型的基因突变,其中改变最频繁的基因TP53 5 例(41.6%),SETD2 5 例(41.6%),EGFR 4 例(33.3%),FAT1 4 例(33.3%),RELA 4 例(33.3%),DAXX 4 例(33.3%),IDH1 4 例(33.3%)。CSF-ctDNA 中检测到25 种类型的基因突变,其中改变最频繁的基因为TP53 5 例(41.6%),SETD2 5 例(41.6%),FAT1 4例(33.3%),EGFR 3例(25.0%),RE⁃LA 3 例(25.0%),IDH1 3 例(25.0%),NF1 3 例(25.0%),PTEN 3 例(25.0%)。两种方式均检测到胶质瘤中一些常见的基因突变,如KRAS、TP53、EGFR、IDH、ATRX、PTEN,均为胶质瘤的潜在肿瘤标志物。检测出IDH1突变的4个样本分别来自间变星形细胞瘤、间变少突细胞瘤、星形细胞瘤与高级别胶质瘤患者各1例。TP53突变的5个样本分别来自3例胶质母细胞瘤、间变少突细胞瘤与星形细胞瘤患者。检测出SETD2突变的5个样本来自4例胶质母细胞瘤与1例星形细胞瘤患者。EGFR突变的4个样本来自3例胶质母细胞瘤与1例星形细胞瘤患者。ATRX突变来自胶质母细胞瘤、间变少突细胞瘤与星形细胞瘤患者各1 例。BRAF 变异来自1 例胶质母细胞瘤患者。患者CSF与TIF样本基因突变频数见图3。
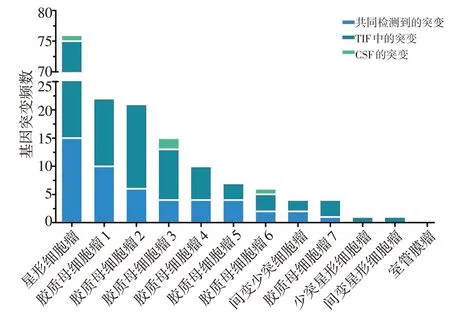
图3 12例胶质瘤患者的基因突变数
2.2 复发与生物信息学分析
本研究中5 例患者在检测后2~4 个月内影像学发现不同程度的肿瘤复发,患者ctDNA 检测发现TP53、EGFR 或SETD2 基因突变,较影像学发现复发时间平均提前2.9个月(图4)。经过生物信息学分析在57 种不同类别的基因变异中,突变基因PIK3CA、PTEN、KRAS、EGFR、TP53、NF1、BRCA1、BRCA2、TSC1、TSC2、IDH1、CDKN2A 匹配到靶向潜在获益药物,突变基因PIK3CA、KRAS、EGFR 匹配到潜在耐药药物(表1)。
图4 5例胶质瘤患者影像学表现

表1 突变基因靶向药物
2.3 标本ctDNA浓度
本研究CSF 与TIF 标本中,ctDNA 浓度有较大差异。来自同1例患者的ctDNA浓度TIF样本高于CSF样本,12 例患者的CSF 标本ctDNA 平均浓度为0.58 ng/μL,TIF 标本ctDNA 平均浓度为3.38 ng/μL,明显高于CSF标本中ctDNA平均浓度,对比有显著性差异(P=0.002)。CSF与TIF检测到的基因突变频率,测序深度均为20 000X,单CSF-ctDNA 检测到2 种突变类型,单TIF-ctDNA检测到32种突变类型,二者共同检测到23 种突变类型,TIF-ctDNA 检测到的基因类别、突变量均明显高于CSF-ctDNA(图5)。TIFctDNA 检测效力更高,相对CSF-ctDNA 检测阳性率高,能够提供更多、更全面的肿瘤基因组信息。
3 讨论
近年来随着精准医疗和分子生物学的飞速发展,对胶质瘤在临床中指导价值较大的某些基因被逐渐挖掘,如IDH、MGMT、EGFR、TERT等。然而由于肿瘤细胞的异质性导致脑胶质瘤原发灶和复发灶的肿瘤细胞基因表达存在不一致性,随着肿瘤的进展及放化疗的进行,肿瘤基因表达发生改变,突变基因不断发生变化,而脑胶质瘤进行精准靶向治疗,需要可以动态监测基因变化的方法。由于脑部位置特殊,手术风险大、费用高,对患者多次开颅活检操作,患者及家属多不能接受,在临床上限制性较大。游离于血液、脑脊液或组织间质液中的ctDNA是各个肿瘤组织脱落的混合体,取样方便、快捷、安全,能够在肿瘤进展过程中多次取样,可以克服肿瘤组织的空间异质性,ctDNA取代手术活检标本,为肿瘤诊断和突变分析提供了一种可靠方法[9]。由于血脑屏障的存在,导致血清中ctDNA的检出十分有限[6],血清ctDNA并不能提供脑肿瘤患者足够的遗传信息。前期多项研究数据表明,CSF-ctDNA相较于血清ctDNA具有更高的组织一致性[10-11]。有研究[6]利用大规模NGS测序技术比较12例脑肿瘤患者CSF和血浆中的特异性ctDNA,发现相比血清,IDH1(R132H)、TP53(R114C)、ANK2(K2337X)在CSF中被检出率更高,更能有效地反映肿瘤进展及其对治疗的反应。
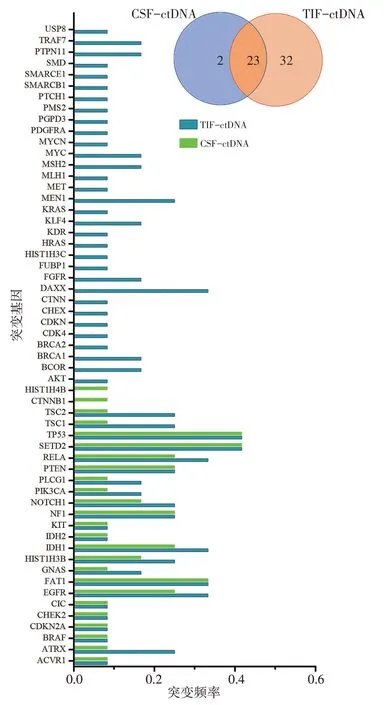
图6 CSF-ctDNA与TIF-ctDNA检测到的基因突变频率
CSF-ctDNA 研究有助于胶质瘤患者早期诊断、筛选靶向药物、早期检测肿瘤复发。Martínez-Ricarte等[12]研究分析来自癌症基因组图谱(TCGA)的2个肿瘤组(包括648 例弥漫性胶质瘤)的IDH1、IDH2、TP53、TERT、ATRX、H3F3A 和HIST1H3B 基因突变,对20 例胶质瘤患者的临床肿瘤标本及CSF 中此7 个基因进行的靶向外显子测序和微滴式数字PCR(ddP⁃CR)分析发现,CSF-ctDNA可对肿瘤进行准确的组织病理分型。Pentsova 等[13]使用MSK-IMPACT 技术在肺癌脑转患者的CSF中鉴定出多种耐药突变,如EG⁃FR T790M 等,为此类患者提供了靶药指导。本研究中,PIK3CA、PTEN、KRAS、EGFR、TP53等突变基因为患者匹配到靶向潜在获益药物;PIK3CA、KRAS、EG⁃FR 突变基因匹配到潜在耐药药物,对临床靶向治疗具有指导作用。目前的影像学技术只能待肿瘤增长至一定体积时做出复发判断,无法在肿瘤发生分子改变的早期做出复发诊断。ctDNA 检测可在影像学未发现复发时在分子水平发现肿瘤基因突变,本研究中ctDNA 在分子水平发现肿瘤复发较影像学发现复发早2.9个月。
虽然CSF-ctDNA 有助于胶质瘤的早期诊断、筛选靶向药物、早期检测肿瘤复发,然而肿瘤DNA脱落进入CSF并非是脑胶质瘤的普遍特征。游离DNA的数量和组成受许多因素影响,包括癌症的分期和解剖位置、肿瘤亚克隆的相对质量、生长速率、基质和炎性成分、肿瘤细胞死亡和坏死的程度。因此,CSF来源的ctDNA检测在临床应用上存在一定的局限性,无法检测到更多的突变基因,检测阳性率低,此与本研究结果相符。由于TIF 是直接来源于术后可能存在的残存肿瘤组织或者原位复发的肿瘤组织,TIF作为胶质瘤分子基因图谱检测的样本,不存在CSFctDNA 的空间分泌障碍和低级别胶质瘤的时空发展局限,能够更直接反映当下肿瘤的真实分子生物学背景信息。Yang等[14]通过从残留积液上清液中分离的cfDNA进行基于杂交捕获的NGS,评估了浆液腔液中cfDNA的分子特征和临床病理相关性,证明了从浆液腔液中分离的cfDNA 进行的液体活检能够为实体肿瘤基因分型提供新的来源。Panditharatna 等[15]分析了1例弥漫性中线胶质瘤患者死后的肿瘤囊肿液、CSF和肿瘤基因组DNA,发现囊液中含有大量的组蛋白突变体DNA,表明囊液中含有大量的肿瘤DNA。由于脑胶质瘤术腔间质液是直接浸透胶质瘤周围脑组织细胞的液体微环境,瘤周组织细胞通过细胞膜和间质液发生物质交换,而且肿瘤原发灶残存或复发坏死或凋亡的肿瘤细胞降解后的产物可直接释放进入间质液。因此,脑胶质瘤术腔间质液ctDNA可直接精准反映原发肿瘤原发灶残存、复发肿瘤基因变异或突变的特点,其绝对含量随着肿瘤负荷和治疗反应而发生敏感变化,其检测结果更具有代表性。本研究结果表明TIF-ctDNA 比CSF-ctDNA 样本中ctDNA 浓度更高,检测到的突变类型更多,检测阳性率更高,更能真实反映肿瘤复发过程中基因表达的变化。
综上所述,CSF-ctDNA、TIF-ctDNA 均可作为在胶质瘤发生和复发的过程中能够反复检测、筛选胶质瘤标志物的一种可靠检测方法,对胶质瘤患者基因诊断、早期检测复发、筛选肿瘤标志物及靶向治疗具有一定临床意义。而TIF-ctDNA 较CSF-ctDNA 检测获得样本ctDNA浓度更高,检测患者基因平均突变数与检测阳性率更高、检测效力更高,能够提供更多、更全面的肿瘤基因组信息,适合临床用于获取胶质瘤的基因表达信息。

