猪ACRBP 基因真核表达载体的构建及生殖系统表达验证
梁耀娣,陈 云,赵 坤,潘学情,张守全*
(1.华南农业大学动物科学学院,广东广州 510642;2.国家生猪种业工程技术研究中心,广东广州 510642;3.广东省农业动物基因组学与分子育种重点实验室,广东广州 510642)
顶体素结合蛋白(ACRBP)是顶体蛋白中的顶体素前体(proACR)和中间形式蛋白的特异性结合蛋白[1],该蛋白特异性地定位于小鼠、猪、种马和人的生殖细胞和精子细胞的顶体中[1-3]。研究表明,ACRBP 在精子发生和受精中起着不可缺少的作用,ACRBP 加工的改变或者异常会导致生育力下降、生育缺陷或者不育[4-6]。Kanemori 等[2]研究发现,缺失ACRBP基因的雄性哺乳动物精子细胞中的顶体结构在精子发生后期严重变形,精子发生异常弯曲运动,雄性生育能力严重下降。ACRBP 在受精过程中能促进精子的获能和前顶体素蛋白成熟[7],在顶体释放和精卵结合中起着至关重要的作用[8]。Vilagran 等[9]实验证明可通过分析公猪精子中ACRBP 含量来预测其抗冻能力,ACRBP 含量较高的有较高抵抗冻融过程的能力。Pinar 等[10]对公猪精子样本冷冻保存并解冻,发现精子活力下降,膜完整性变差,认为在冷冻-解冻过程中ACRBP 受到了破坏。Kim 等[1]发现种马在青春期前,通过免疫标记法未检测到生殖细胞中ACRBP 的存在,在青春期后的阶段以及在粗线期之后的生殖细胞中都观察到了ACRBP 的免疫标记,因此认为ACRBP 可用作种马有性成熟的指示剂[1]。
为了进一步研究猪ACRBP基因在猪的繁殖性能方面的影响作用,本实验构建猪源的ACRBP真核表达载体及检测猪精子精清及其他生殖器官中ACRBP的表达情况,为后续探究和揭示ACRBP 提高精子质量和精子冻融后精子活力等繁殖性能的作用机制奠定实验基础。
1 材料与方法
1.1 实验材料 质粒pIRES2-EGFP、中国仓鼠癌细胞(CHO)均由本实验室构建并保存。
1.2 主要试剂和试剂盒 2×TaqPlusMaster Mix、Phanta Max Super·Fidelity、2×Phanata Max Buffer、d NTP Mix(10 μmol/L)、10×DNA Loading Buffer、感受态细胞DH 5α均由Vazyme 公司提供;ACRBP引物由广州艾基生物技术有限公司合成;Tris、Na2EDTA· 2H2O、冰乙酸、DL 2000 DNA Marker、DL 15000 DNA Marker、EcoRI和BamHI 限制性核酸内切酶、10×K Buffer 缓冲液、T4 DNA 连接酶、缓冲液T4 DNA ligase Buffer 均由TaKaRa 公司提供;无内毒素质粒提取试剂盒、无内毒素质粒DNA 小量提取试剂盒、转染试剂Atractene Transfection Reagent;RND 提取试剂盒均由TIANGE公司提供;凝胶DNA 微量回收试剂盒由Omega 公司提供;0.25% 胰酶-EDTA 溶液、二甲基亚砜(DMSO)由Sigma 公司提供;全蛋白提取试剂盒由凯基生物公司生产;100× 双抗、PBS 溶液、DMEM(1640)液体培养基、FBS 由Gibco 公司提供:ACRBP抗体由Aviva Systems Biology 生产、鼠源β-actin 抗体由Affinity 公司生产、HRP Goat-Anti-Mouse IgG、HRP Goat-Anti-Rabbit IgG 由Vazyme 公司生产。
1.3 引物的设计与合成 在GenBank 获取此ACRBP基因序列,并按照ACRBP基因序列在Prime5 软件设计PCR 扩增引物和RT-PCR 引物,均由广州艾基生物技术有限公司合成,其引物上游序列:5'-CGGAATTCTTA GAGGCCGCTCGGTCC-3',下游序列:5'-CGGGATC CTGGGGTCCAACAGCAATGAA-3′。
1.4 猪睾丸组织RNA 提取与ACRBP扩增及鉴定 采集猪睾丸组织,按照Total RNA Kit II (200)提取试剂盒说明书进行RNA 提取后反转录,进行浓度检测。以睾丸cDNA 为模板进行温度梯度PCR 取最适退火温度,随后确定退火温度,抽提重组载体,以pIRES2-EGFPACRBP重组质粒为模板进行PCR 扩增,检测ACRBP基因。反应条件:95℃预变性3 min;95℃变性15 s,62℃退火15 s,72℃延伸1 min,35 个循环;72℃延伸5 min。
1.5 pIRES2-EGFP-ACRBP真核表达载体构建 通过琼脂糖凝胶回收目的基因片段,并纯化ACRBP基因PCR产物;用BamHI、EcoRI 分别对PCR 产物、pIRES2-EGFP 质粒进行双酶切,使目的片段与pIRES2-EGFP 质粒具有相同的粘性末端,反应条件是单独分开于37℃恒温水浴3 h。反应体系:1 μLEcoRI,1 μLBamHI,2 μL 10×K Buffer,1 μg cDNA/ 质粒,加入dd H2O 至20 μL。回收并纯化经过酶切的目的基因和质粒,进行连接。连接反应体系总共15 μL:0.8 μL T4 DNA ligase,1.5 μL 10 × T4 DNA ligase Buffer。反应条件:16℃,16 h。次日,将连接产物全部加入DH5α感受态细菌中,并置于氨苄抗性平板上,先正置于37℃培养箱中培养10 min,随后倒置培养过夜,次日挑取单个菌落接种于含有氨苄抗性LB 培养液的离心管中,将离心管放在37℃、150 r/min 的摇床震荡培养4 h,随后吸取适量菌液进行菌液PCR,将阳性管送至上海生工生物股份有限公司合成进行测序。
1.6 pIRES2-EGFP-ACRBP重组载体转染CHO 细胞 将测序鉴定正确的含重组质粒的菌液置于37℃,220 r/min摇床摇菌,待菌液浑浊,利用无内毒素质粒提取试剂盒,进行pIRES2-EGFP-ACRBP重组载体质粒抽提。复苏CHO 细胞,用0.25%的胰酶消化细胞并计数。24孔铺板时,细胞密度为1×105,加入含有10% FBS,不含抗生素的DMEM 1640 培养液,加入0.4 μg 用TE 缓冲液稀释好的无血清培养基中,至总体积60 μL;加入1.5 μL 转染试剂,轻轻混匀,离心10 s;室温下,孵育10~15 min;取出要转染的细胞,弃孔中的培养液,用PBS 洗涤2 次,加入含10%胎牛血清的完全培养液500 μL 每个孔;将包被体(60 μL+1.5 μL)加入孔中,轻轻摇到培养板混匀,放到37℃、5% CO2恒温培养箱中培养6~18 h,次日更换培养液。转染24~48 h 后,在绿色荧光显微镜下观察细胞荧光的表达情况。
1.7 细胞RNA 提取及合成cDNA 实验所用细胞株pIRES2-EGFP-ACRBP-CHO 由本实验构建,分别收集稳定转染pIRES2-EGFP-ACRBP-CHO 细胞和转染空质粒的单克隆细胞,按照逆转录试剂盒说明书进行RTPCR,用RNA 逆转录酶合成 cDNA 并检测其浓度。其反应体系共20 μL,首先进行1 μL Oligo dTPrimer(50 μmol/L)or Random 6 mers(50 μL),1 μL Dntp Mixture(10 mmol/L),根据浓度算出1 μg RNA 体积,最后加入RNase Free dH2O 至10 μL,反应条件及试剂使用根据试剂盒进行。
1.8 Western blot 检测ACRBP 蛋白的表达 提取公猪睾丸、附睾、前列腺、尿道球腺、精子、精清、性成熟母猪的卵巢和输卵管,同时提取pIRES2-EGFP-ACRBPCHO 细胞的蛋白及未转染的细胞蛋白进行对比,以未转染CHO 细胞作为阴性对照。根据全蛋白提取试剂盒说明书提取蛋白后,经过SDS-PAGE 凝胶后转印到PVDF 膜上,5%脱脂奶封闭1 h,兔抗猪ACRBP 中4℃过夜孵育,羊抗兔二抗IgG 孵育1 h。
2 结果
2.1 扩增目的基因最佳退火温度结果图 通过温度梯度PCR 方法找到最适合的以公猪的cDNA 为模板的ACRBP退火温度,在电泳结束后,在天能紫光分光仪中看到62℃中基因条带最亮(图1)。
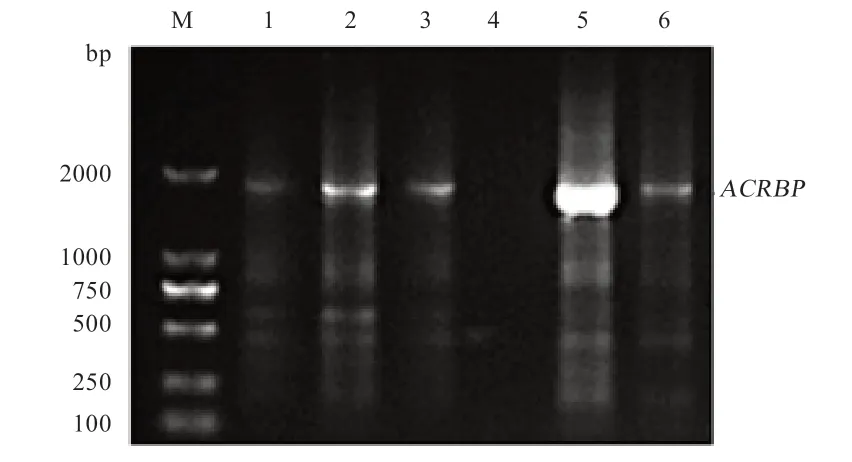
图1 猪源ACRBP 最适退火温度
2.2ACRBP基因的PCR 扩增结果图 利用PCR 技术从猪睾丸组织DNA 扩增出ACRBP基因,结果发现,在1 813 bp 左右出现与预期大小相符的特异性条带(图2)。
2.3 酶切重组质粒结果图 用EcoRI 和BamHI 双酶切重组pIRES2-EGFP-ACRBP质粒,产物经过电泳得到酶切后的基因片段其片段长度符合,条带单一并且较亮(图3)。
2.4 菌液PCR 检测筛选阳性菌液结果图 以经过酶切、连接、转化后得到的具有抗性基因的菌液为模板进行PCR,筛选阳性克隆,将含有亮带、符合长度和条带单一的菌液送到测序公司进行测序,图中1、2、3、4 各取200 μL 进行测序(图4)。经过上海生工生物股份有限公司,序列完全正确,结果证明ACRBP基因片段成功插入pIRES2-EGFP 表达载体中。
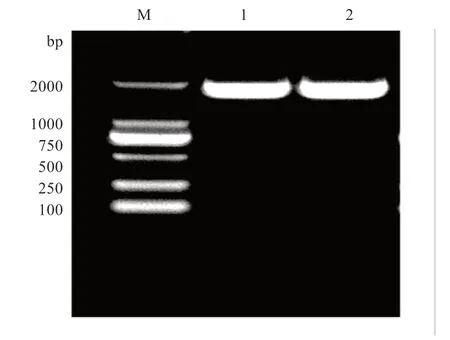
图2 ACRBP 基因PCR 结果

图3 EcoR I 和BamH I 双酶切pIRES2-EGFP 质粒电泳图

图4 菌液PCR 电泳图
2.5 真核表达载体PCR 鉴定结果图 将含有抗性的正确序列的菌液进行培养后,与抽提质粒后得到的重组载体质粒进行双酶切跑电泳、以抽提到的质粒为模板,用ACRBP引物进行PCR 扩增跑电泳鉴定,双酶切后得到ACRBP目的条带及体质粒条带,PCR 扩增得到ACRBP目的条带,说明ACRBP基因成功导入pIRES2-EGFP质粒中(图5)。
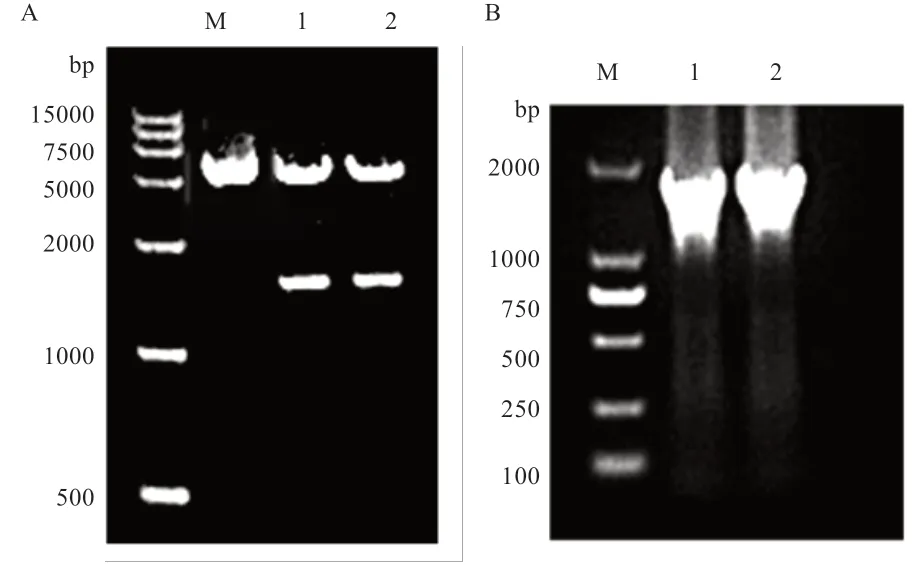
图5 pIRES2-EGFP-ACRBP 重组质粒酶切回收PCR 产物(A)电泳图和pIRES2-EGFP-ACRBP 重组质粒PCR 产物(B)电泳图
2.6 RT-PCR 阳性阴性对照结果图 从经过转染的CHO细胞中提取出RNA,经过反转录得到cDNA,经过PCR 可以得到最纯的ACRBP基因片段,将cDNA、重组载体质粒、转染空质粒的CHO 进行RT-PCR 及电泳,结果显示,cDNA 与质粒均有目的条带表现阳性,转染空质粒的CHO 表现为阴性,可以判断出ACRBP基因在癌细胞株中表达成功(图6)。

图6 RT-PCR 结果图
2.7 荧光检测重组质粒转染CHO 细胞结果图 抽提出来的pIRES2-EGFP-ACRBP质粒转染至CHO 细胞中,通过培养,观察荧光结果,初步认定抗性基因成功导入表达载体(图7)。
2.8 Western blot 检测pIRES2-EGFP-ACRBP在CHO 细胞中表达结果 以没有经过转染重组表达载体的CHO 细胞为对照组,检测到转染过重组质粒pIRES2-EGFP-ACRBP的CHO 细胞中在32 ku 处有条带,其大小与预期相符合,在未经过转染的阴性对照CHO 癌细胞在32 ku 大小处无条带,说明ACRBP基因在蛋白水平上表达(图8)。
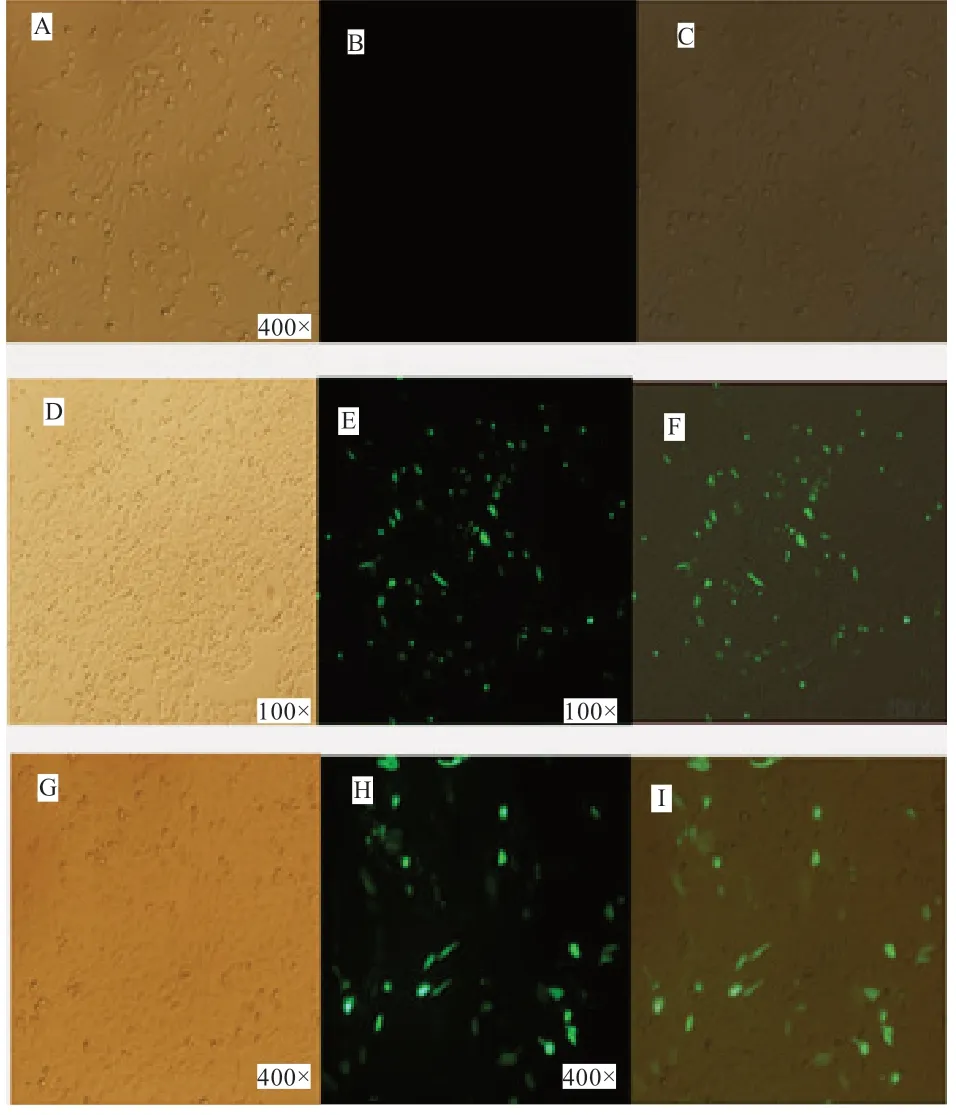
图7 转染CHO 细胞24 h 荧光结果

图8 Western blot 检测重组表达载体在CHO 中的表达结果
2.9 Western blot 检测ACRBP基因在猪的精子精清中表达情况图 从检测结果中看到,ACRBP 在精子中检测到有约32 ku 大小的条带,而在精清中却没有检测到(图9)。

图9 ACRBP 在精子精清中的表达结果图
2.10 Western blot 检测ACRBP在猪生殖器生殖器官中表达结果图 公猪的睾丸、附睾尾、前列腺、尿道球腺、输精管、性成熟母猪的卵巢和输卵管在分子量约为60 ku处有条带(图10)。
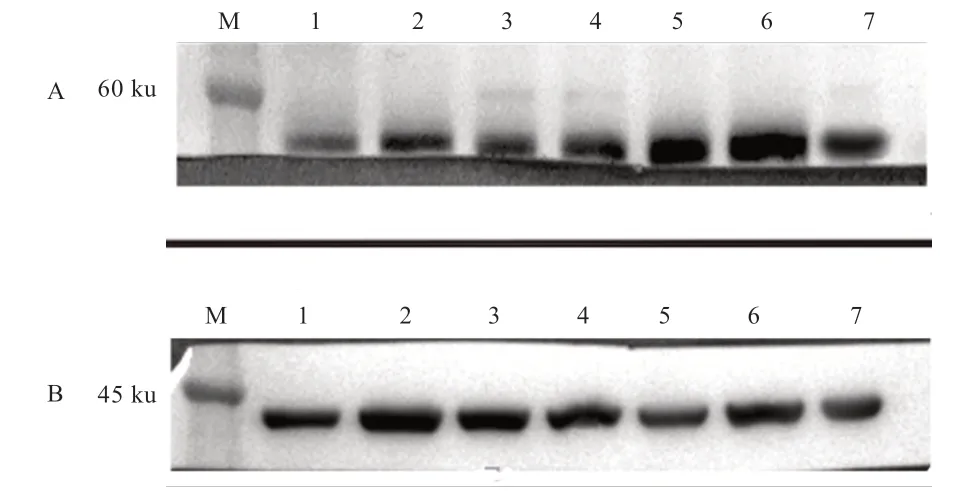
图10 Western blot 检测ACRBP 在猪的生殖组织细胞中的表达结果图
3 讨 论
3.1 ACRBP 蛋白在公猪精子精清中表达情况 1989 年,Baba 等[3]从猪射出来的精子中提取分离纯化出了32 ku的ACRBP,因此又称它为sp32,并分离和鉴定了为sp32中间体的55、53、49 ku 大小形式的特异性结合蛋白。Baba 等[11]认为sp32 最初是由1 个61 ku 前体蛋白和1个假定的信号肽在氨基末端合成的。也有研究者表明,哺乳动物ACRBP 最初在生精细胞粗线期被合成为1 个约60 ku 前体蛋白(ACRBP-w),在精子发生过程中,通过去除前体ACRBP-w 的N 端产生大小为32 ku 的成熟形式ACRBP(ACRBP-c)[12]。本实验检测到精子在32 ku 大小处有条带,这与Baba 等[11]的实验结果一致,但与之对精液检测不同的是本实验对精子精清进行分离,并分开检测精子精清中ACRBP 蛋白表达情况,发现精清中并没有ACRBP 的表达,这为以后研究精子受精蛋白奠定了基础。
3.2 ACRBP 蛋白在猪生殖器生殖器官中表达情况 Baba等[11]发现猪的sp32 及其前体的mRNA 仅仅在睾丸组织中有所表达,而在其他正常的组织不表达。后来研究表明精子蛋白sp32 广泛地存在于各种正常组织中,表达量因组织不同而异,具有限制性表达于正常组织中,而其他异常组织的表达量也相对于正常组织高,选择性地高表达于肿瘤组织的癌-睾丸抗原[13-15]。本实验结果表明,猪的ACRBP 前体除了在公猪睾丸中有所表达,在猪的附睾尾、前列腺、尿道球腺、输精管、性成熟母猪的卵巢、输卵管中在蛋白水平上有表达。
3.3 pIRES2-EGFP-ACRBP真核表达载体成功构建 本实验采用了在细菌和哺乳动物细胞中均能够稳定存在和自我复制,且具有多克隆位点和Neo 基因的pIRES2-EGFP 质粒作为表达载体,连接构建了pIRES2-EGFPACRBP真核表达载体、序列检测、酶切重组质粒检测、荧光检测、RT-PCR、Western blot 检测,验证了所需要的目的基因片段正确克隆并插入了表达载体中,鉴定了阳性的pIRES2-EGFP-ACRBP重组质粒表达的现象与理论符合。
4 结 论
综上所述,本实验利用真核表达系统成功表达了猪源的重组ACRBP,并可得出ACRBP在猪的精子中有所表达,而在猪的精液中没有表达,同时得出了ACRBP前体除了在公猪睾丸中有所表达,在猪的附睾尾、前列腺、尿道球腺、输精管、性成熟母猪的卵巢、输卵管中在蛋白水平上有表达。
——一道江苏高考题的奥秘解读和拓展

