金花茶叶皂苷提取工艺优化及抑制脂肪酶活性研究
陈嘉慧 - 吴雪辉 -
(华南农业大学,广东 广州 510000)
金花茶(CamellianitidissimaChi)是山茶科山茶属金花茶组植物,主要分布于中国广西、广东和越南北部,是茶花家族中唯一花瓣为金黄色的珍稀物种[1],2010年被批准为国家新资源食品[2]。
金花茶叶富含皂苷、黄酮、多酚、多糖、氨基酸等多种生物活性成分,具有提高免疫力、降血脂血糖、抗癌防癌等重要保健功能[3]。广西壮族民间有饮用金花茶叶片习惯[4],当地许多资料亦有记载“金花茶叶为壮族民间药,具有清热解毒,降低胆固醇、预防肿瘤等功效”[5-6]。目前,对金花茶叶中黄酮、多酚、多糖的提取及抗氧化作用研究较多[7-9],但未见对皂苷的提取和抑制脂肪酶的效果研究报道。据前人[10]研究报道,植物皂苷能有效抑制脂肪酶的活性,可以升高血清中高密度脂蛋白含量,降低胆固醇、甘油三酯以及低密度脂蛋白含量,对高血脂症、心脑血管疾病以及动脉粥样硬化的治疗具有明显效果。研究拟采用乙醇提取金花茶中的皂苷,探讨其对胰脂肪酶的抑制作用,以期为金花茶叶资源的开发利用提供理论依据和参考数据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
金花茶叶:摘自广东省佛山市林业科学研究所金花茶示范林,经佛山市林业科学研究所薛克娜教授级高级工程师鉴定为山茶科山茶属植物金花茶的叶,选取无病虫害,无腐烂、枯萎的金花茶叶于50 ℃烘干48 h后粉碎备用;
月桂酸4-硝基苯酯:>98.0%,上海麦克林生化科技有限公司;
人参皂苷Rg1:>98.0%,北京索莱宝科技有限公司;
猪胰脂肪酶:CAS#9001-62-1,上海源叶生物科技有限公司;
醋酸钠、磷酸二氢钠、磷酸氢二钠、香草醛:分析纯,天津大茂化学试剂厂;
硫酸:分析纯,广州化学试剂厂;
乙醇、冰醋酸:分析纯,天津市富宇精细化工有限公司。
1.1.2 主要仪器设备
多功能粉碎机:BJ-150型,德清拜杰电器有限公司;
分析天平:CPA225D型,德国赛多利斯集团;
循环式真空泵:SHB-Ⅲ型,郑州世纪双科实验仪器有限公司;
旋转蒸发仪:RE-52AA型,上海荣亚生化仪器厂;
紫外可见分光光度计:UV-5200型,上海元析仪器有限公司;
电热鼓风干燥箱:101-2A型,天津市泰斯特仪器有限公司。
1.2 方法
1.2.1 金花茶叶皂苷的提取单因素试验设计 称取一定量的金花茶叶粉末,加入适量的乙醇溶液,在适宜的温度下提取一定的时间,经过滤或离心分离,收集提取液,测定其皂苷含量。
(1) 乙醇体积分数:适宜的金花茶叶粉末,分别用体积分数0%,20%,40%,60%,80%,100%的乙醇溶液,按照料液比1∶50 (g/mL),于70 ℃提取100 min。
(2) 料液比:在提取温度70 ℃下,用体积分数60%的乙醇溶液分别按照料液比1∶20,1∶30,1∶40,1∶50,1∶60 (g/mL)提取100 min。
(3) 提取温度:金花茶叶粉末用体积分数60%的乙醇溶液,在料液比1∶40 (g/mL)下,分别于50,60,70,80,90 ℃提取100 min。
(4) 提取时间:一定量的金花茶叶粉末按照料液比1∶40 (g/mL)加入体积分数60%的乙醇溶液,在70 ℃下分别提取60,80,100,120,140 min。
1.2.2 响应面设计 在单因素试验的基础上,选取乙醇体积分数、料液比、提取温度以及提取时间,以皂苷得率为评价指标进行四因素三水平中心组合试验。
1.2.3 皂苷得率的测定 采用香草醛—硫酸分光光度法[11],以人参皂苷Rg1为标样进行测定。准确称取0.005 4 g 人参皂苷Rg1标准品,溶解于纯净水中,配制成质量分数为0.216 mg/mL的标准溶液,精确移取0.0,0.1,0.2,0.4,0.5,0.7 mL标准溶液于比色管中,蒸干后加入8%香草醛—冰醋酸溶液0.5 mL、72%硫酸溶液5 mL,充分摇匀后于60 ℃恒温水浴10 min,随后立即用冰水冷却10 min,摇匀,于540 nm处测吸光度。以人参皂苷Rg1吸光度为纵坐标(Y),标准品质量为横坐标(X,mg)绘制标准曲线如图1,用最小二乘法作线性回归,得到的方程为:Y=6.7X+0.006 2,相关系数R2=0.999。提取的金花茶叶皂苷溶液按照标准曲线的制作方法,测定吸光度,由回归方程计算出皂苷含量,并按式(1)计算金花茶叶皂苷得率。
(1)
式中:
R——皂苷得率,%;
m——提取液中皂苷含量,mg;
M——样品质量,g。
1.2.4 胰脂肪酶活性抑制率的测定 参照赵瑜等[12-14]的方法。取3 mL磷酸盐缓冲溶液和0.08%月桂酸4-硝基苯酯溶液、1.0 mg/mL胰脂肪酶溶液、金花茶叶皂苷溶液各0.5 mL混合均匀,在适宜温度下恒温水浴一定时间后于410 nm处测吸光度为A。同时以不加皂苷溶液在410 nm处的吸光值为A1,加皂苷溶液,不加胰脂肪酶溶液在410 nm处的吸光值为A0。按式(2)计算胰脂肪酶抑制率。
(2)
式中:
C——抑制率,%;
A——样品组吸光度值;
A1——空白组吸光度值;
A0——对照组吸光度值。
1.2.5 缓冲液pH对金花茶叶皂苷抑制胰脂肪酶能力的影响 按1.2.4的方法,分别取pH 6.0,6.5,7.0,7.5,8.0磷酸盐缓冲溶液与1 mg/mL胰脂肪酶溶液、0.08%月桂酸4-硝基苯酯溶液和2 mg/mL金花茶叶皂苷溶液混合均匀,于37 ℃水浴30 min,测定胰脂肪酶的抑制率。
1.2.6 反应温度对金花茶叶皂苷抑制胰脂肪酶能力的影响 按1.2.4的方法,取pH 7.5的磷酸盐缓冲溶液与1 mg/mL 胰脂肪酶溶液、0.08%月桂酸4-硝基苯酯溶液和2 mg/mL金花茶叶皂苷溶液混合,分别于27,32,37,42,47 ℃水浴30 min,测定胰脂肪酶的抑制率。
1.2.7 反应时间对金花茶叶皂苷抑制胰脂肪酶能力的影响 按1.2.4的方法,取pH 7.5的磷酸盐缓冲溶液与1 mg/mL 胰脂肪酶溶液、0.08%月桂酸4-硝基苯酯溶液和4 mg/mL金花茶叶皂苷溶液混合,分别于37 ℃水浴20,30,40,50,60 min,测定胰脂肪酶的抑制率。
1.2.8 金花茶叶皂苷浓度对胰脂肪酶抑制率的影响 按1.2.4的方法,分别取1,2,3,4,5,6 mg/mL金花茶叶皂苷溶液与pH 7.5的磷酸盐缓冲溶液、1 mg/mL胰脂肪酶溶液、0.08%月桂酸4-硝基苯酯溶液混合,于37 ℃水浴30 min,测定胰脂肪酶的抑制率。
2 结果与讨论
2.1 单因素试验
2.1.1 乙醇体积分数对金花茶叶皂苷得率的影响 由图2 可以看出,随着乙醇体积分数的变大,皂苷得率呈先上升后下降趋势,当体积分数为60%时,皂苷得率最大。这是因为乙醇浓度过小时,体系中的溶剂极性较小利于亲水性的蛋白质、多糖等物质溶出,直到溶剂极性与皂苷极性相似时达到最大得率,而乙醇浓度过大时,乙醇会使蛋白质变性凝固,阻止溶剂进入金花茶叶细胞内,影响皂苷的溶出[15]27-28。因此选择60%为最佳乙醇体积分数。
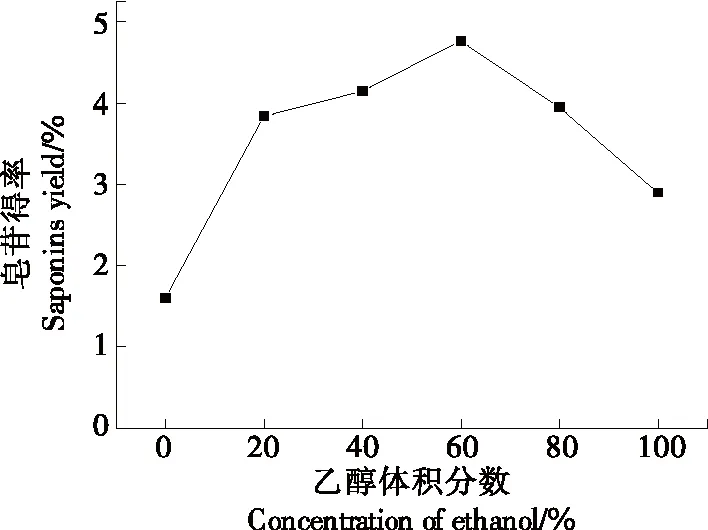
图2 乙醇体积分数对金花茶叶皂苷得率的影响
2.1.2 料液比对金花茶叶皂苷得率的影响 如图3所示,随着料液比的增加得率呈先上升后下降趋势,当料液比在1∶40 (g/mL)时得率达到最大值。金花茶叶皂苷的提取属于固液提取,浓度差是提取动力,因为随着原料与乙醇溶液的接触面积增大,金花茶叶粉末与溶剂充分接触,物料与溶剂间浓度差增大,皂苷的传质速率加快,促进皂苷的溶出,但料液比大于1∶40 (g/mL)时,溶剂的量太大,不利于溶剂与溶质之间充分循环交换[15]26-27。考虑原料的充分利用、生产成本和能耗,料液比选1∶40 (g/mL)为适宜。

图3 料液比对金花茶叶皂苷得率的影响
2.1.3 提取温度对金花茶叶皂苷得率的影响 由图4可知,随着温度的升高,得率先上升后下降,提取温度在70 ℃时,金花茶叶皂苷得率达到最大值,因为随着温度升高,分子扩散运动加快,有助于皂苷的溶出。但是温度超过70 ℃时,温度过高,蒸气压上升[15]25-26,乙醇蒸发加快而冷凝不充分,导致提取瓶中乙醇浓度减少;甚至皂苷结构上含有—COOH和—OH,其在溶液中呈自然弱酸性,在温度较高和含有醇溶液条件下会发生催化水解反应,水解后生成的皂苷元极性低,只可以溶于低极性溶剂,从而导致皂苷得率降低,这一结果与张正茂等[16]报道相似。因此70 ℃为最佳提取温度。
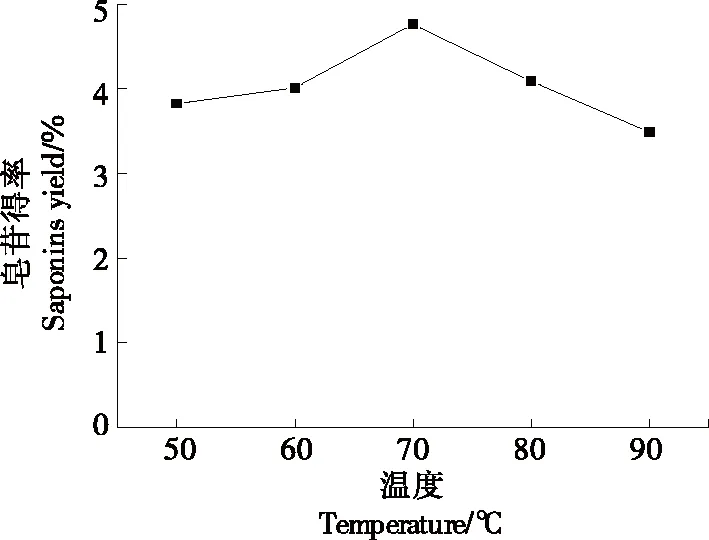
图4 取温度对金花茶叶皂苷得率的影响
2.1.4 提取时间对金花茶叶皂苷得率的影响 由图5可以看出,随着时间的延长皂苷得率先增加再下降,超过120 min后皂苷得率下降。因为随着时间的延长,皂苷的溶出率增加,但到达一定程度后,随着提取时间的延长,杂质溶出,导致扩散系数降低,增大传质阻力,阻止皂苷的溶出[17-18],影响金花茶叶皂苷得率,所以选取提取时间为120 min为适宜。
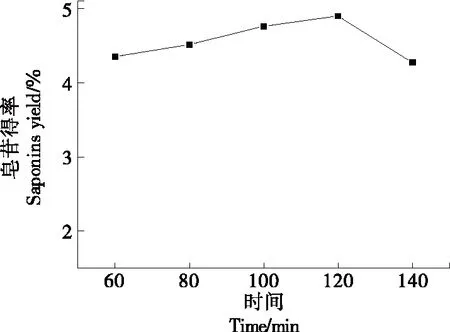
图5 提取时间对金花茶叶皂苷得率的影响
2.2 响应面优化与分析
2.2.1 响应面优化 以乙醇体积分数、料液比、提取温度和提取时间为影响因素(见表1),根据Box-Behnken原理设计四因素三水平中心组合试验,试验结果见表2。
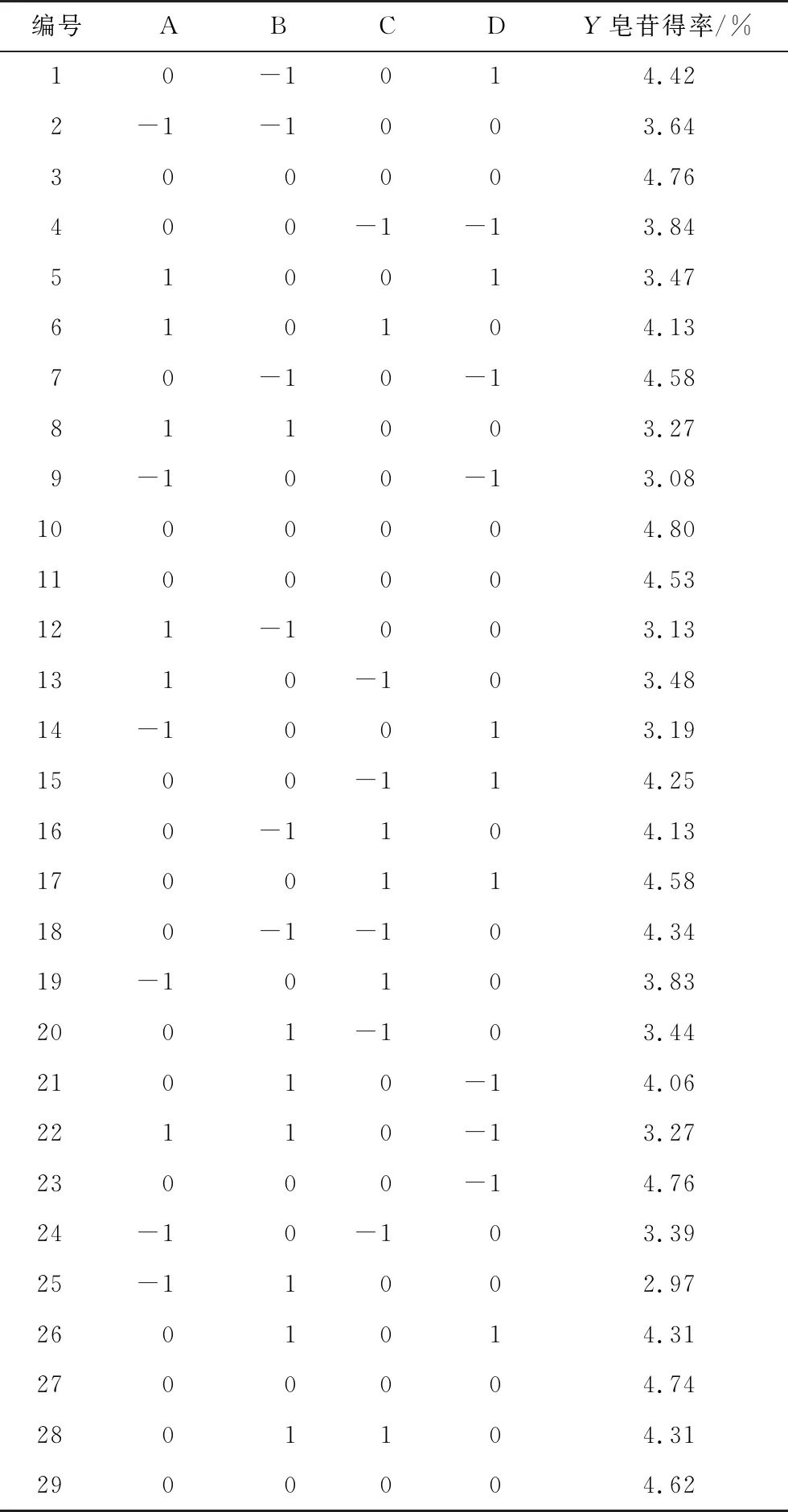
表2 响应面试验设计结果

表1 响应面试验因素与水平表
采用Design-Expert 8.0.6软件对响应面试验结果进行回归拟合分析,从模型中删除不显著变量,优化得到响应面方程为:
Y=4.61+0.17B-0.25C+0.27BC-1.03A2-0.31B2-0.18D2。
(3)
由表3可知,回归模型显著(P<0.000 1),失拟项不显著(P>0.05),R2=0.928 6,CV=5.6%,说明置信度较好,表明该回归模型值与试验值拟合较好,误差较小,能较好地反映影响因素与皂苷得率之间的关系,可解释92.86%的响应值,因此可以用该模型对金花茶叶皂苷的得率进行分析和预测。各因素对皂苷得率的影响大小为提取温度>料液比>乙醇体积分数>提取时间。一次项C及二次项A2、B2对皂苷得率影响极显著(P<0.01),一次项B、交互项BC与二次项D2对皂苷得率影响显著(P<0.05)。

表3 回归模型方差分析和系数显著性检验†
2.2.2 响应面分析 各个因变量之间的交互作用对响应值——皂苷得率的响应面三维图见图6,其中料液比和提取温度的交互作用响应面曲面坡度陡峭,说明对金花茶叶皂苷得率影响显著。利用已建立的数学模型优化出最优条件为乙醇体积分数58.71%、料液比1∶38.69 (g/mL)、提取温度60 ℃、提取时间123.94 min,考虑实际操作,修正工艺条件为乙醇体积分数59%、料液比1∶39 (g/mL)、提取温度60 ℃、提取时间124 min,此条件下的金花茶叶皂苷含量为4.82%,与理论预测值4.838%相差较小,说明该模型可行,优化结果可靠。
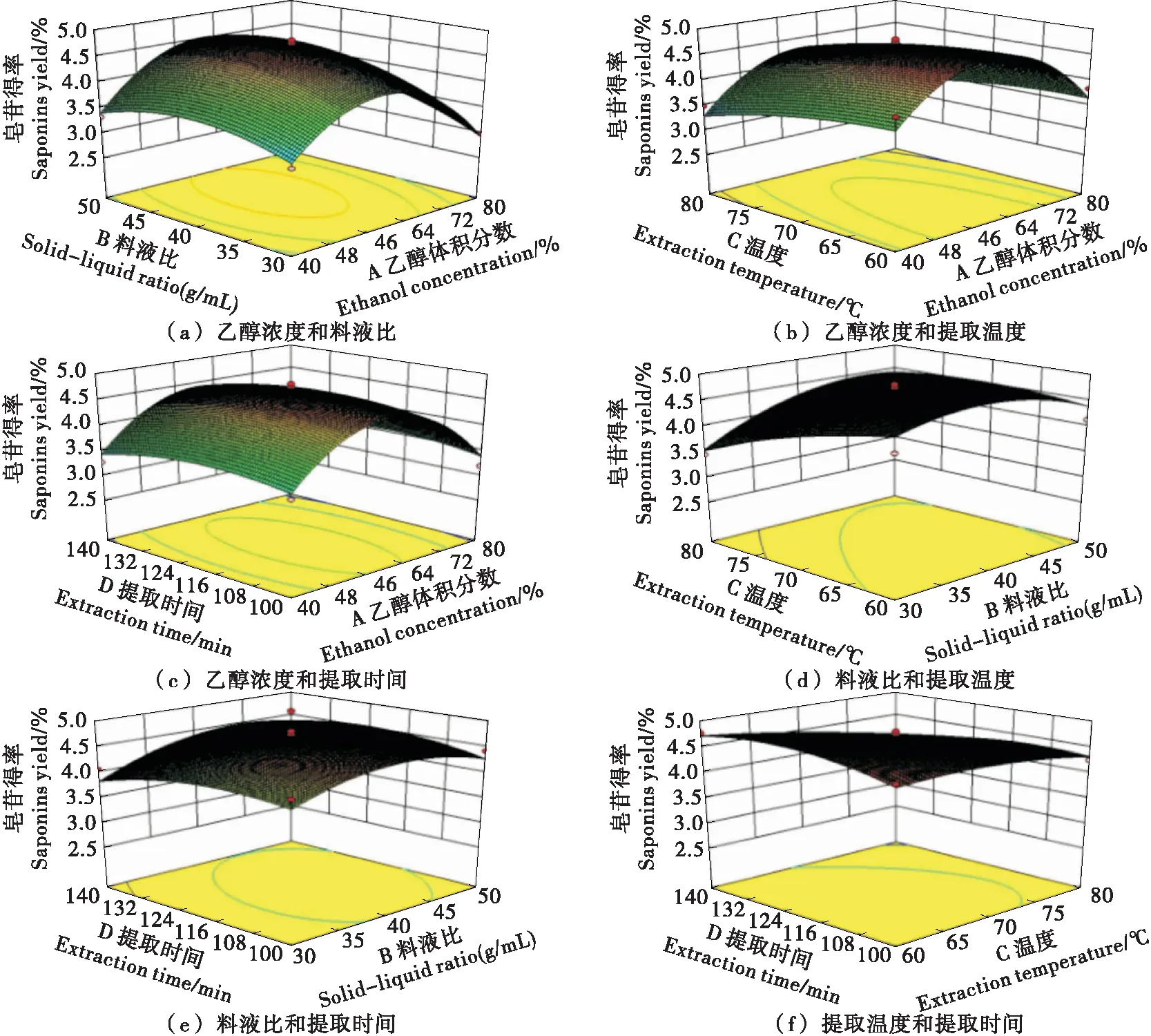
图6 各因素对皂苷得率的交互作用
2.3 金花茶叶皂苷体外抑制胰脂肪酶能力
2.3.1 缓冲液pH对金花茶叶皂苷抑制胰脂肪酶能力的影响 从图7可以直观看出,随着pH的增大,金花茶叶皂苷对胰脂肪酶抑制率先增加后趋于平缓;在缓冲液pH为7.5时对胰脂肪酶抑制率有最佳效果,为52.44%。因为pH可以改变胰脂肪酶分子结构,在最适pH条件下,胰脂肪酶分子活性基团部位与最适底物结合,发挥出胰脂肪酶的最佳催化效果,pH偏高或偏低环境下,会改变胰脂肪酶分子的二级、三级构象,影响酶与底物结合效率,从而影响胰脂肪酶的活性,改变胰脂肪酶的抑制率[19],所以选取pH 7.5为胰脂肪酶的最适pH。
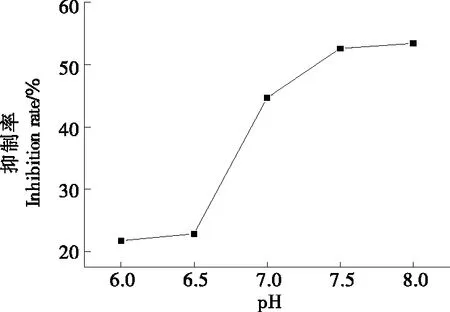
图7 缓冲液pH对胰脂肪酶抑制率的影响
2.3.2 反应温度对金花茶叶皂苷抑制胰脂肪酶能力的影响 由图8可知,抑制率随着温度的升高先上升后下降,当温度为37 ℃时对胰脂肪酶有最佳抑制作用,抑制率为51.28%。动物来源的酶的最适温度一般为35~40 ℃,温度若高于最适温度,会破坏酶分子的构象[20],此时酶的整体三维结构受到破坏,次级键崩解,酶失去活性,从而降低胰脂肪酶的抑制率。因此选取温度37 ℃为胰脂肪酶最佳反应温度。

图8 反应温度对胰脂肪酶抑制率的影响
2.3.3 反应时间对金花茶皂苷抑制胰脂肪酶能力的影响
从图9可以看出,反应时间为20~40 min时,胰脂肪酶的抑制率随着时间的递增先上升后趋于平缓;40 min 后,胰脂肪酶的抑制率随着时间的递增呈下降趋势。当皂苷与胰脂肪酶刚混合时,由于两者结合不充分,抑制率较低,随着时间的增加,二者结合逐渐充分,有效接触增多,抑制率上升,反应时间>30 min时,金花茶叶皂苷与胰脂肪酶之间有效基团已充分接触反应,相互作用趋于饱和,导致两者的浓度减小,二者结合速率降低,反应时间进一步延长,胰脂肪酶的抑制率呈下降趋势[21],所以30 min为胰脂肪酶的最佳反应时间。
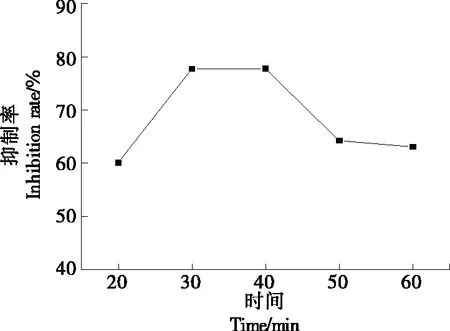
图9 反应时间对胰脂肪酶抑制率的影响
2.3.4 金花茶叶皂苷浓度对胰脂肪酶抑制率的影响 由图10可知,金花茶叶皂苷浓度为1~6 mg/mL时,胰脂肪酶的抑制率随着金花茶叶皂苷浓度的增加呈两个阶段上升趋势;1~4 mg/mL时,胰脂肪酶结合位点未饱和,胰脂肪酶的抑制率急剧升高;4~6 mg/mL时,胰脂肪酶和金花茶叶皂苷两者充分相互接触,结合位点达到饱和,故抑制率增加缓慢。皂苷浓度为6 mg/mL时,对胰脂肪酶的抑制率达到最大值为84.76%。
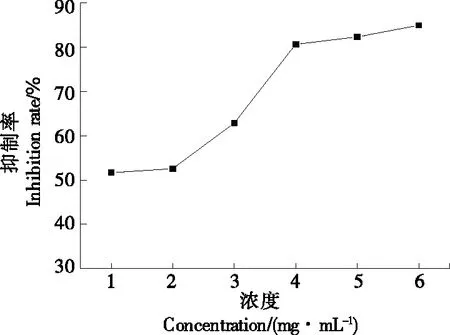
图10 皂苷浓度对胰脂肪酶抑制率的影响
3 结论
通过单因素试验,选择适合的因素水平进行响应面优化,研究了金花茶叶提取皂苷的最佳工艺条件,并对金花茶叶提取的皂苷进行抑制脂肪酶活性研究。试验结果表明,金花茶叶皂苷最佳提取条件为乙醇体积分数59%、料液比1∶39 (g/mL)、提取温度60 ℃、提取时间124 min,此条件下的金花茶叶皂苷得率为4.82%;金花茶叶提取的皂苷对胰脂肪酶的抑制试验表明,皂苷提取物在37 ℃、质量浓度在6 mg/mL、pH 7.5、反应30 min下,脂肪酶抑制率达到84.76%;并且金花茶叶皂苷浓度与胰脂肪酶的抑制作用呈剂量效应,浓度越高,抑制效果越佳,说明金花茶叶皂苷是一种良好的胰脂肪酶抑制剂,具有较好的降血脂应用前景。后续可以利用现代分析方法深入研究金花茶叶皂苷对胰脂肪酶的抑制机理。

