石骨症特异诱导多能干细胞的建立及其功能研究
吴爱国,何丛馨,杨少军,李岚,余国伟
中信惠州医院骨科,广东 惠州 516006
石骨症(osteopetrosis)是一类以破骨细胞活性异常、骨吸收缺陷和骨硬化等骨代谢异常为特征的遗传性疾病。根据遗传方式的不同可以分为常染色体显性遗传石骨症、常染色体隐性遗传石骨症和X连锁石骨症[1]。常染色体显性遗传骨硬化症2 型(autosomal dominant osteopetrosis type Ⅱ,ADO2)是我国临床上最常见的石骨症亚型,多见于成人,又称为成年型石骨症。氯离子第7 通道蛋白(chloride channel 7,CLCN7)基因突变是导致ADO2 的主要原因之一。有研究证实,CLCN7杂合突变导致显性遗传石骨症的过程中存在明显的骨吸收障碍,引起破骨细胞数目增加,但是不少细胞不能形成功能完整的褶皱缘[2]。CLCN7的基因产物为破骨细胞褶皱缘上的氯离子通道蛋白,该基因杂合突变引起部分破骨细胞氯离子通道功能的缺陷,从而影响骨吸收酸性微环境的生成,进而可能导致破骨细胞发育过程中的一系列调控网络异常[3]。为了明确携带CLCN7 杂合突变的ADO2 患者破骨细胞发育异常过程中涉及的信号通路及信号分子,COUDERT 等[4]把ADO2 患者和对照者外周血单个核细胞诱导培养成为破骨细胞,利用基因表达谱芯片技术分析发现了两者之间存在多达182个基因差异表达,该结果在mRNA水平和蛋白水平均得到验证证实;此外,他们在对照者破骨细胞诱导培养过程中转染携带CLCN7突变的载体,发现其结果与携带CLCN7 杂合突变的ADO2患者破骨细胞类似。目前,国内外尚缺乏石骨症相关细胞及动物模型。研究表明,来源于人类疾病患者的诱导多能干细胞(induced pluripotent stem cells,iPSCs)具有细胞疾病模型作用[5]。因此,本研究利用石骨症患者尿液肾管状细胞建立ADO2特异性多能干细胞(ADO2-iPSCs),探索基因突变对氯离子通道相关通路的影响,为骨代谢异常疾病的临床诊治提供依据。
1 资料与方法
1.1 一般资料 选择2017 年10 月至2019 年10月在中信惠州医院确诊为ADO2 且CLCN7 基因突变的患者10 例作为实验组,其中男性6例,女性4 例;年龄25~78岁,平均(48.67±5.46)岁。同时将10例性别年龄等基本条件与选取的ADO2患者相匹配的正常健康者作为对照组。本研究经医院医学伦理委员会批准,所有受试者和对照者均知情并签署同意书。
1.2 iPSCs细胞的构建及鉴定
1.2.1 体细胞的准备 室温采集两组受试者的无菌清晨中段尿,于6 h内进行离心分离,获得尿液细胞,进行原代细胞培养。
1.2.2 诱导多能干细胞的建立 ①病毒包装和感染:包装逆转录病毒感染尿脱落细胞293T分盘培养后,第2 天进行磷酸钙转染法质粒转染。第4 天将体细胞培养基替换为新鲜培养基后加入病毒上清,Oct4、Sox2、Klf4 和c-Myc 四种病毒;另选一孔体细胞只加入2 mL pMX-GFP 病毒,作为感染对照,测试病毒感染效率。感染过夜后换新鲜体细胞培养基。第5天进行第二次转染。②感染后细胞的接种和培养:感染后细胞接种饲养层细胞病毒感染后第2 天,将培养基更换为DFBS 培养基;第5 天复苏饲养层细胞到100 mm盘;第6天感染后的体细胞用胰酶消化后计数,接种到饲养层细胞上。此时细胞培养基为DFBS+Vc+VPA,培养基每天更换。VPN 处理8~10 d 后撤去,第18 天将培养基换为KSR 培养基。③克隆的选取和维护:扩大复苏饲养层细胞到12孔板,第2天换为KSR培养基;病毒感染后第22~30天,镜下选择形态与人胚胎干细胞相近的克隆,拍照记录并编号;细胞间紫外照射30 min,将选好的克隆切割并剥离饲养层细胞,吸出,于12 孔板中培养传代,扩增。
1.2.3 诱导多能干细胞的鉴定 ①iPS细胞克隆形态及碱性磷酸酶染色观察;②细胞免疫荧光鉴定人ES 细胞标志性抗原表达;③提取SLE-iPSCs 总RNA,采用RT-PCR 检测人ES 细胞标志性基因表达水平及外源基因是否沉默;④人iPS 细胞核型分析。⑤悬浮培养观察拟胚体形成及体外分化;⑥iPS 细胞接种至SCID 小鼠皮下,观察畸胎瘤形成及体内分化情况。
1.2.4 人破骨细胞诱导培养鉴定及功能分析 将上述iPSCs诱导培养为破骨细胞,通过TRAP染色、HE染色、荧光染色以及噬骨能力鉴定细胞,并采用实时荧光PCR 技术检测各种来源的破骨细胞CLCN7 mRNA 表达情况,采用Western blot 检测CLCN7 蛋白表达。
1.3 破骨细胞基因表达谱及其突变效应分析 对诱导获得的破骨细胞,提取细胞总RNA,构建破骨细胞基因表达文库,并采用基因表达谱芯片分析突变型CLCN7 破骨细胞基因表达谱情况,获得CLCN7 突变对破骨细胞发育及成熟影响的关键通路及信号分子信息。
1.4 CLCN7突变体对人破骨细胞基因表达的影响 利用miRNA、RNAi 技术,以及实时荧光定量PCR、蛋白质印迹法(Western blot)技术分析上一步骤筛选到的关键通路信号分子以及文献已报道的与CLCN7 突变所致石骨症破骨细胞发育相关的调控因子(ITGB5、PERF1、WARS 和SERPINE2)表达情况,构建ADO2破骨细胞发育基因调控网络图。
1.5 统计学方法 应用SPSS20.00 统计软件进行数据分析,计量资料以均数±标准差(x-±s)表示,两两比较采用t检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验组患者的表型和CLCN7 突变 ADO2患者总共有6种不同的CLCN7突变,这些突变位于不同位置CLC7 蛋白,其中三个位于细胞内C-末端区域,另一个位于跨膜区域。5 名相关患者有p.G215R突变和3个无关的患者p.R767W突变。
2.2 两组受试者的7 个差异基因比较 qPCR 技术检测mRNA 的结果显示,与对照组比较,实验组患者ITGB5的比例高46%,CES1的比例高143%,PERF1的比例低48%,SERPINE2 的比例低53%,WARS 的比例低39%,GBP4比例低28%和UCHL1的比例高58%,差异均具有统计学意义(P<0.05)。
2.3 ADO2 细胞中的ITGB5、SERPINE2、CES1、WARS、PERF1表达情况 为验证qPCR观察到的表达变化,通过Western blot 评估受试者的蛋白质表达水平。与对照组的供体破骨细胞比较,ADO2 细胞中的ITGB5 的表达增加278%,SERPINE2 表达下降51%,WARS 表达下降68%和PERF1 表达下降49%,差异均有统计学意义(P<0.05),而两组受试者的CES1表达比较差异无统计学意义(P>0.05),见图1。但蛋白质印迹法无法观察UCHL1 和GBP4。采用免疫荧光染色法,观察到ITGB5、SERPINE2、CES1、WARS、PERF1 存在于ADO2和健康供体的破骨细胞中,见图2。

图1 ADO2 细胞中的ITGB5、SERPINE2、CES1、WARS、PERF1表达情况
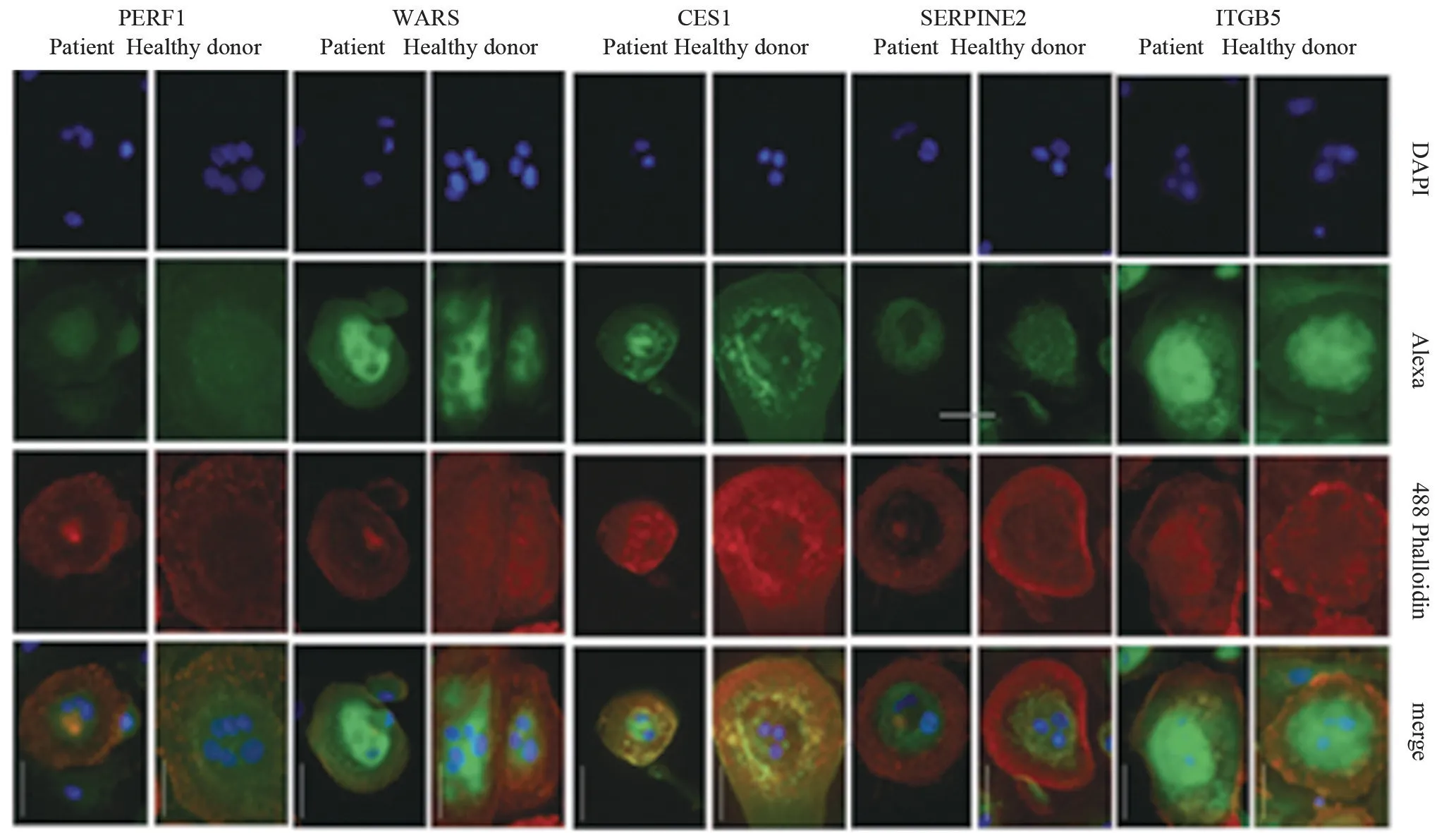
图2 免疫荧光染色后破骨细胞质中ITGB5、SERPINE2、CES1、WARS和PERF1的表达
2.4 两组转染中的基因表达修饰模型表达水平比较 实验组ITGB5 表达水平为(1.25±0.31) EU/μg,明显高于对照组的(0.93±0.23)EU/μg,而PERF1 基因表达水平为(1.07±0.26) EU/μg,明显低于对照组的(1.51±0.39)EU/μg,差异均有统计学意义(P<0.05)。而两组的WARS和SERPINE2比较差异均无统计学意义(P>0.05)。
3 讨论
骨吸收作用一般包括对骨组织羟基磷灰石等无机物和胶原纤维等有机物的代偿作用[6]。破骨细胞是高度分化的多核巨细胞直接参与骨吸收,是骨组织吸收的最主要功能细胞之一。在破骨细胞相对密封的区域内,α3亚基上的空泡质子泵提供H+,ClC-7被动转运提供Cl-,两者结合转运至破骨细胞内小囊泡,在膜表面与褶皱缘形成骨吸收亚环境,分泌、释放有机酸及相关酶类,启动骨吸收作用。在该过程中,ClC-7和质子泵等水平的降低或功能的异常都有可能会造成破骨细胞额骨吸收功能出现障碍,导致破骨细胞功能缺陷或细胞数目异常进而产生骨硬化症[7]。
在临床治疗石骨症方面,一般仅限于控制感染、防止外伤性骨折、输血、改善神经压迫、补充低钙及磷酸纤维素类食物等对症治疗,这些方案只能在一定程度上延缓骨硬化的进程。此外,造血干细胞移植也是治疗严重石骨症的重要方法之一,然而移植治疗风险较大且效果并不能令人满意。研究表明,仅7%接受造血干细胞移植术石骨症患者的病情会得到明显改善,69%接受造血干细胞移植术石骨症患者的病情出现继续恶化现象,而25%接受造血干细胞移植术石骨症患者仍有可能出现持病情持续加重现象[8]。由此可见,石骨症目前临床仍缺乏行之有效的治疗措施。iPSCs具有类胚胎干细胞的功能,由于iPSCs直接来源于患者,所获得的疾病iPSCs 及其终端分化细胞可应用于疾病病理机制研究、药物安全性检验、药物筛选乃至个体化治疗方案的制定与选择[9]。目前,将iPSCs成功定向发育为破骨细胞,建立ADO2 特异性多能干细胞(ADO2-iPSCs)很可能为石骨症发病的分子机制研究提供新的工具。
基因表达谱分析可用于调查人类样本中突变引起的变化。在本研究中,对于7 个差异表达基因GBP4、UCHL、CES1 等的RNA 可在人类破骨细胞中表达。SERPIN 是纤溶酶原系统的一部分,与基质重塑和血栓形成有关。而SERPINE2属于丝氨酸蛋白酶抑制剂超家族,表达于各种各样的组织。研究显示,SERPINE2 强烈影响纤维蛋白溶解和血栓溶解,SERPINE2在ADO2破骨细胞中明显降低[10],推测可能是一种ADO2破骨细胞吸收功能的代偿性降低。
穿孔素1 (perforin 1,PERF1)是66 kDa 的成孔蛋白质,其聚合并形成一种跨膜的孔状结构靶细胞的质膜脂质双层膜,通道依赖于Ca2+,并将颗粒酶输送到靶细胞的胞质溶胶。PERF1表达于细胞毒性自然杀伤淋巴细胞。在破骨细胞中证实PERF1表达提高[11]。本研究结果显示,CLCN7基因突变的患者与健康对照组相比,ADO2细胞中的PERF1表达水平下降约49%。
本研究结果还显示,CLCN7 基因突变的患者ADO2 破骨细胞中WARS 基因表达水平明显下降,这可能是由于破骨细胞可以合成血清素,促进色氨酸羟化酶表达,从而导致破骨细胞分化,ADO2破骨细胞中WARS 基因表达水平明显下降[12]。WARS 可能与破骨细胞生物学有关,但无法在转染实验中证实。研究显示,干扰素能够诱导短WARS 的形式[13],此外,SERPINE2 和PERF1 也是通过直接或间接调节的干扰素。亦有一个全基因组基因研究显示[14],CLCN7突变小鼠的表达谱分析,在破骨细胞组织中观察到了几种较高的表达干扰素诱导基因指向同一途径,但方向相反。
由于ITGB5 在RNA 和蛋白质水平表达存在一个趋势,即在CLCN7 突变的人破骨细胞中ITGB5 水平升高。ITGB5 是在未成熟的破骨细胞中高表达。亦有研究显示,在雌性小鼠中缺乏ITGB5的表达诱导会增加破骨细胞功能[15]。单一出现了具有未知突变的ADO2 患者破骨细胞ITGB5 的变化,包括表达增加整合素ITGB5 的细胞骨架组织和活动性破骨细胞都依赖于整合素β3及其涉及Rho GTP酶和Rho GTP酶的下游信号通路vav3。
综上所述,取自ADO2 患者和健康者的破骨细胞中表达基因存在差异,并验证CLCN7 突变所致ITGB5、WARS、SERPINE2和PERF1的表达情况变化,ITGB5表达上调和PERF1的表达下降,可能与破骨细胞功能障碍有关。

