蓝莓根毛缺失的机制及内生菌根真菌的促生作用
尤式备,徐佳慧,郭怡文,廖芳蕾,杨莉,陈文荣,郭卫东
(浙江师范大学化学与生命科学学院,浙江 金华321004)
蓝莓(Vaccinium spp.),又称为越橘,是杜鹃花科越橘属植物,是一种具有较高营养价值的果树。近几年,我国蓝莓产业发展迅猛,但由于蓝莓根系不发达,根毛缺失,使得对栽培基质的要求苛刻[1],因而在一定程度上限制了蓝莓产业的发展。根毛在植物水分及矿质元素吸收等生理活动中发挥着重要作用,绝大多数植物均具根毛,但越橘属(Vaccinium)和松属(Pinus)等少数植物类群的根细胞没有根毛特化[2]。即使在有根毛分化的植物根系中,并非所有根表皮细胞均能特化为根毛细胞,仍有大量细胞无根毛状特化。由生毛细胞(trichoblast)发育形成的根毛细胞被称为H型细胞,而由非生毛细胞(atrichoblast)发育形成的无根毛细胞被称为N型细胞[3]。在拟南芥中,根表皮细胞向H型或N 型细胞发育的命运主要受6 个关键基因调控,其中:TRANSPARENT TESTA GLABRA(TTG)、WEREWOLF(WER)、GLABRA2(GL2)的表达产物能形成介导N 型细胞发育的激活态复合物,抑制根毛产生,而CAPRICE(CPC)、TRIPTYCHON(TRY)、TRY 和CPC1 增 强 子(ENHANCER OF TRY AND CPC1,ETC1)编码的R3 MYB类转录调节因子则通过侧向抑制的方式干扰和阻止TTG、WER、GL2 等N 型细胞命运正调控因子的聚合与活化,从而诱导相邻细胞根毛的形成[4]。过去主要采用以拟南芥为主的模式植物进行根毛发生机制的研究,而对于蓝莓等自然状态下不具根毛的植物却未见其根毛缺失机制的报道。
由于蓝莓根表面不存在根毛,其养分吸收主要依赖于与蓝莓共生的菌根真菌[5],故菌根的形成对蓝莓生长至关重要。其中,蓝莓根系形成的菌根大多属于杜鹃花类菌根(ericoid mycorrhizas, ERM),为内生菌根的一种。目前,已先后鉴定出隶属于子囊菌纲(Ascomycetes)、担子菌纲(Basidiomycetes)和丝孢纲(Hyphomycetes)的ERM 真菌[6],但均未进行系统的调查和详细的分类,且关于蓝莓ERM真菌的报道相对较少。
蓝莓ERM的存在具有普遍性,几乎所有的野生蓝莓都会在自然条件下形成菌根,但人工栽培的蓝莓菌根相对较少[1]。研究表明,接种ERM真菌可以提高蓝莓根系生物量及株高[7],且对不同蓝莓品种产生不同的影响[8]。READ等研究表明,在蔓越莓上接种ERM 真菌能显著提高植株各生育期总氮(N)含量,其原因可能是ERM对土壤有机氮的矿化使土壤铵态氮含量提升,同时,ERM 也可能提高了植株对铵态氮的吸收效率[9]。此外,有报道显示,ERM对宿主植株磷(P)营养的吸收具有促进作用,且其能向菌体胞内和胞外分泌磷酸酯酶[10]。这暗示ERM对土壤P元素的活化可能是其促进杜鹃花科植物生长的重要机制。目前,虽然关于ERM真菌对宿主植物促生机制的研究已有一些报道,但关于蓝莓ERM的促生机制尚不清晰,亟待进一步明确。
本研究以‘布里吉塔’蓝莓根系为材料,对6 个根毛发生关键基因(TTG、WER、GL2、CPC、TRY、ETC1)进行分离鉴定,并对根毛形成相关关键基因表达量进行半定量分析,以探究蓝莓根毛缺失机制;同时,从5年生‘奥尼尔’和‘夏普蓝’蓝莓根系中分离并纯化了12株蓝莓内生菌根真菌,并在‘海岸’蓝莓苗上进行接种,通过比较不同有益内生菌接种处理对蓝莓根系活力、基质理化指标及叶片大量营养元素含量的影响,以期进一步探究有益内生菌接种对蓝莓生长的影响及相关促生机制,为蓝莓的现代化生产栽培提供理论基础及新的思路。
1 材料与方法
1.1 试验材料及处理
在浙江师范大学特色经济植物生物技术研究重点实验室的大田基地内,采集长势一致且健康的南高丛蓝莓‘夏普蓝’(‘Sharpblue’)和‘奥尼尔’(‘O’Neal’)5 年生苗、北高丛蓝莓‘布里吉塔’(‘Brigitta’)2 年 生 苗 及 南 高 丛 蓝 莓‘海 岸’(‘Gulfcoast’)无菌组培苗。其中:‘夏普蓝’和‘奥尼尔’蓝莓用于分离蓝莓内生菌;‘海岸’蓝莓用于已分离内生菌的回接试验;‘布里吉塔’蓝莓根系用于基因组扩增的总DNA 及cDNA 反转录的RNA提取。
1.2 试验方法
1.2.1 蓝莓根系总DNA 的提取及根毛发生相关基因的扩增
参照改良的十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法[11]提取‘布里吉塔’蓝莓根系基因组DNA,随后用NanoDrop 2000C超微量分光光度计测定样品在260 和280 nm 处的吸光度值,以检验提取的DNA浓度及纯度。
从蓝莓转录组库(https://www.vaccinium.org)中获得根毛发生相关基因序列,并在NCBI 基因库(https://www.ncbi.nlm.nih.gov)中验证后设计相关引物(表1)。以蓝莓根系DNA为模板,聚合酶链式反应(polymerase chain reaction, PCR)体系如下:10×缓冲液2.5 μL,dNTP 2 μL,上、下游引物各1 μL,Ex Taq酶0.5 μL,DNA模板1 μL,用ddH2O补足体积至25 μL。PCR 反应条件:94 ℃预变性4 min;94 ℃变性40 s,在不同退火温度(根据引物设定,表1)下退火60 s,72 ℃延伸40 s,35 个循环;最后,72 ℃充分延伸10 min,于10 ℃条件下保存。取PCR 扩增产物各5 μL,采用1.0%琼脂糖凝胶电泳检测。

表1 本研究中使用的引物Table 1 Primers used in this study
1.2.2 蓝莓根系总RNA 的提取与cDNA 的合成及根毛发生相关基因的克隆
采用张彦苹等[12]改良的十二烷基磺酸钠(sodium dodecyl sulfate,SDS)法提取‘布里吉塔’蓝莓根系总RNA。经琼脂糖凝胶电泳检验RNA提取质量及用NanoDrop 2000C 超微量分光光度计测定RNA样品浓度后,取5 μL,按照PrimeScriptTM反转录试剂盒(日本TaKaRa 公司)说明书进行RNA 反转录,合成的cDNA第1链于-20 ℃条件下保存。
以‘布里吉塔’蓝莓根系cDNA 为模板,用PrimeSTAR HS DNA 聚合酶及上下游引物构建PCR 体系并进行PCR 扩增,反应条件为:98 ℃预变性4 min;98 ℃变性30 s,在不同退火温度(根据引物设定,表1)下退火30 s,72 ℃延伸2 min,35个循环;最后,72 ℃充分延伸10 min,于10 ℃条件下保存。加A尾后的目的片段用琼脂糖凝胶电泳检测,并割胶回收特异性扩增的目的片段。将目的片段连接至pMD19-T载体上,然后转化到大肠埃希菌DH5α内,经过筛选后得到的含重组质粒的大肠埃希菌DH5α 送至英潍捷基(上海)贸易有限公司进行测序,并将测序结果与预测的根毛发生相关基因序列进行比对。
1.2.3 蓝莓根系内生菌的分离纯化及鉴定
内生菌的分离纯化:截取‘夏普蓝’和‘奥尼尔’蓝莓的幼嫩根系,用75%乙醇溶液及10%次氯酸钠溶液进行表面消毒后,将其剪成0.3~0.5 cm的较小根段,并接至马丁培养基中,于28 ℃条件下避光培养1 周左右。采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基进行纯化,直至形成纯培养,于4 ℃条件下保存。
菌种分子生物学鉴定:参考WALKER 等的方法[13],用CTAB 法提取真菌DNA,其内转录间隔区(internal transcribed spacer, ITS)序列用通用引物ITS1 和ITS4 进行PCR 扩增,经琼脂糖凝胶电泳检测后,将有条带的样品送往英潍捷基(上海)贸易有限公司进行测序,将结果在NCBI 的GenBank 数据库(https://www.ncbi.nlm.nih.gov)中进行BLAST 比对后,选取相似程度最高的真菌序列,使用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统进化树,确定其真菌种类。
1.2.4 内生菌回接蓝莓试验
在接种前20 d,将‘海岸’蓝莓无菌组培苗用清水清洗后,随机分组并栽种于无菌的椰糠栽培基质中,在25 ℃环境下适应20 d。随后,采用5 mm打孔器在内生菌菌落边缘打孔,获取新鲜菌丝块,将其接种于各处理组蓝莓苗根系附近,每株接种2块。对照组接种无菌的PDA培养基。每处理3个重复,每个重复接种3株,共9株。处理后,将组培苗置于恒温培养箱中培养,昼/夜温度为25/20 ℃,每天光照14 h,光照强度为1 000 lx,相对湿度控制在70%~75%之间。
1.2.5 蓝莓株高的测定及促生内生真菌的筛选
分别在接种0、30、60、90 d 后用刻度尺测量各组蓝莓株高,并对90 d时各组蓝莓株高增量进行统计分析,然后结合不同处理组的蓝莓生长状况筛选具有显著促生作用的内生真菌。
1.2.6 根系内生菌的侵染观察
采用台盼蓝染色法[14]对根系进行染色,取染色后的根系先端末级分枝上2 cm 长根段制片,每10个根段为一个装片,每组处理通过正置荧光显微镜(德国卡尔蔡司公司)观察有益内生菌的侵染特征并拍照记录。根系侵染率=真菌侵染的根段数/镜检根段总数×100%。
1.2.7 根系活力测定
用氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride,TTC)还原法测定根系活力。从根系中提取的三苯基甲臜(triphenyltetrazolium formazan,TTF)在485 nm波长处用紫外分光光度计进行比色。TTC 还原强度/(μg/(g·h))=TTC 还原量/μg÷(根质量/g×t/h)。
1.2.8 根际栽培基质的氮磷含量测定
通过抖土法收集各组蓝莓根际椰糠栽培基质,在室内自然风干并研磨成粉,用于理化指标测定。椰糠栽培基质的pH用电位法[15]测定,铵态氮含量用纳氏比色法[16]测定,速效磷含量用钼锑抗比色法[15]测定。
1.2.9 叶片总氮磷含量测定
分别收集各组蓝莓叶片,经洗涤、烘干、研磨后用H2SO4-H2O2消煮法进行消煮,随后稀释定容至50 mL。采用纳氏比色法[17]测定蓝莓叶片总N含量,采用钼锑抗比色法[16]测定叶片总P含量。
1.2.10 真菌分泌物维生素B2的定性测定
按照吴静萍等[18]测定维生素B2的方法,将有益内生菌分别接种至不含B 族维生素的无菌Murashige & Skoog(MS)培养基中,于100 r/min、28 ℃条件下避光振荡培养5 d。将菌根真菌液体纯培养物用4层纱布过滤,收集滤液,并刮取纱布上层的菌丝体,经超声波破碎3 min 后,加入适量稀硫酸,于沸水浴中抽提30 min,冷却后过滤制成菌丝体抽提液。分别将真菌培养液和菌丝体抽提液的pH调至7.0,并以10 nm为狭缝宽度,在435 nm的激发波长下进行扫描,并绘制荧光发射光谱。
1.2.11 数据分析
使用Excel 2013进行数据统计,并用SPSS 24.0对数据进行单因素方差分析(one-way analysis of variance, one-way ANOVA)及最小显著差数法(least significant difference,LSD)检验。
2 结果与分析
2.1 基因组扩增结果
如图1A 所示:在电泳图上能清晰地观察到从蓝莓根系基因组中扩增的根毛发育相关基因CPC、ETC1、TRY、WER、TTG和GL2的亮带,说明上述6个基因在蓝莓基因组中都存在,其引物设计正确。
2.2 蓝莓根系cDNA 的克隆结果
以蓝莓根系cDNA 为模板,通过PCR 扩增得到WER、TTG 和GL2 的cDNA 序列,测序结果表明,其长度分别为648、1 017 和1 625 bp;但未能检测到CPC、ETC1和TRY的表达(图1B)。
2.3 菌种鉴定结果
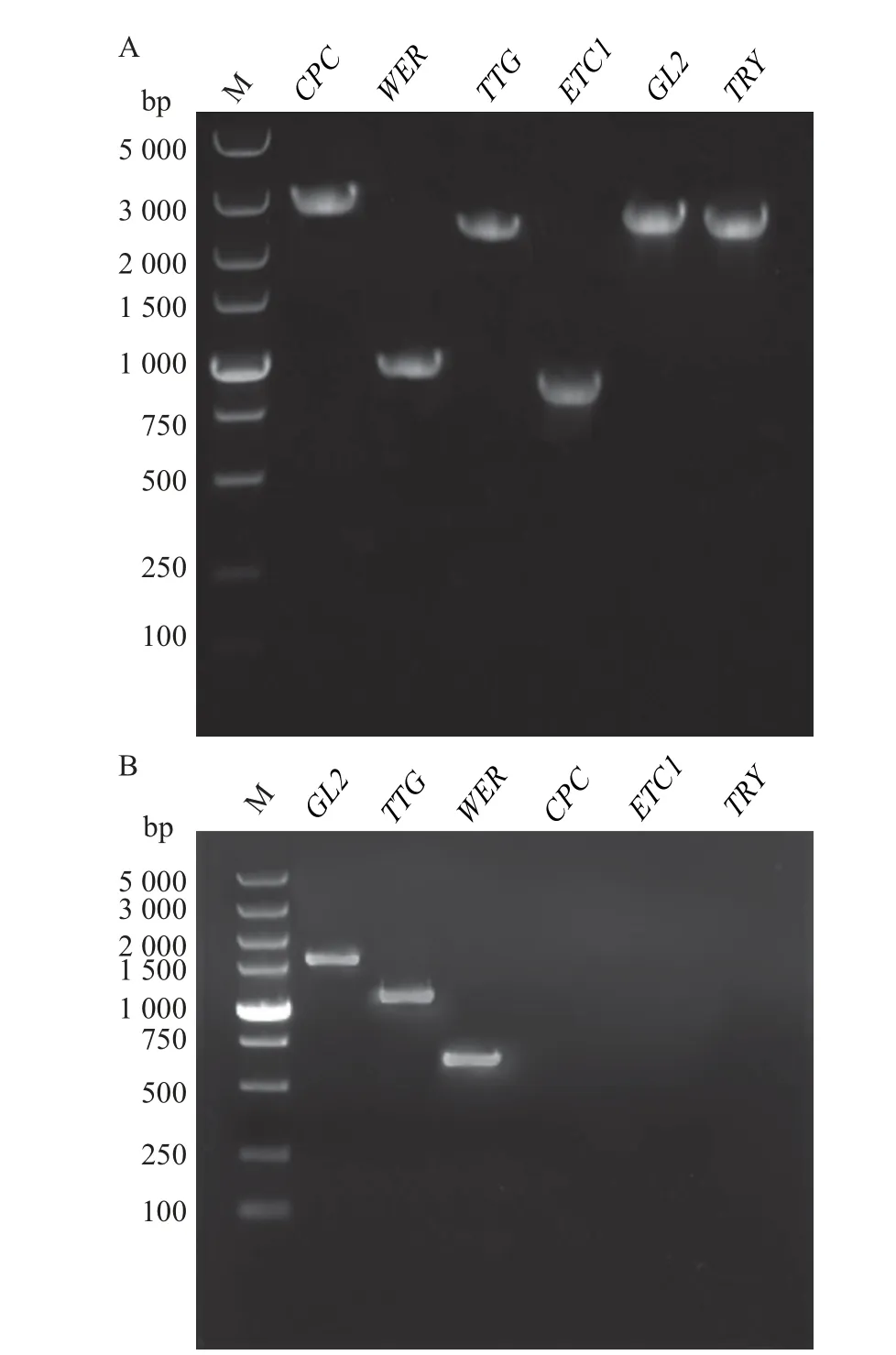
图1 蓝莓根毛发生相关基因扩增(A)及cDNA 克隆(B)电泳图Fig.1 Electrophoretogram of PCR products of blueberry root hair development related genes (A) and their cDNA clones(B)
分离得到的12株菌根真菌的形态学特征如图2所示:菌落颜色以白色和灰白色为主;表面形态大多为毡状或絮状;菌落边缘除个別呈放射状外,大多规则平整;个别菌株能分泌绿色、黄色等色素。
经分子生物学分析,从‘奥尼尔’蓝莓中分离并鉴定出3株真菌,从‘夏普蓝’蓝莓中分离并鉴定出9株真菌。其中:11株真菌为子囊菌,1株真菌为未知菌。
从系统发育树(图3)上可以看到,分离得到的12个菌株在NJ树上聚为4大类,其中:X5单独聚为一大类,与其他菌株的亲缘关系较远,分类地位尚不明确;X10 单独聚为一大类,与未分类真菌(GenBank登录号:KC202937.1)亲缘关系最近;X6、A2、X11、X2聚为一大类;A1、A4、X17、X24、X22、X28聚为另一大类。从图3 还可以看出:A4、X17、X22、X28 与镰刀菌属(Fusarium)各个真菌种的亲缘关系最近;A1与踝节菌属(Talaromyces)真菌的亲缘关系最近;X24 与赤霉属(Gibberella)真菌的亲缘关系最为接近;X2、A2、X6 在亲缘关系上分别最接近于青霉属(Penicillium)各个种;而X11 与曲霉属(Aspergillus)真菌的亲缘关系最近。
2.4 菌根真菌对蓝莓株高增长的影响及有益菌的筛选结果
在1年生‘海岸’蓝莓上接种从不同蓝莓(‘奥尼尔’和‘夏普蓝’)中分离的菌根真菌90 d后,处理组蓝莓的平均株高增长量与对照相比总体呈上升趋势(图4)。其中,A1、A4、X2、X22 接种组的蓝莓平均株高增长量较对照组显著增加,分别提高了105.01%、80.58%、55.24%和46.43%。
2.5 不同有益内生菌接种的根系侵染特征及其对根系活力和根际基质pH 的影响
镜检分析显示,被真菌侵染的蓝莓根细胞内存在菌根结构,一种是形成胞内菌丝团或菌丝圈(图5A~B),另一种是贯穿于细胞间隙的菌丝(图5C),均属于典型的内生菌根结构。在表皮细胞与皮层细胞间隙间的菌丝有的纵向贯穿于根细胞间,有的横向侵入细胞或沿细胞间隙延伸,整体构成了复杂的网络状(图5D)。对蓝莓的根系活力测定结果显示,内生真菌A1、A4、X2、X22 不同程度地提高了‘海岸’蓝莓的根系活力,相比对照分别提升了92.52%、43.92%、4.17%、100.33%;对根际pH测量结果表明,除A1以外,接种真菌A4、X2、X22均显著降低了根际基质pH,表明A4、X2、X22能够酸化根际;此外,4 种真菌对‘海岸’蓝莓的侵染率介于45%~61%之间,极显著高于对照组(表2)。
2.6 有益内生菌对蓝莓根际速效养分及叶片总氮磷含量的影响
有益内生菌接种对根际栽培基质铵态氮及速效磷含量的影响如图6所示:接种A1和X22极显著提高了蓝莓根际栽培基质中铵态氮含量,与对照相比铵态氮含量分别升高51.50%和31.41%;接种A1和X2 显著降低了蓝莓根际栽培基质中速效磷含量,而接种A4和X22后蓝莓根际栽培基质中速效磷含量与对照无明显差异。由图6 还可以看出:与对照相比,接种A1、A4、X2 和X22 不同程度地提高了蓝莓叶片总氮含量,增幅分别为6.68%、22.90%、11.78%和1.18%,其中,A4 处理组蓝莓叶片总氮含量显著增加;叶片总磷含量在接种A1 和X2 后均无显著差异,而接种A4和X22后显著和极显著地提高了蓝莓叶片的总磷含量。
图2 蓝莓内生菌根真菌的形态学特征Fig.2 Morphological characteristics of endophytic mycorrhizal fungi in blueberry
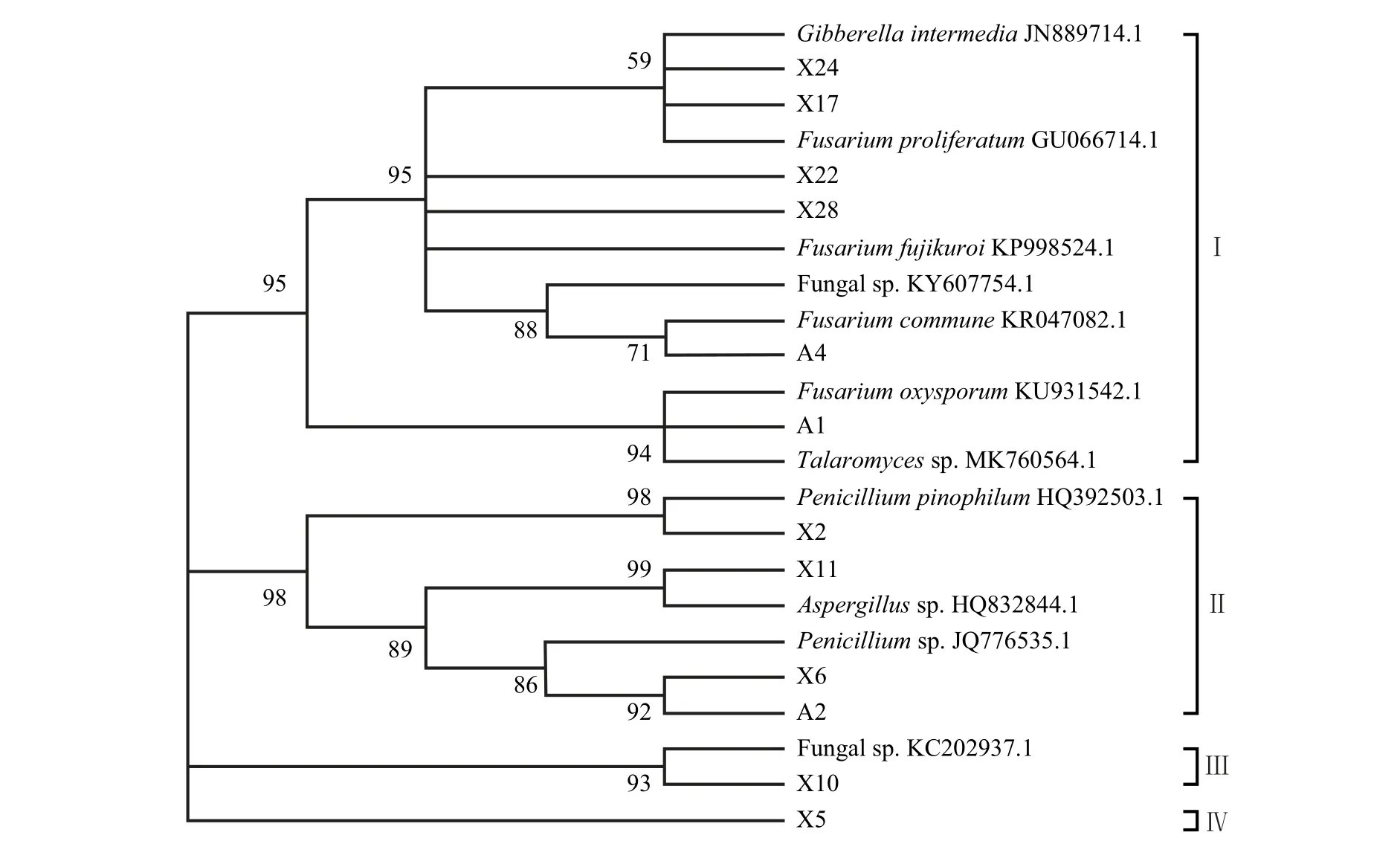
图3 基于NJ法的蓝莓内生菌根真菌的系统聚类分析Fig.3 Systematic cluster analysis of endophytic mycorrhizal fungi in blueberry based on NJ method
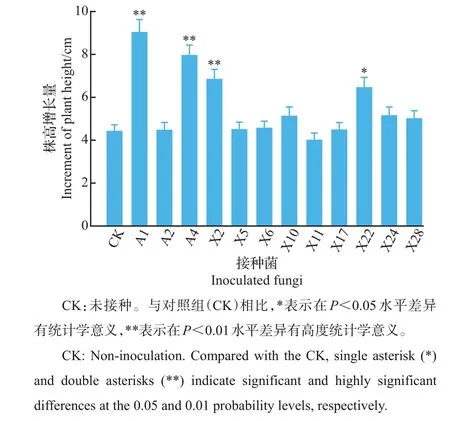
图4 蓝莓内生菌根真菌回接对蓝莓株高增长的影响Fig.4 Effects of inoculation of endophytic mycorrhizal fungi isolated from blueberry on increment of blueberry plant height
2.7 有益内生菌分泌物维生素B2的定性分析
荧光定性分析显示:促生内生菌X22 培养液(图7A)及菌丝体抽提液(图7B)在波长为435 nm激发光激发下,均在525 nm 处形成荧光发射峰,该峰与维生素B2在相同激发光激发下形成的发射峰处于相同位置,表明X22培养液及菌丝体抽提液中有维生素B2的存在,即X22能向外分泌维生素B2且自身含有该物质。而在A1、A4、X2培养液和菌丝体抽提液中均未检测到维生素B2,表明这3 株菌无维生素B2分泌能力。
3 讨论
对拟南芥的研究显示,关键基因WER、TTG、GL2 对根毛发生起负调控作用,相关表达产物抑制根毛形成[19]。对于其调控根毛发生的机制,有报道指出,WER 和TTG 等调控因子形成的复合体能激活GL2[20],而GL2 直接决定了植物根表皮细胞分化命运,并诱导根表皮细胞向N型细胞发展[21]。CPC、TRY、ETC1 为根毛发生正向调控基因,其表达产生的R3 MYB类转录调节因子具有诱导根毛发生的作用,但这种诱导仅作用于相邻细胞[22],其诱导机制被认为是CPC、TRY、ETC1 通过侧向运输干扰相邻表皮细胞中TTG、WER 等形成激活态复合物,进而抑制GL2 表达,使表皮细胞特化形成根毛[23]。本研究结果显示,6 个根毛发生关键基因WER、TTG、GL2、CPC、TRY、ETC1均存在于蓝莓根细胞基因组中,其中负调控基因WER、TTG、GL2 有明显转录,但未见根毛发生的正调控基因CPC、TRY、ETC1的表达,表明蓝莓根毛缺失与上述6个根毛发生的关键基因相关。本研究首次利用自然状态下无根毛分化物种的正常基因环境进行根毛发生机制研究,避免了以单向敲除基因的突变体为材料所存在的触发未知旁路调控机制的风险,进一步验证了关键基因在根毛发生中的作用。

图5 根系内生菌根真菌侵染形态Fig.5 Infection morphology of root endophytic mycorrhizal fungi
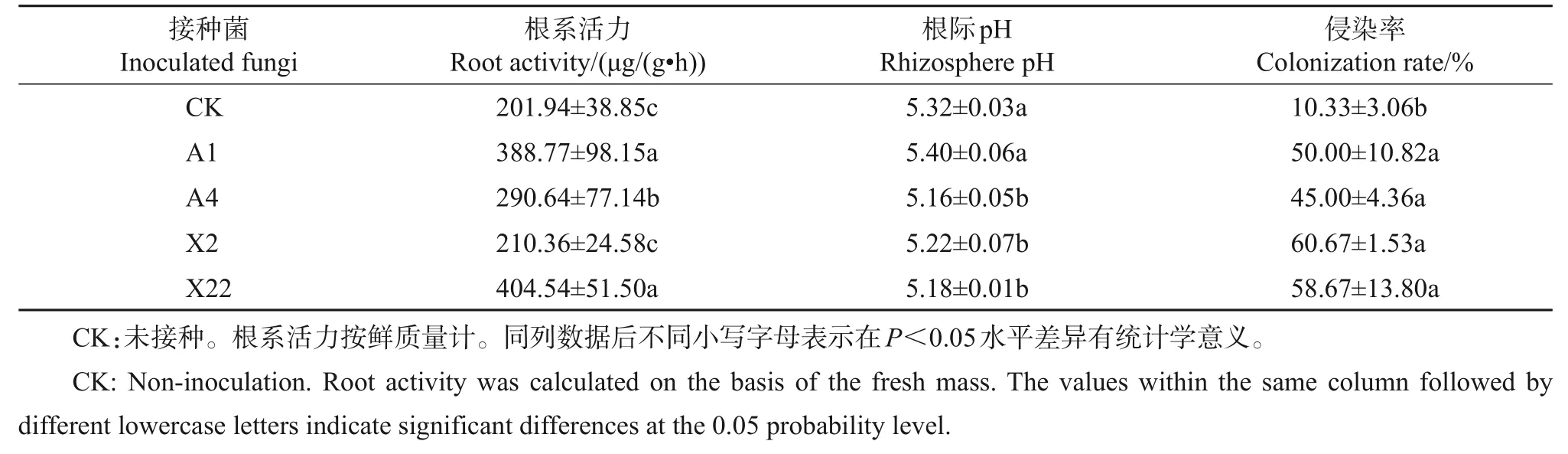
表2 接种不同有益内生菌对根系活力及根际pH的影响Table 2 Effects of inoculation of different beneficial endophytic mycorrhizal fungi on root activity and rhizosphere pH
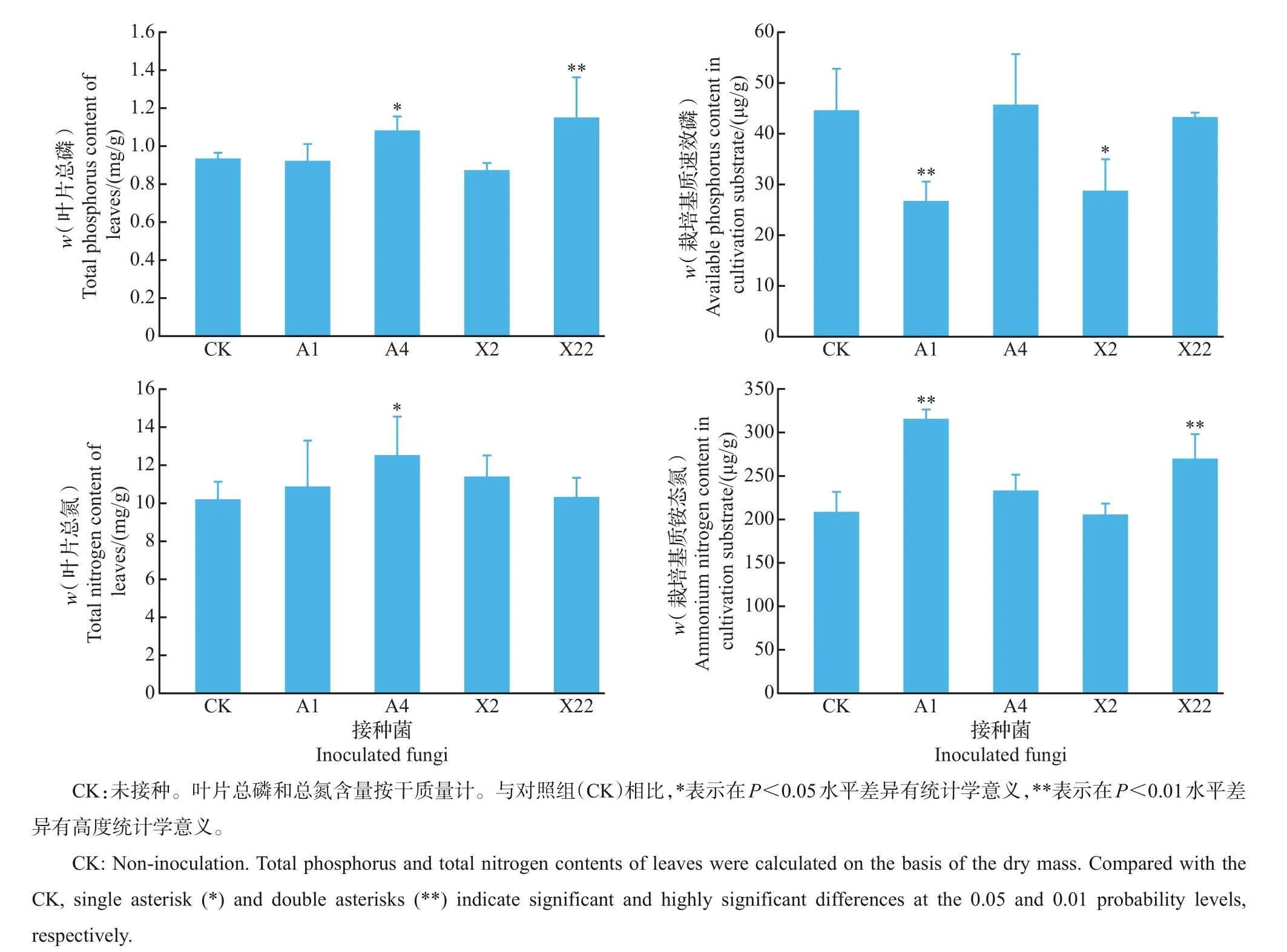
图6 接种促生内生菌根真菌对根际速效养分及叶片总氮磷含量的影响Fig.6 Effects of beneficial endophytic mycorrhizal fungi inoculation on available nutrients in rhizosphere and total nitrogen and total phosphorus contents of leaves
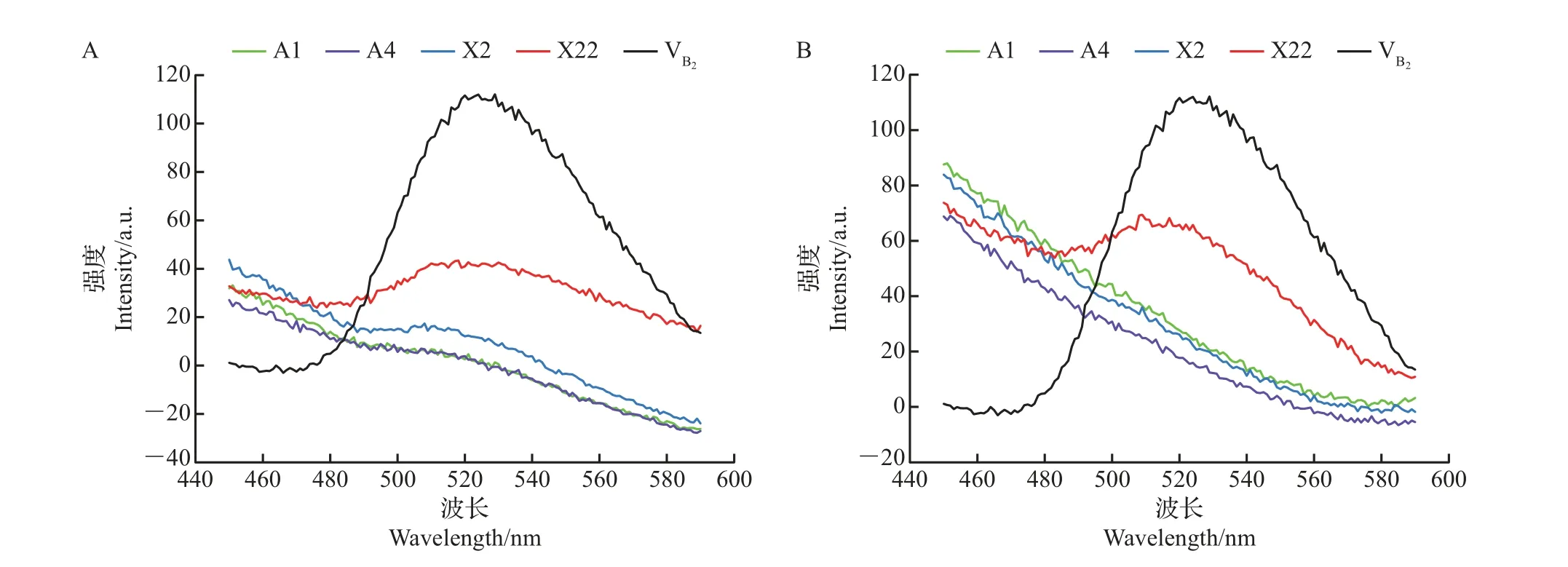
图7 促生内生菌根真菌培养液(A)及菌丝体抽提液(B)中核黄素的荧光定性分析Fig.7 Qualitative fluorescence analysis of vitamin B2 (VB2) in culture medium (A) and mycelium extract (B) of beneficial endophytic mycorrhizal fungi
越橘属、松属植物根表皮细胞的发育均遵循N型细胞命运而不受分布位置影响,鉴于越橘属、松属植物为木本植物,故其根毛缺失可能存在外皮层相关机制:根外皮层木质化过程早于根表皮细胞分化,从而使外皮层的部分木质化弱化了根表皮细胞与其覆盖的外皮层细胞的接触与细胞通讯,使得CPC、TRY、ETC1无法表达,最终致其根毛不发生。
蓝莓根毛的缺失使其对菌根具有较高的依赖性,自然状态下通常与特定真菌形成ERM真菌。本研究从‘奥尼尔’和‘夏普蓝’根系中共分离并鉴定了12 个菌株,其中除X5 和X10 的分类地位尚不清楚外,4株为镰刀菌属真菌,3株为青霉属真菌,1株为踝节菌属真菌,1 株为赤霉属真菌,1 株为曲霉属真菌。类似的研究也从不同蓝莓品种中分离得到曲霉属、镰刀菌属[24]和青霉属[6]ERM 真菌。在本研究中,镰刀菌属真菌A4和X22、踝节菌属真菌A1及青霉属真菌X2 接种的蓝莓株高增长量显著提高,且上述4 种真菌对‘海岸’蓝莓根系的侵染率均在45%以上,可以初步判断A1、A4、X2 及X22 能促进植株生长。对菌根形态的显微观察表明,这4 种内生真菌与蓝莓根系形成紧密的菌丝圈,为ERM的典型结构[25]。同样,促生内生菌根真菌对蓝莓的促进作用与类似研究的结果[26]相似。
根系活力综合反映了根系养分吸收和物质合成能力,同时,蓝莓根系发育状况及蓝莓对菌根的依赖性与根系活力密切相关[27]。本研究中,4 种蓝莓内生菌根真菌接种不同程度地提高了‘海岸’蓝莓根系活力,其中A1、A4 及X22 接种效果显著,表明有益菌定殖后形成的ERM 真菌改善了蓝莓根系的生长状况。
根际pH 环境与植物生长关系密切,根际pH 的改变将引起土壤矿物元素有效性、植物的养分吸收效率及土壤结构的改变[28]。研究表明,土壤pH的降低能促进蓝莓的养分吸收,同时能提高蓝莓根系代谢活力,甚至上调养分吸收及转运的相关基因表达[29]。除A1接种的‘海岸’蓝莓根际pH与对照差异不大以外,A4、X2和X22接种均降低了蓝莓根际pH(P<0.05),说明A4、X2 和X22 与‘海岸’蓝莓根系形成的ERM 真菌可能具有酸化根际环境的作用。ERM真菌对根际pH的降低或为改善蓝莓生长状况的重要原因之一。
氮、磷作为必需大量营养元素,在植物的生长发育过程中发挥重要作用。蓝莓对于铵态氮具有偏好性,在3.5~7.5 的pH 区间,铵态氮源相比硝态氮源更利于蓝莓生长及其养分吸收[30]。对蔓越莓的研究表明,ERM真菌接种提高了各生育期营养器官中的氮含量[8]。本研究中,促生ERM真菌接种不同程度地提高了‘海岸’蓝莓叶片氮含量,且A4 接种处理效果显著。这与已有的关于ERM 真菌提高蓝莓植株N 水平的报道[6]相一致。同时,A1 和X22 接种处理使‘海岸’蓝莓根际栽培基质中铵态氮含量明显上升(P<0.01),可能的原因是ERM 真菌将椰糠栽培基质中的有机氮矿化为铵态氮[31]。虽然A4和X2接种对根际栽培基质中铵态氮含量的影响不明显,与对照组处于相同水平,但鉴于4个促生内生真菌处理组蓝莓株高显著提升,且在试验过程中未对各组施用外源肥料的情况下‘海岸’蓝莓叶片总氮含量却总体呈上升趋势,故可以推断A4 和X2 形成的ERM 真菌也可能对栽培基质有机氮具有一定的矿化作用。磷是植物体物质合成及代谢途径中的重要物质,直接参与光合作用、植物生长等生理过程[32]。而菌根的形成对植物磷元素利用具有正面影响[33]。本研究显示:A4 和X22 接种显著提高了‘海岸’蓝莓叶片总磷含量,而对蓝莓根际栽培基质中速效磷含量的影响不明显;相比之下,A1和X2接种处理组蓝莓叶片总磷含量与对照无明显差别,但其根际栽培基质中速效磷含量显著降低。由于试验过程中未对各组施加外源磷肥而4种真菌接种组蓝莓叶片总磷含量却显著提升,说明A4 和X22 与‘海岸’蓝莓形成的ERM 真菌可能具有促进根际栽培基质磷元素有效化的作用,可能的机制是A4 和X22 与‘海岸’蓝莓根系形成的ERM 能向外分泌磷酸酯酶,进而降解根际有机磷[10]。
此外,本研究还在X22 真菌培养液和菌丝体抽提液中检测到维生素B2的存在。类似的研究显示,与密花石斛共生的兰科菌根真菌也具有分泌维生素B2等B 族维生素的能力[18]。维生素B2具有促进植物生长及提高植物体抗逆性的作用[34-36],如维生素B2可作为植物的一种抗病诱导剂,启动由丝裂原活化蛋白激酶MPK3/MPK6 介导的抗病基因表达[35]。这暗示维生素B2的分泌或是ERM 真菌具有益生作用的另一机制。

