微流芯片表面生物改性用于重组人骨形态发生蛋白-2的检测
陈婧,何宏燕,2*,刘昌胜,2
(1.华东理工大学材料科学与工程学院,上海200237;2.华东理工大学教育部医用生物材料工程研究中心,上海200237)
骨形态发生蛋白(bone morphogenetic protein,BMP)作为一种功能性生长因子,对于生命体的生长发育,特别是骨再生修复有着非常重大的作用,近年来被广泛应用于骨组织修复工程领域[1-3]。在众多BMP分子中,由基因工程技术生产的重组人骨形态发生蛋白-2(recombinant human bone morphogenetic protein-2, rhBMP-2)在临床上应用较为广泛。rhBMP-2 具有和人类天然BMP-2 相同的氨基酸序列,已被美国食品和药物管理局(Food and Drug Administration, FDA)和欧洲药品评估局(European Agency for the Evaluation of Medicinal Products,EMEA)批准用于大段骨缺损、骨不连和脊柱融合等的临床手术治疗中。rhBMP-2不仅能够规避异种因子存在的免疫反应以及病原传播的潜在风险,同时也避免了使用动物组织来提取生长因子导致的质量问题和纯度问题[4]。已有大量研究表明,将rhBMP-2以物理吸附、共价接枝、层层自组装、仿生沉积或电化学沉积等方法添加到材料表面或内部均会显著提高植入材料在缺损部位的诱导成骨效果,其浓度的高低和活性的维持直接影响植入材料的成骨能力[5-9]。目前,评价rhBMP-2浓度和活性的方法主要包括二辛可宁酸(bicinchoninic acid,BCA)检测、酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)检测和碱性磷酸酶(alkaline phosphatase,ALP)活性检测。其中:BCA 检测方法虽然具有成本低、操作简便、反应时间短等优点,但其检测区间在20~2 000 μg/mL 之间,灵敏度较低,且缺乏特异性;ELISA 检测虽然满足了特异性和高灵敏度的要求,但操作相对复杂,试剂成本高;而ALP活性检测可以直接衡量rhBMP-2的活性,但耗时过长,反应时间通常需3~7 d,尤其是评价由大肠埃希菌(Escherichia coli)表达系统制得的rhBMP-2浓度和活性更具挑战。因此,开发一种快速、价廉、精准的rhBMP-2检测方法具有非常重要的意义。
将微流控技术和特异性抗体-抗原反应的免疫分析相结合,在玻璃或高分子芯片上刻痕,研制免疫分析微流芯片是酶联免疫分析的主要发展趋势[10-13]。刻痕得到的微流道比表面积大、体积小,不仅大大减少了抗体和试液的消耗,而且洗涤和孵育所需时间大大缩短,实现了快速免疫分析。但是,微流道检测孔内由于试剂用量的大大减少,也会使得检测信号降低,导致检测信号之间的差异不易区分。因此,迫切需要对微流芯片检测孔进行改性,提高抗体的吸附效率,才可以保证足够的线性检测范围和检测灵敏度。等离子体处理是通过将气体暴露在高频振荡区域,气体的电子和原子核产生分裂,继而形成等离子。使用该方法处理材料表面,极易引入羟基、氨基等活性官能团,有效地提高材料的表面活性用于后续反应[14-15]。蛋白A(protein A)来源于金黄色葡萄球菌细胞壁,在一定酸度下能够维持其活性,且稳定性非常好。已有研究表明,蛋白A 能够强烈地与多种哺乳动物的免疫球蛋白发生特异性结合,即形成蛋白A-Fc结合,有效调节了抗体的特异吸附方向,在一定程度上有利于抗体进一步结合抗原,进而增强检测信号的强度[16-17]。
本文结合酶联免疫分析与微流控检测策略,力求实现rhBMP-2的特异和精准的浓度检测。首先,以大肠埃希菌表达系统制备的rhBMP-2为样本,筛选出与其有特异性结合作用的抗体。其次,为了提高检测信号强度,基于调控抗体特异方向的策略,采用等离子体-蛋白A方法对高分子微流芯片的检测孔进行修饰(图1),以评价抗体蛋白在微流芯片表面的吸附效果以及最终的检测信号强度,探讨微流控技术用于rhBMP-2浓度检测的前景。
1 材料与方法
1.1 实验试剂
过 氧 化 氢(H2O2)、3- 对 羟 基 苯 丙 酸(3-hydroxyphenylpropionic acid, HPPA)、脱盐柱、封闭缓冲液、碳酸氢钠粉末、磷酸盐粉末、蛋白A、酪氨酸酶(25 KU)[购自西格玛奥德里奇(上海)贸易有限公司];rhBMP-2第1抗体、rhBMP-2第2抗体、辣根过氧化物酶(horseradish peroxidase,HRP)共轭链霉素和聚氧乙烯基单月桂酸酯(Tween-20)(购自上海欣博盛生物科技有限公司)。分别从上海润裕生物科技有限公司(简称“润裕”)、上海欣博盛生物科技有限公司(简称“欣博盛”)和美国派普泰克公司(简称“派普泰克”)购买BMP-2 ELISA 试剂盒和相关的抗体,其中,润裕抗体是小鼠单抗IgG(Abcam:ab6285)。rhBMP-2 标准品由合作单位上海瑞邦生物材料有限公司(简称“瑞邦”)提供;芯片由中国台湾Ritek公司提供,微流道深度均为200 μm。
1.2 rhBMP-2 抗体的筛选
首先,将市售的BMP标准品按梯度稀释至1 000 pg/mL,瑞邦rhBMP-2标准品稀释至相同质量浓度。选用不同公司的试剂盒,每孔加入100µL 样品,孵育90 min;弃去剩余试剂,每孔加入350µL洗涤液,静置30 s后弃去液体,重复洗板5次。接着,每孔加入100µL 第2 抗体,孵育60 min;弃去剩余试剂,洗板5 次。然后,每孔加入100µL HRP,避光孵育30 min;弃去剩余试剂,洗板5 次。再接着,每孔加入100 µL 3,3′,5,5′-四甲基联苯胺(3, 3′, 5, 5′-tetramethylbenzidine, TMB),避光孵育15 min。最后,每孔加入100 µL 终止液,3 min 内用酶标仪在450 nm 波长处测定各孔的吸光度值。以上每次孵育时用封板胶纸封住反应孔,孵育温度为37 ℃。所得的数据依照式(1)分别计算不同ELISA试剂盒的η值;η值越接近1,表明标样抗体对E.coli-rhBMP-2的特异性吸附越好。

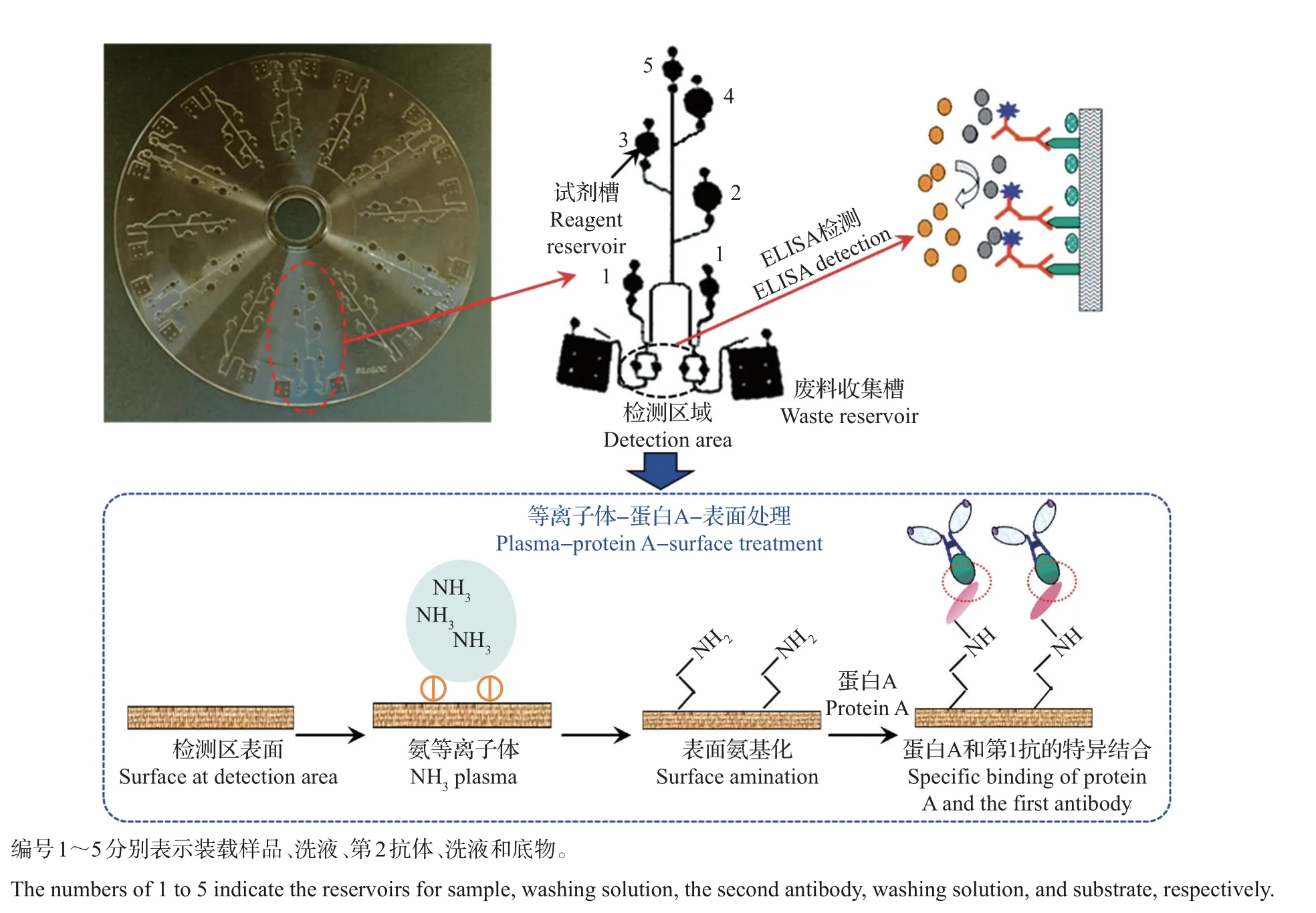
图1 高分子微流芯片表面的等离子体-蛋白A处理工艺示意图Fig.1 Schematic diagram of the plasma-protein A treatment process on the surface of polymer-based microfluidic chip
式中:D样是瑞邦rhBMP-2 标准品在450 nm 波长处的吸光度值;D标是对应的试剂盒中相同质量浓度标准品在450 nm波长处的吸光度值。
1.3 抗体的二级结构测定
由于抗体初始质量浓度不同,分别将润裕和派普泰克抗体采用超纯水稀释至25µg/mL;欣博盛抗体的质量浓度为1µg/mL。用J-715 型圆二色谱仪(JASCO公司,日本)测定抗体蛋白的二级结构。检测波长范围为190~260 nm,扫描步长为1 nm,控温20 ℃。采用CDNN 2.1软件计算溶液中抗体蛋白二级结构元件的百分比。
1.4 等离子体-蛋白A 表面改性
将微流芯片分割为小块(1 cm×1 cm),随机分成2 组放入烧杯中,并加入一定量去离子水使其浸没,超声处理5 min,吹干表面后待用。调节氧气流量,使压力表指针稳定在0.3~0.4之间,在100 W功率下对所有样品处理1 min,以清除样品表面杂质。然后,关闭氧气通路开关,抽真空,将腔体内氧气去除。最后,接通氨气通路开关,调节流量阀,使压力表指针稳定在0.3~0.4之间,等待2 min以充分置换处理室及管路中的残余气体。氨气等离子体处理功率分别为25、50和100 W。
配制50 mmol/L磷酸二氢钾溶液,并调节pH至6.5。将酪氨酸酶溶解于一定量磷酸二氢钾溶液中,配制成2 mg/mL 的酪氨酸酶溶液。按每100µL 为一份分装,保存于-20 ℃冰箱中,备用。将蛋白A溶解于一定量磷酸盐缓冲液(phosphate buffered saline,PBS)中,得到质量浓度为100µg/mL的蛋白A 溶液,按每500µL 为一份分装,保存于-20 ℃冰箱中,备用。取一份酪氨酸酶溶液(100µL)和一份蛋白A溶液(500µL),混合均匀,加入到经等离子体活化后的样品表面(每孔2µL),置于培养皿(空气密封或湿润密封)中,在4 ℃条件下静置4 h。
1.5 表面水接触角测定
等离子体处理工艺参数对微流芯片亲水和疏水特性的影响采用JC2000D2 型水接触角测量仪(上海中晨数字技术设备有限公司)进行表征。实验中每次所需纯净水体积约为3 μL,拍照记录水滴与材料表面接触瞬间的情况,并测量水滴与平面的接触角,同等条件下测量3次,取平均值。
1.6 抗体的荧光染色
取市售的碳酸氢钠粉末一份,溶解于50 mL 去离子水中,并调节pH 至0.9±0.1,得到碳酸氢钠溶液。在异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)中加入适量碳酸氢钠溶液,配制成摩尔比为2.5∶1的FITC溶液。取市售的磷酸盐粉末一份,溶解于1 000 mL去离子水中,并将pH调至7.4±0.1,得到磷酸盐缓冲液(PBS)。取100µL 第1 抗体与50µL 2.5∶1 的FITC 溶液混合,于室温条件下避光振荡2 h,获得抗体-FITC结合物。用PBS将凝胶过滤柱清洗2遍。将抗体-FITC结合物从凝胶过滤柱的上方加入,以去除未与抗体结合的FITC,收集过滤液,在4 ℃条件下避光保存。用PBS 洗出残留在凝胶过滤柱中的FITC,在4 ℃条件下避光保存。
1.7 抗体的吸附效率
为了研究等离子体处理功率和湿润条件对第1抗体吸附效率情况的影响规律,样品表面经等离子体-蛋白A 处理后(氨气等离子体处理时间为30 s,处理功率分别为25和100 W),多余液体被吸出,在检测孔中加入PBS,洗涤3次。然后在检测孔中加入2µL抗体-FITC,置于敞口表面皿(干燥环境)或带盖表面皿(内部湿润环境)中,于4 ℃条件下孵育4 h,洗板3 次后,在A1R 型激光共聚焦显微镜(尼康公司,日本)下观察微流芯片检测孔内荧光分布情况。
1.8 微流芯片表面在ELISA不同阶段的特性表征
分别采用25 和100 W 等离子体功率处理样品30 s,将第1 抗体、rhBMP-2 和第2 抗体依次特异吸附到样品表面,通过EASCAB 250 XI型X射线光电子能谱仪(Themo Fisher 科技公司,美国)对表面进行N 元素分析。通过X 射线光电子能谱技术(Xray photoelectron spectroscopy, XPS)及N(1s)分峰对比,可以判断微流芯片表面N元素变化。将微流芯片切割成3 mm×3 mm 的样品,在SPM 9500 型原子力显微镜(Shimadzu公司,日本)下观测每个反应阶段样品经改性处理后的表面形貌,并采用NanoScope Analysis 1.5软件对图像进行分析。
1.9 微流芯片-ELISA 标准曲线的测定
根据1.4所述的方法对微流芯片检测孔进行表面改性,其中等离子体处理功率为100 W,时间为30 s。检测孔表面吸附特异抗体后,根据ELISA 标准方法进行实验,其中自制rhBMP-2标准品质量浓度分别为0、250、500、1 000、2 000 pg/mL。所用底物A、B 的配制方法如下。底物A:0.045 26 g HPPA粉末溶于11.3 mL Tris-HCl缓冲液中;底物B:10µL H2O2溶于11.3 mL Tris-HCl 缓冲液中。在DMi8 倒置荧光显微镜(徕卡公司,德国)下观察微流芯片检测孔内的荧光强度,并用Image J 1.8.0 软件计算孔内平均光密度。
2 结果与分析
2.1 第1 抗体的筛选
已有研究表明,基于大肠埃希菌表达系统生产的rhBMP-2蛋白具有良好的骨诱导和骨传导能力,可以促进C2C12 细胞向成骨方向分化[18]。因此,本文选用C2C12 细胞作为评价原核rhBMP-2 活性的细胞模型。不同质量浓度的rhBMP-2 样品在C2C12 细胞系中的ALP 活性表达情况如图2A 所示:当rhBMP-2 样品质量浓度低于156.25 ng/mL时,ALP 表达的吸光度值均在0.11 左右,说明此时rhBMP-2 样品并不能有效地诱导C2C12 细胞向成骨方向分化;随着其质量浓度的增大,ALP 的活性表达迅速增强,意味着rhBMP-2成骨分化能力迅速提升;当rhBMP-2质量浓度达到1 250.00 ng/mL时,吸光度值达到1.03;此后,随着rhBMP-2质量浓度的增大,吸光度值的增长速率减缓且趋于平稳,最终停留在1.60附近,说明rhBMP-2已经发挥出最佳效果,最大限度地诱导了C2C12细胞向成骨方向分化,其质量浓度继续增加对提高诱导能力的意义不大。可见,在一定质量浓度范围(156.25~1 250.00 ng/mL)内,rhBMP-2的骨诱导能力具有剂量依赖性。
选取1 000 pg/mL的自制rhBMP-2样品,采用不同厂家的ELISA 试剂盒检测其在450 nm 波长处的吸光度值,然后计算其与不同厂家标准品检测值的比值(η值)。如图2B所示,仅有欣博盛的η值接近于1,意味着测得的吸光度值接近于同质量浓度标准品的吸光度值,也间接证明上海欣博盛公司的ELISA抗体可用于大肠埃希菌表达系统生产的rhBMP-2特异性吸附。而另外2家极低的η值表明,它们的抗体无法有效地捕获大肠埃希菌系统生产的rhBMP-2蛋白,原因可能与不同抗体的结构和特性不同有关。
将圆二色谱图经CDNN 2.1 软件解析,得到不同厂家第1 抗体的二级结构元件含量。如表1 所示:润裕抗体和欣博盛抗体的结构较相似,98%以上的结构均为螺旋构型,其余为少量的β-折叠构型。其中润裕抗体的结构略复杂一些,还含有少量的正向平行构型和无规则卷曲构型。而派普泰克抗体的二级结构更为复杂,无规卷曲的成分最多,达到45.0%,其余成分则由螺旋、反向平行、正向平行和β-折叠构型构成。基于此,后续的实验和比较均选用欣博盛抗体。

图2 瑞邦自制rhBMP-2 的碱性磷酸酶(ALP)活性(A)和用不同厂家试剂盒检测的η值(B)Fig.2 Alkaline phosphatase (ALP) activity of recombinant human bone morphogenetic protein-2 (rhBMP-2) with different concentrations (A) and η value calculated by the measured data from different enzyme-linked immunosorbent assay(ELISA)kits(B)
2.2 微流芯片表面的亲疏水特性
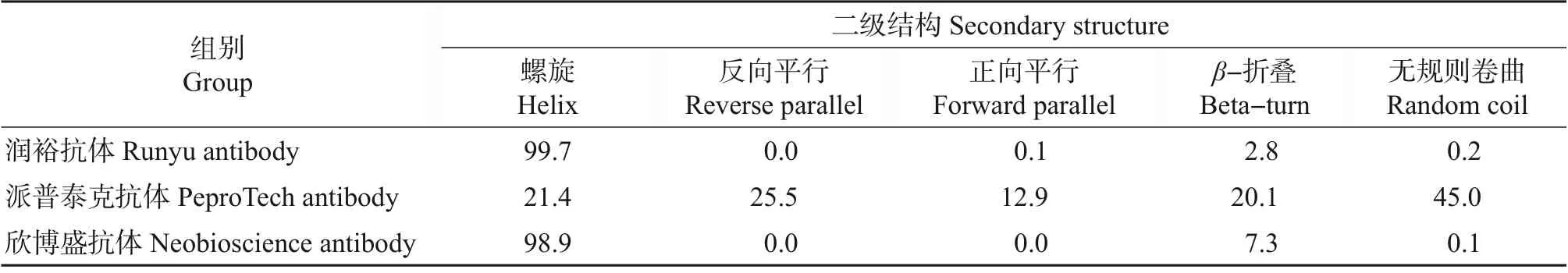
表1 不同抗体的二级结构元件含量比较Table 1 Comparison of the secondary structure contents of different antibodies %

图3 不同等离子体处理功率下微流芯片表面的接触角对比Fig.3 Comparison of contact angles on the microfluidic chip surfaces treated with different plasma powers
能是由于等离子体在材料表面除了引入亲水基团外,还会对表面进行刻蚀作用,功率越大导致刻蚀程度越高,表面越粗糙,进而使得接触角增大。
2.3 第1 抗体吸附情况的比较
图4比较了不同等离子体功率处理后的表面对第1 抗体的吸附效果。可以看出:在未控制湿度的干燥环境中,未处理表面和实验组表面的荧光强度都非常弱,很难分辨出检测区的边界,仅在检测孔内有少许分散的荧光点,但由于这些荧光点分散不均且数量太少,因此,无法根据该实验结果优化等离子体处理的功率和处理时间。这与试剂用量过少(2µL)有关,在没有调控湿度的情况下溶剂非常容易挥发,使得孵育过程中因试剂的挥发而提前终止。在表面皿内添加湿纸巾以控制湿度的环境中,未处理表面的荧光强度仍然很弱,但是实验组的荧光强度明显优于未处理表面,能够清晰地分辨出检测孔的边界。这意味着等离子体处理可以增强第1抗体在表面的吸附。同时也说明在湿润情况下,可以有效地缓解试剂的挥发,保证孵育时间,使得实验顺利进行。随着处理功率的增大,荧光强度增强,即吸附在表面的抗体逐渐增多,其中,处理功率100 W、处理时间30 s时第1抗体的吸附效果最好。
2.4 微流芯片表面在ELISA 不同反应阶段的特性比较

图4 干燥和湿润情况下不同微流芯片表面对第1抗体的吸附效果比较Fig.4 Comparison of the first antibody absorption on the microfluidic chip surfaces treated with different plasma powers under dry and humid conditions
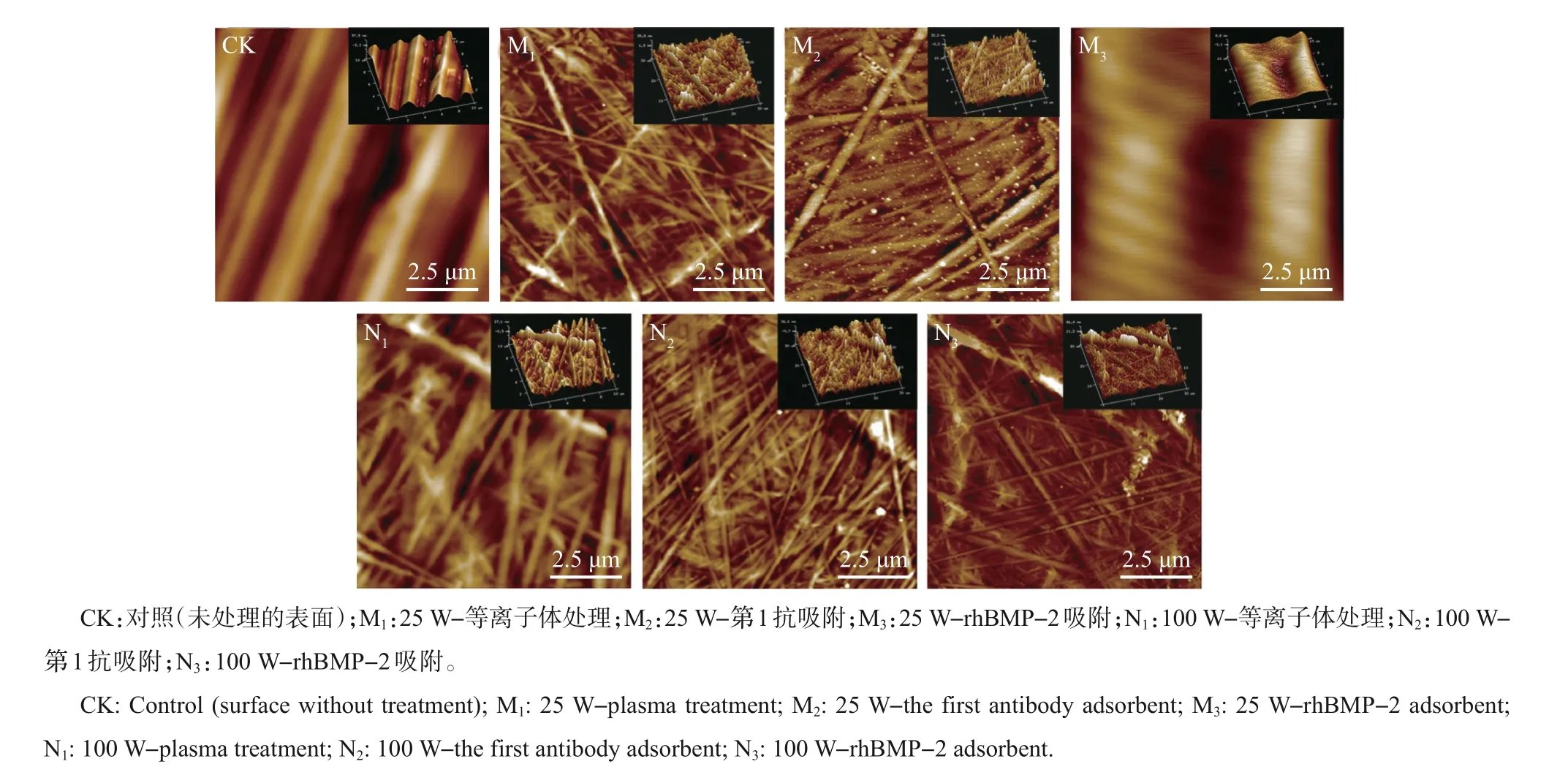
图5 微流芯片表面在ELISA的不同反应阶段的表面形貌比较Fig.5 Comparison of surface morphologies of microfluidic chip at different ELISA stages
图5比较了微流芯片表面在ELISA不同反应阶段的原子力显微镜图像。可以看出:未处理的对照组表面具有平行但间距及深度不匀的沟壑;处理功率为25 W时,处理后的表面变为不规则的突起,存在一定的刻蚀作用,随着第1抗体和rhBMP-2的特异吸附,表面突起渐渐变得不太尖锐;处理功率为100 W时,表面的沟槽和突起更为明显,表面粗糙度更高,证实了这种功率处理下表面亲水性较差。横向比较的结果也表明,每个反应阶段的表面粗糙度均发生了明显变化,间接证实了不同阶段反应在表面的顺利进行。
图6比较了ELISA不同反应阶段微流芯片表面含N 量的变化。可以看出:未处理微流芯片表面(CK)不含有N元素;如N1曲线所示,等离子体处理后,样品表面带有氨基,N元素增加;如N2曲线所示,N元素含量再次增加,证明第1抗体成功地特异吸附到微流芯片表面;N3曲线中N元素的强度增加显著,证实了rhBMP-2分子也成功地连接到样品表面。
2.5 采用微流芯片-ELISA 测定的rhBMP-2 的质量浓度曲线
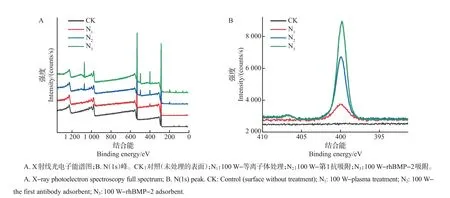
图6 微流芯片表面在ELISA不同反应阶段的元素表征比较Fig.6 Characterization comparison of surface elements of microfluidic chip at different ELISA stages
图7 展示了不同质量浓度rhBMP-2 在微流芯片检测孔表面的ELISA荧光显色情况。可以看出:当rhBMP-2 的质量浓度为0 pg/mL 时,检测区内的荧光强度非常低;随着rhBMP-2 质量浓度的增大,检测区的颜色愈加明亮,检测区内外差异愈加明显,意味着微流芯片检测孔内的ELISA荧光强度与体系中rhBMP-2的质量浓度呈正相关。
使用Image J 1.8.0软件对图片的荧光强度进行分析,计算出孔内的平均光密度,并使用ELISA Calc软件将浓度与平均光密度的关系作线性拟合。如图8所示:改性微流芯片孔内平均光密度与rhBMP-2的质量浓度呈线性关系,线性拟合的R2值为0.993,线性区间为0~2 000 pg/mL;与之不同的是,采用欣博盛的96孔板,rhBMP-2的线性区间为0~250 pg/mL。
2.6 微流芯片-ELISA 与传统ELISA 对比
由表2可知,与传统ELISA相比,所制得的微流芯片-ELISA 试剂用量约为传统试剂用量的2.7%,显著减少了试剂用量和成本。
3 结论
如前所述,市售ELISA试剂盒虽然具有良好的敏感性和特异性,但时间成本和试剂成本较高。本文将微流控检测技术与ELISA相结合,在保持ELISA高敏感性和特异性的情况下,还具有以下优点。
1)抗体蛋白的吸附效率与材料表面的亲水性、粗糙度等有着紧密关系:氨气等离子体处理功率较大时(100 W),亲水性较差,但表面粗糙度较大,表面积增大,抗体的吸附效率反而增大。

图7 改性微流芯片对不同质量浓度rhBMP-2的ELISA荧光显色对比Fig.7 Fluorescence comparison of rhBMP-2 with different concentrations using modified microfluidic chip
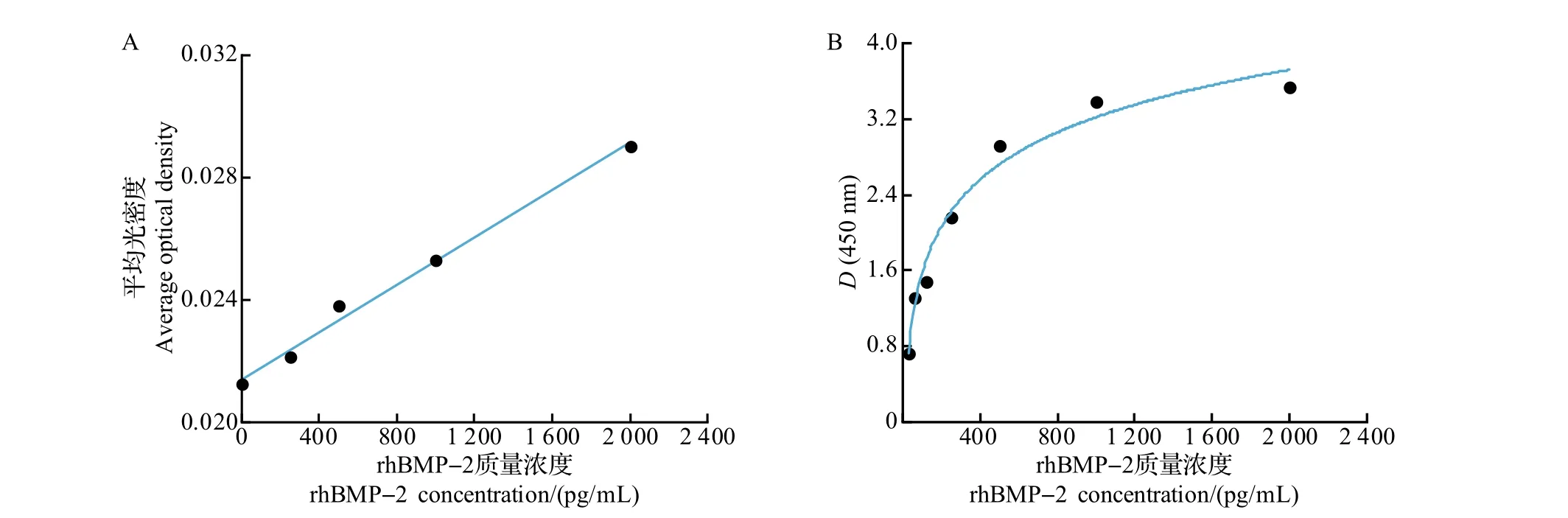
图8 改性微流芯片(A)和欣博盛96孔板(B)的rhBMP-2 ELISA标准曲线对比Fig.8 Comparison of standard ELISA curves of rhBMP-2 using the modified microfluidic chip(A)and the standard 96-well plate(B)
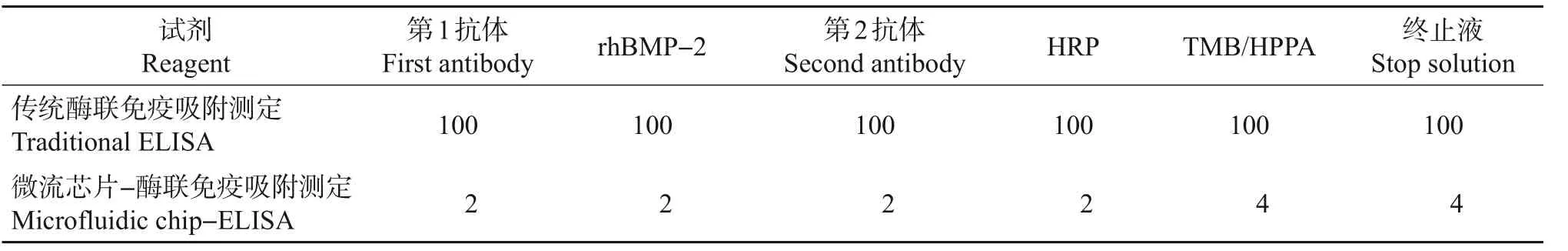
表2 微流芯片-ELISA与传统ELISA试剂用量对比Table 2 Comparison of the reagent consumption using microfluidic chip-ELISA and traditional ELISA kits µL
2)采用100 W、30 s 氨气等离子体处理微流芯片表面后,可以有效地检测出rhBMP-2 质量浓度。相比传统96孔ELISA法的试剂用量600 μL/样品和线性区间0~250 pg/mL,微流芯片-ELISA 方法使试剂用量减少约97.3%,而其线性范围却拓展为0~2 000 pg/mL。
综上所述,等离子体-蛋白A 的靶向修饰通过调控抗体的特异吸附方向显著提高了rhBMP-2 抗体的吸附效率,拓展了线性检测范围,降低了试剂成本。该修饰技术同样适用于目前ELISA 检测所涉及的众多领域,在医疗诊断、食品安全及环境检测等中具有广泛的应用潜力。

