慢性牙周炎对c57小鼠认知能力的影响
童钰鑫 肖新莉 安莹 张佳喻 石旭妍 王旭 陈悦
1.陕西省颅颌面精准医学研究重点实验室 西安 710032;2.陕西省牙颌面疾病临床研究中心 西安 710032;
3.军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔生物工程技术研究中心,空军军医大学口腔医院牙周病科 西安 710032;
4.西安交通大学医学院 西安 710061;
5.西安交通大学口腔医院牙周黏膜科 西安 710004
牙周炎是一种以菌斑微生物为始动因素的慢性感染性疾病,在成年人中的发病率达50%以上,临床表现包括牙龈炎症和出血、牙周袋形成、牙槽骨吸收、牙齿松动和移位。牙周炎造成的牙齿脱落是成人失牙最主要的因素;中、重度牙周炎患者牙周袋内溃疡面积总数可达72 cm2,能够引起全身低炎症状态,影响全身健康,增加疾病易感性或导致已有全身性疾病(包括糖尿病、心血管疾病、神经退行性疾病等)发展[1]。
牙周炎可能通过系统循环、神经旁路两种途径作用于大脑[2],影响中枢神经系统稳态,加速神经退行性疾病的发生和进展。血液循环中的细胞因子影响血脑屏障(blood-brain barrier)的渗透性,激活胶质细胞,进一步升高炎症因子水平;当胶质细胞处于激活状态(老龄、炎症状态)时,将扩大已有炎症。神经旁路途径指外周炎症因子作用于传入纤维,导致脑内细胞炎症因子水平升高,如迷走神经、舌咽神经与三叉神经等[3]。
阿尔兹海默症(Alzheimer's disease)是发生于中枢神经系统的慢性进行性神经退行病变,临床表现主要为认知功能减退、非认知精神行为症状和日常社会生活功能减退,是一种不可逆的慢性致死性疾病,病因不清,目前尚无有效治疗方法,所以早期预防十分重要[4]。流行病学研究[5]发现,对于患阿尔兹海默症不一致的同卵双胞胎,牙缺失增加阿尔兹海默症的患病风险;1项为期32年的队列研究[6]发现,缺牙率增加、牙周袋深度增加、牙槽骨高度降低都与认知能力下降相关。相关流行病学研究提出,牙周炎是阿尔兹海默症的危险因素,认知障碍作为阿尔兹海默症早期且标志性的临床症状,牙周炎与认知障碍的直接相关性尚需进一步探讨。
本研究通过建立动物模型,探究牙周炎对认知能力的影响,研究牙周炎与认知障碍的关系,为探索牙周炎与阿尔兹海默症发生的关系奠定基础,以期未来能够通过预防或治疗牙周炎来预防或减缓认知障碍乃至阿尔兹海默症的发生、发展。
1 材料和方法
1.1 实验动物及分组
雌性c57小鼠20只,2~3月龄,体重(20±2)g,由西安交通大学医学院无特定病原体(specific pathogen free)动物实验中心提供,饲养在温度(22±1)℃、相对湿度60%±5%、12 h明暗交替(7: 00,19: 00)的通风干燥环境,标准化饮食适应性饲养1周后开始实验。采用随机数字表法将动物分为2个组(每组10只):1)对照组;2)实验组,即牙周炎动物模型组。实验组小鼠接受1 g·L-1脂多糖3 μL(055:B5大肠埃希菌;Sigma公司,美国)。
1.2 动物模型的建立
实验组小鼠采用4%水合氯醛腹腔注射麻醉(剂量为0.01 mL·g-1),微量注射器于上颌右侧第一、二磨牙腭侧牙龈乳头内朝向牙槽嵴顶处进针,注射时黏膜发白,无明显渗出(3 min完成注射),药物注射完成后微量注射器在局部留置1 min。注射共计13次,每3 d注射1次,共计39 d。对照组不干预。
1.3 Morris水迷宫认知能力检测
建模后第1 d进行Morris水迷宫实验。首先每只小鼠分别进行游泳实验,筛除不会游泳的小鼠,减少各组小鼠的组间差异,结果每只小鼠均能够完成游泳任务。水迷宫由1个直径120 cm,高50 cm的圆形水池构成,盛水30 cm深,水温设置为(25±2)℃,将迷宫从图像上平均分为4个象限,将直径8 cm的平台随机置于1个象限(第4象限)中间位置水平面下1 cm处,在水中均匀撒入二氧化钛粉末,确保小鼠不能看见平台。参考Vorhees描述的方法,每天上午9点开始实验。
第1~5 d进行定位航行实验。小鼠从不同象限入水到找到平台的时间记为潜伏期,60 s内找不到平台的小鼠的潜伏期记为60 s;同时放于平台上适应15 s。每只小鼠每天从4个象限各需进行1次潜伏期测定实验,取4个象限潜伏期的平均值,评估小鼠的学习能力。同时,测定小鼠在潜伏期内在外环(筒外壁内20 cm范围)停留的时间,取小鼠从4个象限入水后在内环内的游泳时间的平均值,评估小鼠的趋触性,反映小鼠的焦虑状态。
第6 d进行空间搜索实验。将第4象限内的隐藏平台撤去,各组小鼠分别从第2象限入水,记录小鼠在60 s内在第4象限停留的时间,记算各组每只小鼠在第4象限的滞留时间百分比(即第4象限停留时间在60 s内所占百分比)。通常正常的小鼠会花35%~40%甚至更多的目标象限时间。同时,记录小鼠在60 s内的游泳轨迹长度,计算小鼠的游泳速度。
1.4 标本制备
水迷宫实验结束当天,用多聚甲醛灌注处死小鼠(每组5只),剥取全脑制备冰冻切片(厚度40 μm),漂片法进行尼氏染色;同时,取小鼠上颌骨进行MicroCT,随后颌骨标本进行石蜡切片制备,苏木精-伊红(hematoxylin and eosin,HE)染色。摘除小鼠双侧眼球后取全血(每组5只),置于5 mL Eeppendorf管内,室温静置30 min,低温离心机离心(4 ℃,3 000 r·min-1,20 min)后取上清液,供酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)备用;颈椎脱位处死后,即刻冰上剥取双侧海马,加入样品稀释剂100 μL后,海马组织匀浆,离心去除沉淀,ELISA备用。
1.5 海马CA3区尼氏体、神经元观察
使用光学显微镜观察海马CA3区尼氏体、神经元形态变化,统计相应区域神经元数量并拍照记录。使用放大40倍的物镜,在420 μm×320 μm视野中进行神经元计数。
1.6 牙槽骨吸收情况观察
在多聚甲醛固定后,修剪小鼠上颌组织,将样本置于Micro-CT系统的检测试管内,三维扫描,获取小鼠右侧上颌骨第一、二磨牙之间的影像,并重建小鼠上颌骨三维模型,观察骨表面吸收情况。扫描参数:扫描分辨率144.0 μm,管电压90 kV,管电流88 μA,曝光时间 200 ms,图像分辨率1 024×1 024。测量如下公式中的参数并按公式计算牙槽骨丧失高度。

式中,a为第二磨牙腭侧中间位点牙槽骨丧失垂直高度;b为第二磨牙腭侧近中位点牙槽骨丧失垂直高度;c为第一磨牙腭侧远中位点牙槽骨丧失垂直高度;d为第一磨牙腭侧中间位点牙槽骨丧失垂直高度。
MicroCT结束后,进行石蜡切片制作,HE染色后使用光学显微镜观察小鼠右侧上颌第一、二磨牙间脂多糖注射区域牙周组织炎症状态,参照文献[7]方法进行破骨细胞计数:细胞核数目≥3为破骨细胞标志,使用放大40倍的物镜,对每个随机视野中的破骨细胞进行计数。每个样本选择3张玻片,每张玻片随机选择3个视野,计数后取平均值。结果以每张玻片细胞数表示。
1.7 血清及海马匀浆中白细胞介素(interleukin,IL)-1β含量
按照产品说明书的步骤,使用ELISA测定血清及海马组织IL-1β的含量。
1.8 统计分析
各实验的数据以平均值±标准差表示,采用SPSS 18.0软件包进行统计学分析。Morris水迷宫定位航行实验潜伏期及趋触性的数据使用重复测量的方差分析法分析;Morris水迷宫空间搜索实验目标象限停留时间百分比、尼氏染色神经元计数、MicroCT牙槽骨吸收高度、HE染色破骨细胞计数、血清及海马匀浆中IL-1β含量采用单因素方差分析法分析。P<0.05差异有统计学意义。
2 结果
2.1 Morris水迷宫学习相关行为学测试
2.1.1 定位航行实验潜伏期测定结果 球形检验后,不认为2个组5 d重复测量的数据间存在高度的相关性(P=0.337),直接进行重复测量的方差分析。数据分析结果显示,时间因素的差异有统计学意义(P<0.000 1),结合折线图(图 1),2组小鼠的潜伏期随实验天数的增加而缩短,说明随训练天数的增加,各组的潜伏期随时间逐渐缩短的趋势相同(P=0.788)。分组主效应(脂多糖注射)的结果说明,实验组小鼠的潜伏期较对照组明显增加,学习能力损伤(P<0.000 1)。
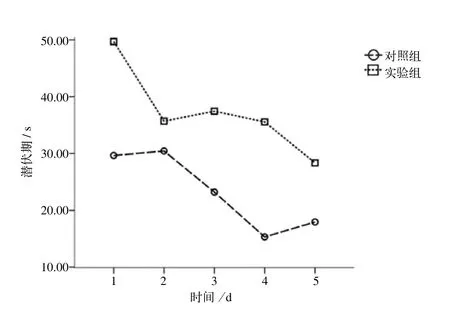
图1 不同组别小鼠水迷宫潜伏期结果Fig 1 Results of Morris water maze latency in different groups of mice
2.1.2 定位航行实验趋触性测试结果 首先通过球形检验判断重复测量数据之间是否存在相关性,不认为2个组5 d重复测量的数据间存在高度的相关性(P=0.123),进行重复测量的方差分析时不需要校正。数据分析结果结合折线图(图2),显示2个组小鼠的趋触性基本随实验天数的增加而缩短(P<0.000 1)。时间和分组交互作用结果说明,随训练天数增加,2个组趋触性均呈逐渐缩短的趋势(P=0.136)。实验组小鼠趋触性较对照组增加,说明实验组小鼠恐惧焦虑感增高(P<0.000 1)。
2.1.3 空间搜索实验目标象限停留时间百分比 实验组与对照组小鼠的目标象限停留时间百分比分别为31.2%和38.9%,使用方差分析进行各组数据的比较,两组间差异无统计学意义(P=0.119,方差齐性检验P=0.751,方差齐)。
2.1.4 空间搜索实验游泳速度 在第6 d的空间搜索实验中,分析各组小鼠的游泳速度(反映游泳能力)。实验组与对照组小鼠的游泳速度分别为152.8和151.3 mm·s-1,两组间差异无统计学意义(P=0.783;方差齐性检验P=0.143,方差齐),表明各组小鼠不因游泳速度的不同而导致定位航行实验潜伏期的不同。
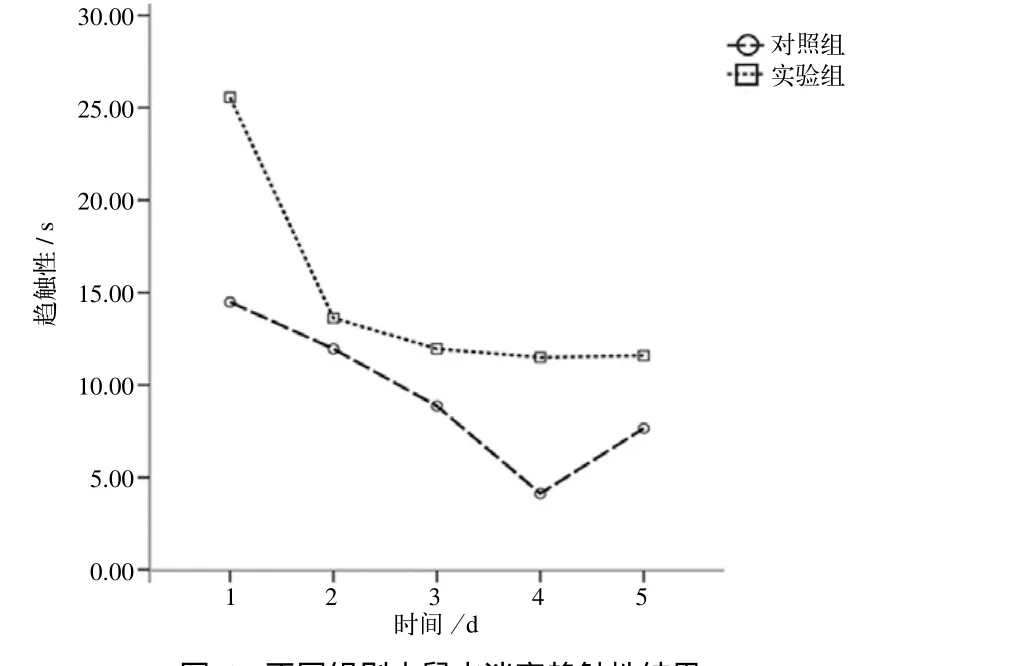
图2 不同组别小鼠水迷宫趋触性结果Fig 2 Results of Morris water maze thigmataxis in different groups of mice
2.2 尼氏染色结果
尼氏染色观察实验组小鼠海马神经元形态改变,并统计海马CA3区神经元数量。实验组小鼠海马尼氏体、神经元数量较对照组明显减少,排列层次减少,部分细胞出现深染、细胞核固缩,细胞间隙增大(图3)。
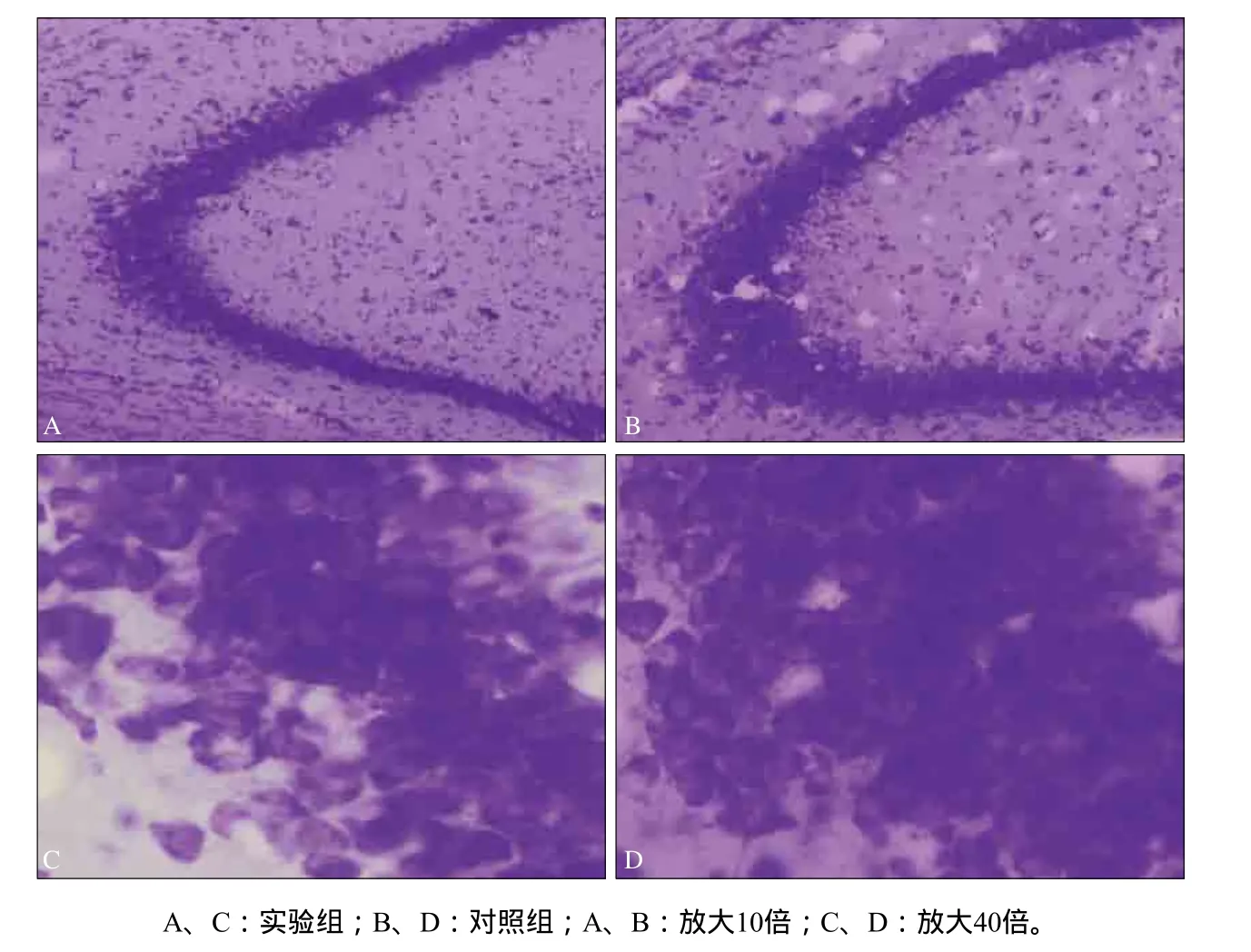
图3 小鼠海马尼氏染色形态观察Fig 3 Nissl's staining morphology of mice hippocampus
实验组与对照组海马CA3区的神经元数量分别为36.8与60.2个,实验组较对照组海马CA3区神经元数量明显减少(P=0.001;方差齐性检验P=0.130,方差齐)。
2.3 牙槽骨吸收情况
2.3.1 MicroCT检查 通过MicroCT三维重建图(图 4),观察脂多糖注射建模部位牙槽骨吸收情况。发现实验组右侧上颌第一、二磨牙腭侧牙槽骨之间有明显的水平形骨吸收区域,且牙槽骨高度低于对照组。测量并计算出实验组及对照组的牙槽骨丧失垂直高度分别为0.236和0.158 mm;单因素方差分析显示,与对照组相比,实验组牙槽骨丧失垂直高度增加(P=0.006)。
2.3.2 HE染色结果 组织病理学观察可见,实验组牙周组织破坏,牙槽骨吸收,炎性细胞浸润,破骨细胞出现,如图5所示;实验组与对照组破骨细胞数分别为3.18与1.62个,实验组较对照组破骨细胞数显著增多(P=0.006)。

图4 慢性牙周炎动物模型MicroCT三维重建图Fig 4 Three dimensional reconstruction of MicroCT in periodontitis model of mice
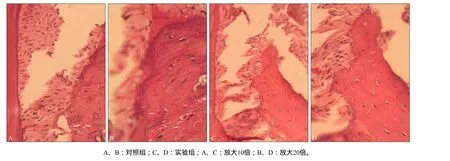
图5 HE染色观察牙槽骨吸收情况Fig 5 Observation of alveolar bone absorption with HE staining
2.4 血清及海马内IL-1β测定结果
实验组与对照组血清内IL-1β水平分别为30.6和9.8 ng·L-1,实验组较对照组升高(P=0.007;方差齐性检验P=0.116,方差齐);实验组与对照组海马内IL-1β水平分别为2 918.6和3 133.4 ng·L-1,两组间差异无统计学意义(方差齐性检验P=0.329,方差齐)。
3 讨论
菌斑微生物作为引发慢性牙周炎的始动因子,是造成牙周组织破坏的必需因素。在牙周炎进展阶段,龈下环境中的非附着性龈下菌斑生物膜与牙槽骨快速破坏、牙周炎的发生及发展密切相关。脂多糖是革兰阴性厌氧菌细胞壁外膜中独有的高活性致病物质,对牙周组织具有毒性、抗原性,是牙周炎发病过程导致牙龈组织破坏及牙槽骨吸收的主要致病物质[7]。
本研究通过脂多糖口腔内局部注射的方法,建立慢性牙周炎动物模型[8]。相关研究[9]发现,脂多糖牙周组织注射模型与牙周炎病理学改变相似。将大肠埃希菌和牙龈卟啉单胞菌注射于颅部皮下组织后,局部骨质溶解,诱导全身炎症反应,且大肠埃希菌来源的脂多糖诱导的全身炎症反应较牙龈卟啉单胞菌严重[10]。Moriyama等[11]发现,大肠埃希菌脂多糖局部注射后引起的骨吸收存在作用峰值(注射第16次时),高浓度注射组引起的骨质破坏较多;注射一定时间后,牙槽骨呈现“破坏修复”现象;当脂多糖注射停止后,引起的骨吸收立即随时间逐渐减弱。
牙周炎是全身系统性疾病的危险因素,可能通过增加血液中炎症因子,透过血脑屏障同时刺激管周细胞产生其他信号因子(如IL-1β、一氧化氮、前列腺素等),激活胶质细胞,促进脑内促炎细胞因子的产生,包括IL-1β、IL-6和肿瘤坏死因子α,升高炎症因子的表达,扩大已有炎症,加速诱导神经退行性疾病[12]。研究[13]发现,牙龈卟啉单胞菌特异的牙龈蛋白酶在阿尔兹海默症的发生、发展中起到重要作用,并且通过动物研究证实,使用牙龈蛋白酶抑制剂COR388能够起到保护小鼠大脑神经元的作用,抑制细菌生长,降低淀粉样蛋白沉积。
研究[14]发现,脂多糖静脉注射建立内毒素休克大鼠模型,1~4 h对脑组织和血清样本进行分析发现,脂多糖注射能够激活核因子-κB通路,导致脑损伤;侧脑室单次注射脂多糖1、2和4 d后,激活脑室周围的脑实质内的星形胶质细胞,可能参与脑内的免疫调节和保护性反应。国内外现有研究多数集中在脂多糖大剂量注射后短期对脑组织内相关蛋白质表达的影响,尚缺乏脂多糖口腔局部多次注射建立牙周炎动物模型后,观察对脑认知功能的影响。相关的临床研究指出,在非阿尔兹海默症人群的脑组织中也有淀粉样蛋白的沉积,相较于在细胞、分子水平的研究,关注人群行为学的改变更具有临床借鉴意义。
本研究直接使用脂多糖口腔内低剂量长期注射法建立慢性牙周炎动物模型,通过Morris水迷宫检测啮齿类动物海马依赖性空间学习和长期空间记忆行为。结果发现,实验组小鼠潜伏期明显增加,学习能力损伤,同时趋触性增加,说明脂多糖诱导的牙周炎可降低小鼠空间学习能力,增加小鼠的恐惧焦虑感。同时,采用尼氏染色法观察CA3区锥体细胞减少和萎缩情况,海马CA1区和CA3区锥体细胞减少和萎缩与学习、记忆能力下降有关[15]。
IL-1β与牙周炎、阿尔兹海默症的发生及发展密切相关。在牙周炎症进展期,血清IL-1β水平较非进展期高;通过牙周治疗可以降低IL-1β水平。结合基因多态性的研究[16]发现,IL-1B+3953等位基因Ⅱ(与IL-1β的高表达有关)在牙周炎和侵袭性牙周炎患者中检出率显著高于正常对照组。IL-1β在中枢神经系统内能激活小胶质细胞以及星形胶质细胞,产生其他的致炎因子以及趋化因子[17]。离体研究和动物实验[18]发现,小胶质细胞识别和吞噬可溶性淀粉样蛋白后被激活,能够释放炎性细胞因子和趋化因子IL-1β。阿尔兹海默症患者及阿尔兹海默症动物模型的脑脊液及脑组织中IL-1β水平升高[19]。
本实验通过检测海马与血清中IL-1β的水平,研究了慢性牙周炎的存在对全身免疫与海马组织内免疫功能的影响,结果发现实验组中血清IL-1β含量显著高于对照组,两组海马内IL-1β含量无显著差异,提示脂多糖诱导的牙周炎能引发全身炎症反应,但这种全身免疫激活对海马内IL-1β水平无影响,与笔者的实验预期不符。这可能与IL-1β的检测时机以及脑内小胶质细胞所处的激活状态相关。
IL-1β可作为一种多效因子,在阿尔兹海默症的炎症机制中发挥重要作用。慢性系统炎症可能会引发阿尔兹海默症脑内神经炎症状态,导致小胶质细胞激活,释放炎性细胞因子和趋化因子IL-1β[20]。阿尔兹海默症患者及阿尔兹海默症小鼠模型的脑脊液及脑组织中IL-1β水平升高[20]。中和IL-1β则能减轻阿尔兹海默症小鼠的P-tau沉积量及认知恢复[20]。同时IL-1β具有双向性,在脑内还可能起到保护作用。Cherry等[21]将人IL-1β cDNA导入APP/PS1小鼠海马后,IL-1β诱导Arg1+小胶质细胞上调,淀粉样蛋白沉积减少,提出炎症因子能够激发抗炎反应,局部IL-1β产生后,能够募集Th2细胞,改善炎症。离体实验[22]发现,IL-1β介导的炎症反应能够减少淀粉样蛋白累积,可能存在神经保护作用。本研究中海马内IL-1β水平可能与IL-1β的检测时机以及脑内小胶质细胞所处的激活状态相关。
因为在预实验阶段发现空白对照组与生理盐水口内注射组的行为学表现无明显差异,本实验采用了空白对照。同时,王秀秀[23]通过建立动物模型发现,短期内重复多次腹腔注射小剂量水合氯醛对大鼠认知功能无明显影响,排除了本实验通过全身多次注射水合氯醛麻醉对小鼠认知能力的影响。
研究发现牙周炎的存在能够影响动物的空间学习能力。在阿尔兹海默症早期的认知障碍阶段,控制牙周炎可能会缓解认知障碍加重,为预防或延缓阿尔兹海默症提供可能。但是,为了增加实验的可比性,在进一步的实验中应该加入注射生理盐水作为对照组,使结果更具基线可比性;在现有研究的基础上,加入对胶质细胞、肿瘤坏死因子α等炎症通路上关键细胞和细胞因子表达的研究,对相关机制进行进一步的探索。

