骨保护素/核因子κB受体活化因子配体影响肺癌细胞下颌骨与股骨转移差异的初步研究
付世锦 曾刊 李鑫 杨静 汪成林 叶玲
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心
四川大学华西口腔医院牙体牙髓病科 成都 610041
颌骨溶骨性病变是口腔诊疗过程中常见的疾病表现形式,如慢性根尖周炎、颌骨骨髓炎、颌骨肿瘤等。在临床诊疗工作中可以发现,颌骨原发性肿瘤类型多样,而颌骨转移性肿瘤却相对少见。一旦发生颌骨转移性肿瘤,往往意味着原发灶的播散或复发,预后较差,多数患者在确诊后数月死亡[1]。在颌骨转移性肿瘤中,又以下颌骨的后牙区及下颌升支区常见[2],如何正确鉴别诊断肿瘤骨转移导致的下颌骨溶骨性改变,避免误诊及延误病情,对于口腔医生非常重要。
易发生骨组织转移的恶性肿瘤主要包括肺癌、乳腺癌及前列腺癌等[3]。其中,肺癌是全球范围内发病率(11.6%)和死亡率(18.4%)最高的恶性肿瘤[4],且尸检结果显示高达50%的肺癌死者伴有骨转移[5]。肺癌细胞骨转移的特征之一是呈现明显的部位特异性差异。有报道显示,脊柱、股骨、肋骨和胸骨的骨转移发生率分别为50%、25%、12%[6],而下颌骨鲜少发生骨转移[7]。此外,家族性巨颌症[8]、甲状旁腺颌骨肿瘤综合征[9]及双膦酸盐相关性颌骨坏死[10]等骨组织疾病仅见报道于颌骨而未见于其他骨组织,提示局部骨组织微环境可能参与调控部位特异性骨疾病的发生、发展。
肿瘤骨转移引起骨破坏的实质是肿瘤细胞入侵局部骨微环境并破坏其稳态[11]。在正常状态下,骨组织中骨形成和骨吸收之间存在动态平衡;在发生肿瘤细胞骨转移时,肿瘤细胞的入侵破坏了局部骨稳态,从而引起骨破坏。肿瘤细胞骨转移的过程受到诸多因素影响,除循环系统分布差异外[12],局部骨微环境至关重要。基于肿瘤细胞转移经典的“种子土壤学说”[13],在骨转移过程中转移瘤细胞与骨微环境相互作用,形成“恶性循环”,从而引起肿瘤细胞定植与骨破坏[14-15]。肿瘤细胞分泌的生长因子可促进成骨细胞表达核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),其与位于破骨细胞表面的核因子кB受体活化因子(receptor activator of nuclear factor-кB,RANK)结合,激活破骨细胞的分化、成熟,促进骨吸收[16];同时,产生多种生长因子,促进肿瘤增殖。增殖的肿瘤细胞进一步促进成骨细胞表达RANKL,扩大破骨效应,形成肿瘤骨转移的“恶性循环”[17-18]。骨保护素(osteoprotegerin, OPG)是由成骨细胞表达、分泌的RANKL诱导受体[16],与RANK竞争性地结合RANKL,抑制破骨细胞活化,从而起到骨保护作用。作为破骨细胞活化的重要调节因素,OPG/RANKL在肿瘤细胞骨转移过程中发挥重要作用[17-20],而OPG/RANKL是否参与调控肺癌细胞骨转移部位差异目前尚不清楚。
基于此,本实验通过构建肺癌细胞骨转移小鼠模型,选择下颌骨和股骨作为临床上骨转移低发和高发的代表性骨组织,检测肺癌细胞骨转移差异发生的骨组织中OPG/RANKL表达情况及破骨细胞活化情况,探讨其是否参与调控肺癌细胞骨转移部位差异,以期为部位特异性骨疾病的发病机制与防治研究提供新的思路。
1 材料和方法
1.1 主要仪器和试剂
μCT50-MicroCT(SCANCO Medical AG公司,瑞士);NanoDrop紫外分光光度计(Thermo Fisher Scientific公司,美国);小鼠Lewis肺癌(Lewis lung cancer cell,LLC)细胞(四川大学口腔疾病研究国家重点实验室保存); Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM;Hyclone公司,美国);胎牛血清(Gibco公司,美国);青霉素-链霉素混合溶液(penicillin-streptomycin solution,PS;Hyclone公司,美国);磷酸盐缓冲液(phosphate buffer solution,PBS;Hyclone公司,美国);Trizol试剂(Invitrogen公司,美国);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(上海碧云天生物技术有限公司);组织蛋白酶K(cathepsin K,CTSK)一抗(ab19027;Abcam公司,美国);山羊抗兔免疫球蛋白H&L(HRP)二抗(ab7090;Abcam公司,美国);抗兔HRP-3,3'-二氨基联苯胺四盐酸盐(3,3',4,4'-biphenyltetramine tetrahydrochloride,DAB)免疫组化试剂盒(CTS005,R&D公司,美国);逆转录试剂盒、定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒(Takara公司,日本);乙二胺四乙酸二钠盐(ethylenediaminetetraacetic acid disodium salt,EDTA;分析纯,成都市科龙化工试剂厂);小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、OPG、RANKL引物(上海生工生物工程公司)。
1.2 方法
1.2.1 肺癌细胞骨转移动物模型构建 细胞培养:小鼠LLC细胞在5% CO2、37 ℃培养箱中培养,培养液为含10%胎牛血清和1% PS的DMEM高糖培养基。处于指数生长期的LLC细胞经PBS洗涤2次后,用0.25%的胰蛋白酶消化后离心,稀释为合适浓度的LLC细胞PBS悬浮液备用。
全身性肺癌细胞骨转移模型构建:40只6~8周龄的C57BL/6小鼠在无特定病原体(specefic pathogen free,SPF)条件下饲养1周适应后,随机分为2组,实验组尾静脉注射1×107mL-1LLC细胞PBS悬浮液100 μL,对照组尾静脉注射等量PBS。建模后第3、5、7、9周时,随机取3只实验组小鼠和3只对照组小鼠颈椎脱臼法处死,取双肺组织及双侧下颌骨和股骨组织进行后续分析。
股骨局部肺癌细胞骨转移模型构建:6只6~8周龄C57BL/6小鼠在SPF条件下饲养1周适应后,随机分为2组,实验组股骨干骺端注射1×106mL-1LLC细胞PBS悬浮液20 μL,对照组为同只小鼠对侧股骨干骺端注射等量PBS。建模2周后颈椎脱臼法处死小鼠,取实验组股骨组织和对照组股骨组织进行后续分析。
实验动物饲养及动物实验经四川大学华西口腔医院伦理委员会批准(WCHSIRB-D-2017-199)。
1.2.2 MicroCT检测溶骨性损伤 骨组织经4%多聚甲醛固定,隔夜后去除多余软组织,将骨组织固定于扫描管内,调整三维位置,使用μCT50-MicroCT进行扫描(扫描条件:65 kV、80 μA,分辨率为10 μm),检测骨组织是否有溶骨性损伤。
1.2.3 骨组织HE染色 骨组织经10% EDTA脱钙液脱钙4周及双肺组织经4%多聚甲醛固定后,用石蜡包埋,制作成5 μm厚石蜡切片,进行HE染色。采用常规二甲苯脱蜡,乙醇梯度水化,自来水充分冲洗,蒸馏水漂洗2次;苏木素染色5 min,自来水冲洗;盐酸乙醇分化30 s;1:400氨水返蓝1 min;80%、90%梯度乙醇脱水后,伊红染色2 min;100%乙醇脱水2次;二甲苯透明处理;中性树脂封片。
1.2.4 骨组织免疫组织化学染色 骨组织石蜡切片经常规二甲苯脱蜡、乙醇梯度水化后,PBS洗涤;0.4%胃蛋白酶进行抗原修复;按照免疫组织化学试剂盒说明书进行过氧化物酶、山羊血清、生物素、亲和素封闭;以抗原稀释液按1:100稀释CTSK一抗,4 ℃孵育组织过夜后,室温复温,PBS洗涤;加入生物素二抗37 ℃孵育60 min,PBS漂洗;滴加1~3滴辣根过氧化物酶(horseradish peroxidase)-链亲和素结合物孵育30 min,PBS漂洗;滴加DAB显色液,显微镜观察孵育至合适显色强度;苏木素染色,梯度乙醇脱水后,中性树脂封片。显微镜下采图、计算单位面积骨组织中CTSK阳性破骨细胞数目并进行统计分析。
1.2.5 骨组织差异表达基因检测 骨组织RNA提取:6~8周龄C57BL/6小鼠雌、雄各3只,取下颌骨、股骨组织,体视显微镜下去除牙齿、软组织等附属组织。在研钵里加入液氮,低温环境下研磨骨组织至粉末状,加入适量Trizol试剂,用酚-氯仿法提取骨组织,NanoDrop紫外分光光度计测定骨组织RNA浓度、纯度后备用。
骨组织转录组测序(RNA sequencing,RNA-seq)分析:一半新鲜下颌骨、股骨组织RNA送北京百迈客生物科技有限公司进行RNA-seq,用生物信息学方法分析OPG mRNA/RANKL mRNA比值在下颌骨与股骨中的差异。
骨组织实时定量聚合酶链反应(real time quantitative polymerase chain reaction,RT-qPCR)检测:剩余的下颌骨、股骨骨组织RNA逆转录成互补DNA(complementary DNA,cDNA)后,加入Takara RT-qPCR反应系统,以GAPDH基因作为内参物,目的基因mRNA相对表达量按公式2-ΔΔCt进行计算,检测骨组织中OPG mRNA/RANKL mRNA比值情况。GAPDH引物:上游5'-GCCTTCCGTGTTCCTACC-3',下游5'-AGAGTGGGAGTTGCTGTTG-3';OPG引物:上游5'-GTGAGGAAGGGCGTTACC-3',下游5'-TTTTGCGTGGCTTCTCTG-3';RANKL引物:上游5'-ATCGGGTTCCCATAAAGT-3',下游5'-CCAAAGTACGTCGCATCT-3'。
1.2.6 统计学分析 实验数据采自3次独立重复实验,以平均值±标准差形式表示,采用GraphPad Prism 6.01软件进行统计分析,组间比较采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 肺癌细胞骨转移在小鼠下颌骨与股骨中差异发生
小鼠尾静脉注射LLC细胞建模后第3、5、7、9周时,随机取3只实验组小鼠和3只对照组小鼠解剖取肺组织,发现从第3周起,实验组小鼠开始形成肺部散在黄白色结节,随着观察周数延长,肺部结节逐渐增多增大,而对照组小鼠肺部表面光滑(图1A)。对建模小鼠肺组织进行石蜡切片及HE染色观察,发现相较于对照组(图1B~D),实验组小鼠肺部结节内细胞核异质明显,随着观察周数延长,小鼠正常肺组织减少,核异质细胞明显增多(图1E~G),说明小鼠肺转移模型建立成功,为小鼠骨转移提供转移灶基础。
同时对12只实验组小鼠下颌骨及股骨进行取样,发现在建模第3、5、7周均未见骨转移;在第9周时有2只小鼠发生长骨(股骨及胫骨)转移而下颌骨未见骨转移,骨转移发生率为16.67%。进一步对发生股骨转移的小鼠进行MicroCT三维重建及HE染色分析,结果显示下颌骨未见明显骨破坏,而股骨及胫骨干骺端、生长板附近出现明显骨破坏(图2A),且松质骨与皮质骨均可发生溶骨性骨破坏(图2B)。进一步对下颌骨及股骨进行HE染色,实验组在股骨可观察到骨质破坏区髓腔内存在形态不一、核异质细胞,证实股骨骨质破坏区存在转移瘤细胞定植,而下颌骨未见转移瘤细胞定植(图2C)。上述结果表明,在全身性肺癌细胞骨转移小鼠模型中,相较于股骨,下颌骨不易发生肺癌细胞骨转移。
2.2 生理情况下正常下颌骨与股骨破骨细胞活化存在差异
选择下颌骨和股骨作为癌细胞骨转移低发和高发的代表性骨组织,破骨细胞标志物CTSK免疫组织化学染色结果(图3A~D)显示,股骨中CTSK阳性细胞主要分布在生长板及股骨头周围,较为集中(图3A、B);下颌骨中CTSK阳性细胞主要分布在牙槽骨及牙周膜周围,较为分散(图3C、D)。CTSK阳性破骨细胞数目统计分析(图3E)发现,下颌骨中单位骨面积破骨细胞数目显著低于股骨,差异有统计学意义(P<0.01)。

图1 尾静脉注射LLC细胞后小鼠肺转移灶形成Fig 1 Lung metastasis in mice by injection of LLC cells through tail vein
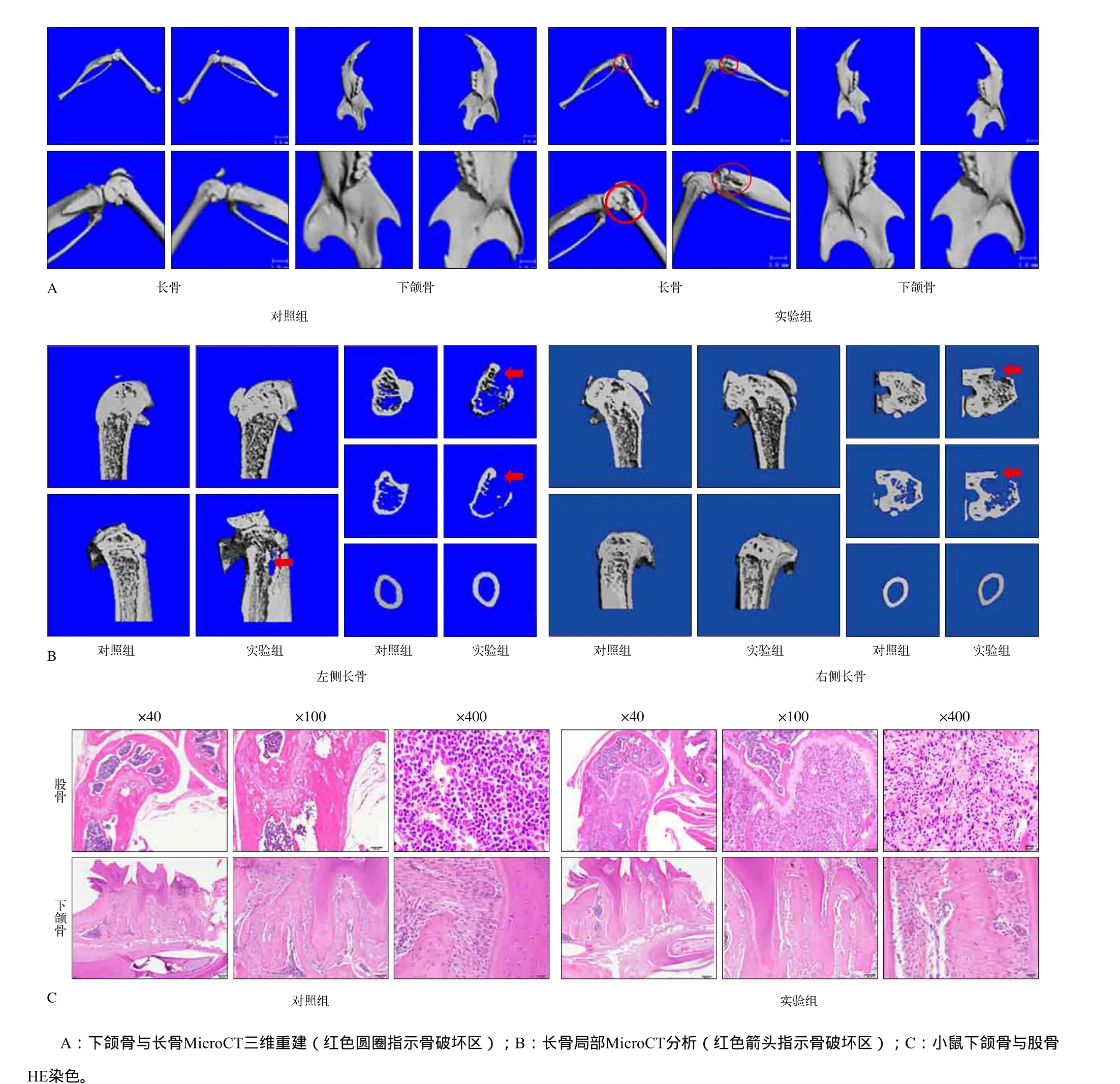
图2 全身性肺癌细胞骨转移小鼠模型中下颌骨与股骨中肿瘤细胞定植与骨破坏情况Fig 2 Tumor colonization and bone destruction occurred in mandible and femur in mouse model of systemic lung cancer cells bone metastasis
2.3 生理情况下正常下颌骨与股骨OPG mRNA/RANKL
mRNA比值存在差异
在生理情况下,正常小鼠下颌骨与股骨组织的RNA-seq数据(图4A)及统计分析结果(图4B)显示,下颌骨组织OPG mRNA/RANKL mRNA比值高于股骨(P<0.01)。RT-qPCR分析(图4C)进一步验证,生理情况下正常下颌骨与股骨OPG mRNA/RANKL mRNA比值存在差异,下颌骨OPG mRNA/RANKL mRNA比值高于股骨(P<0.05)。
2.4 发生肺癌细胞转移的骨组织中破骨细胞及OPG
mRNA/RANKL mRNA比值发生变化
股骨局部肺癌细胞骨转移模型的HE染色及MicroCT结果(图5A)显示,建模2周后,髓腔内出现肿瘤细胞定植,转移骨组织松质骨与皮质骨出现明显的溶骨性破坏。CTSK免疫组织化学染色结果(图5B~E)显示,发生溶骨性骨破坏的区域主要是CTSK阳性破骨细胞集中分布的股骨生长板及干骺端区域(图5D、E)。统计结果显示,发生肺癌细胞转移的骨组织区域破骨细胞数目明显多于对照组骨组织同一区域(图5F),差异具有统计学意义(P<0.01)。骨转移组骨组织OPG mRNA/RANKL mRNA比值显著低于对照组骨组织(图5G),差异有统计学意义(P<0.000 1)。
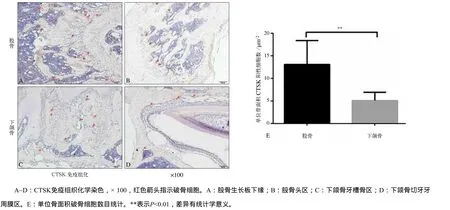
图3 正常生理情况下颌骨与股骨CTSK阳性破骨细胞分析Fig 3 Analysis of cathepsin K-positive osteoclasts in normal physiological mandible and femur
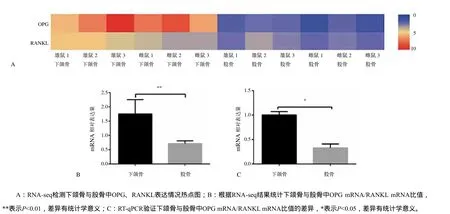
图4 正常生理情况下颌骨与股骨组织OPG mRNA/RANKL mRNA水平分析Fig 4 Analysis of OPG mRNA/RANKL mRNA ratios in normal physiological mandible and femur
3 讨论
部位特异性骨疾病在临床上多有报道[6-10],而其发病机制目前仍不明确。下颌骨是研究部位特异性骨疾病发生机制的理想骨组织。按形态分类,骨骼可分为长骨(如股骨)、短骨、不规则骨(如下颌骨)、扁平骨及圆骨等[21];骨骼的成骨方式可分为2种,即软骨内成骨(股骨类长骨)和膜内成骨(颅骨、椎体等扁骨及不规则骨)。下颌骨发育兼具软骨内成骨及膜内成骨方式。然而骨骼的形态分类和成骨方式差异均不能较好匹配临床上肺癌细胞骨转移部位差异性(脊柱转移率最高,股骨等长骨次之,下颌骨鲜少发生骨转移[6-7])。进一步从胚胎起源上看,骨骼的胚胎起源包括3类,神经嵴(外胚层)、体壁中胚层、轴旁中胚层[22]。其中,下颌骨发生于颅神经嵴,股骨等长骨发生于侧板中胚层,脊柱等躯干骨发生于轴旁中胚层[23-24],这与临床上各部位骨组织肺癌细胞骨转移发生率高低较契合。不同胚胎起源骨骼的基因表达差异可能引起骨微环境差异,从而影响肿瘤骨转移部位差异。因此,本研究选取下颌骨和股骨作为不同胚胎来源的骨组织代表,探讨骨组织微环境差异是否参与肺癌细胞骨转移部位差异。
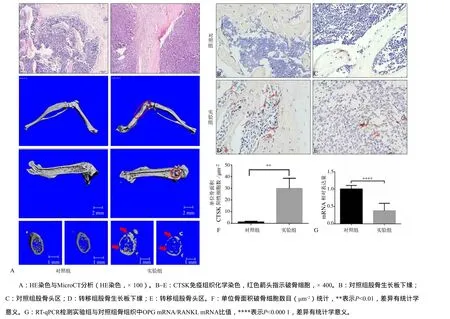
图5 对照组与实验组骨组织中破骨细胞活化情况及OPG mRNA/RANKL mRNA比值分析Fig 5 Osteoclasts activation and OPG mRNA/RANKL mRNA ratios in bone tissues of the experimental and conrtrol groups
在正常状态下,骨组织中骨形成与骨吸收存在动态平衡;在发生肿瘤细胞骨转移时,肿瘤细胞的入侵破坏了局部骨环境稳态,引起骨破坏。作为调控骨改建过程的重要功能细胞,破骨细胞也是参与转移瘤细胞与骨微环境恶性循环的关键细胞。OPG/RANKL是骨微环境的重要调控因子,也是破骨细胞活化成熟的重要调控因素[16-20]。在本研究中,笔者发现,相较于肺癌细胞骨转移高发的股骨,骨转移低发的下颌骨组织中CTSK阳性破骨细胞较为分散且数目更少(图3),且OPG mRNA/RANKL mRNA比值显著偏高(图4)。局部肺癌细胞骨转移模型的研究结果表明,在发生肺癌细胞转移的骨组织中,破骨细胞活化增强(图5D~F),且OPG mRNA/RANKL mRNA比值明显下调(图5G)。以上结果提示,骨组织微环境可能通过OPG/RANKL影响破骨细胞活化进而参与调控肺癌细胞骨转移部位差异。
许多学者[6-7,25]在对临床病例资料统计分析后,对下颌骨肿瘤转移率很低达成了共识。本研究采用尾静脉注射肿瘤细胞的方式构建全身性肺癌细胞骨转移模型,提高了骨转移建模的生存率且建模周期适中,并可模拟骨转移发生过程中肿瘤细胞经血运到达靶器官的过程。MicroCT三维重建、HE染色分析发现,与临床报道相一致,相较于股骨,下颌骨不易发生肺癌细胞骨转移(图2)。本研究采用股骨组织注射肺癌细胞的方法构建局部肺癌细胞骨转移模型,建模成功率高、周期短,且可排除血液循环、肿瘤定植等因素的影响,适用于研究局部骨微环境对肺癌细胞骨转移部位差异的影响。通过实验发现,发生肺癌细胞转移的骨组织中破骨细胞活化增强,OPG mRNA/RANKL mRNA比值明显下调(图5)。印证了骨转移高发的股骨组织中破骨数目多,OPG mRNA/RANKL mRNA比值较低,而下颌骨与此相反(图3,图4)。该种差异可能影响肺癌细胞转移至下颌骨的概率较低。由此,笔者认为在口腔疾病的诊治过程中,面对下颌骨溶骨性疾病,临床医生应建立正确的诊断思路,在临床思辨过程中,按照症状和影像学表现可能涉及疾病的发病率进行一一排除,从最常见的疾病(如根尖周炎、牙周炎等)入手,再逐步扩大直至发病率较低的病症(如下颌骨转移瘤)。
综上,本文通过构建全身性肺癌细胞骨转移小鼠模型,明确肺癌细胞骨转移在小鼠下颌骨与股骨中差异发生,并以下颌骨与股骨作为肺癌细胞骨转移低发和高发的代表性骨组织,采用骨组织注射构建局部肺癌细胞骨转移小鼠模型,模拟肿瘤细胞到达骨组织后与骨组织微环境之间的相互作用。从骨组织微环境角度出发,初步揭示了肺癌细胞骨转移部位差异可能与骨组织微环境中破骨细胞活化情况及OPG/RANKL有关,可能为从骨组织微环境角度研究部位特异性骨疾病的发病机制与防治提供参考。

