低温离子体与红外光谱技术及其在灵芝诱变育种中的应用研究进展
黄 青,马玉涵,,张倩倩,姚国华,何华奇,韦 达
(1. 中国科学院合肥物质科学研究院 强磁场与离子束物理生物学重点实验室,安徽 合肥 230031; 2. 中国科学院 智能机械研究所,安徽 合肥 230031; 3.安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
微生物已广泛应用于医药生产、环境修复、日常生活等方面.遗传育种是获得更多具有优良性能的微生物品种的途径之一[1].基因工程是微生物菌种改良的主要方法,诱变是基因工程的重要手段[2].很多情况下,并不清楚诱变物种的遗传背景,为了食品安全,人们更青睐 “非转基因”改造[3].随机诱变可以通过生物[4]、化学及物理方法[5-6]实现.
由于诱变产生了大量突变菌株,因此筛选的工作非常重要.筛选工作耗资、耗时,急需建立高通量的筛选方法[7].高效的诱变手段配合有效的筛选技术,是育种成功的关键.常见的筛选技术通常费时耗力,尤其是对目标微生物的代谢途径不甚了解的情况下,这些技术很难发挥作用[16].光谱筛选具有多种优势,在育种筛选中受到重视.光谱筛选技术有:UV-Vis吸收光谱、荧光光谱、红外和拉曼光谱等[17],其中红外光谱技术具有实时、高效、无损、高通量等优点,适合微生物突变库的筛选[8,18-21].
近年来,科研人员在低温等离子体结合红外光谱育种方面取得了一些进展.该文概述等离子体和红外光谱在微生物育种中的应用,介绍低温等离子体和红外光谱技术在灵芝诱变育种及品质检测方面的最新研究进展,且展望其未来的应用前景.
1 等离子体诱变技术在微生物育种中的应用
虽然基于预先设计的基因工程已成为某些微生物菌种改良的首选技术,但在很多情况下,基于物理和化学的随机诱变仍然是十分重要的技术,特别是在某些基因操作手段存在技术或非技术困难的情况下,这种诱变技术就会显示独有的优势.相对于其他物理和化学诱变技术,低温等离子体(low temperature plasma,简称LTP)兼具物理诱变及化学诱变二者的特点.作为物质的第4种状态,等离子体可通过增加电极间电压人工获得.当电压超过击穿电压时,气体分子在电极间电离,产生电子和离子混合的气体.由于混合气体中电子温度很高而离子温度较低(接近室温),相对于太阳的高温等离子体来说,它通常被称为低温等离子体.低温等离子体与物质作用方式比较复杂,而且作用产生的物质成分也很丰富.等离子体作用于含水体系,可产生多种自由基,从而引起丰富的生物学效应,如图1所示.等离子体作用于生物分子(如蛋白质、DNA分子)时,会导致分子损伤;在剂量较低时,作用于细胞中的DNA,可能导致DNA出错,从而诱发变异[22];此外,在适当条件下,能产生刺激效应,促进微生物生长和次生代谢产物积累[23].LTP诱变有如下优点:操作简单、易于控制、有效突变率高、无环境污染、不需要复杂设备和较大的资金投入.

图1 常用的生物诱变技术及等离子体诱导的生物学效应(资料来源:文献[21])
LTP诱变技术已在多种微生物中得到广泛应用[24].研究人员采用LTP技术处理细菌(大肠杆菌[11]、巴氏醋酸杆菌[12]、谷氨酸棒状杆菌[25]、产气肠杆菌[26]、阴沟肠杆菌[27]、枯草芽孢杆菌[13-14]等),取得了较好的诱变效果.文献[28]利用LTP结合亚硝酸钠处理大肠杆菌,获得了高产反式-4-羟基-L-脯氨酸的菌株,在5 L发酵罐中发酵48 h,该菌株的产量达到了25.4 g·L-1.文献[29]利用LTP处理ldhA和pflB缺陷型大肠杆菌菌株,原菌株在厌氧条件下无法利用葡萄糖,但诱变处理后,突变体恢复了葡萄糖利用能力,且在发酵120 h后,通过35.0 g·L-1的葡萄糖产生了25.2 g·L-1的琥珀酸.文献[30]对转有L-赖氨酸诱导启动子(该启动子控制和表达绿色荧光蛋白)的大肠杆菌进行LTP处理,通过对突变体库的荧光激活细胞的筛选和后续复选,获得了2株高产突变菌株,其L-赖氨酸浓度和含量均有提高.文献[31]将射频大气压辉光放电(一种LTP的放电方式)作用于甲状毛孢菌(Methylosinustrichosporium)后,突变体的生长速度和甲烷单加氧酶的活性均有明显提高.文献[32]通过LTP和细胞固定,提高了假单胞菌对底物的耐受性,筛选获得的突变菌株mut-D3的最适底物浓度由100 mmol·L-1提高到150 mmol·L-1,烟酸浓度达189 g·L-1,比野生型(WT)提高了42%.另外,LTP诱变技术对丝状真菌的应用也很广泛.文献[33]用LTP处理Aspergillusniger,得到了3株优良菌株,其葡萄糖酸盐的产率均有提高.文献[34]用LTP对黑霉菌进行诱变,得到的突变菌株的淀粉酶活性提高了70%.文献[35]对Blakesleatrispora进行LTP诱变处理,其番茄红素的合成水平提高了55%.文献[36]使用LTP处理丝状真菌(Glarealozoyensis),其突变株合成纽莫康定B0(Pneumocandin B0)的能力提高了1.39倍.文献[36]利用LTP处理Mortierellaalpina,其诱变菌株的花生四烯酸的相对浓度和产量均有所提高.
2 红外光谱筛选技术在微生物育种中的应用
通过包括等离子体诱变技术在内的多种物理和化学诱变,可以获得大量的突变菌株,但如何从这些突变株中把具有目标性状的突变株筛选出来,是诱变育种的关键问题之一,也是一项耗时耗力、难度大的工作.通过基因工程的设计和构建,可以获得大量不同的微生物菌株,但对这些突变体进行表型认识及筛选也同样是一个难题[37].一般来说,在筛选过程中,对于缺乏显色或荧光特性的分子,往往用色谱或质谱进行定量分析[38].随着自动化水平的不断提高,仪器的筛选效率大幅提高.但是,这不仅需要大量的资金投入,而且还需要适合突变菌株的分析和筛选技术.特别是,如果对微生物产物代谢途径不甚了解,就很难用常规的技术得到满意的分析和筛选结果.以灵芝为例,灵芝属中含有316种灵芝三萜,它们结构相似,难以分离纯化[39-40].在这种情况下,现有大多数筛选技术均不合适.为了对这些物质进行快速、准确分析,实现突变菌株的高通量筛选,就需要探索新的筛选技术.
光谱技术可对微生物的代谢产物及代谢过程进行快速、实时、无损观测与分析,能为筛选提供有效的检测及分析工具[41-42].所谓生物光谱技术,就是基于生物分子发射、吸收及散射的光谱特征,确定生物样品的物质结构、组成和含量等,并对生物性质及形成过程进行观测及分析的技术[41].生物光谱技术能对生物样品进行实时、动态、无损检测,对多个样品不同化学组分进行高通量检测与分析,获得的信息量大,且样品用量少、操作简便.
红外光谱(infrared spectroscopy,简称IR)技术已在多个微生物研究领域广泛使用[8,24-43].红外光谱是波数范围在10~13 330 cm-1的光谱,可分为远红外、中红外(mid-IR)、近红外(NIR),它们的谱区范围分别为10~400 cm-1,400~4 000 cm-1,4 000~13 330 cm-1.红外光源于分子振动或转动的能级跃迁[44].傅里叶变换红外光谱(Fourier transform infrared spectroscopy,简称 FTIR)技术是一种使用傅里叶变换快速采集红外光谱的技术,适用于微生物品种的鉴定和分类[45],即利用傅里叶变换红外光谱的指纹谱区,对不同的菌株进行快速鉴别和聚类分析.微生物发酵是一个快速变化的过程,FTIR技术可以对这一过程进行动态监控,实现实时高效分析[46].利用FTIR技术,对微生物在胁迫条件下的响应加以监测,从而对抗性及营养缺陷的筛选机理进行研究[47].除此之外,由于 FTIR技术可观测微生物的生长和变化过程,因此能用于诱变育种领域[8,18].利用FTIR的微成像技术,可动态研究微生物生长发育各阶段细胞内的组分含量,从而更加精确地对突变发生的位点和机制加以分析[48].文献[49]先用γ射线辐照微球菌,后利用FTIR技术对辐照引起的细胞脂质过氧化、蛋白质和糖类的修饰、DNA损伤等进行研究.文献[50]利用红外光谱显微成像技术,对雨生红球藻中虾青素的代谢进行实时观察.研究人员在菌株选育方面应用生物光谱技术开展了一系列工作[51-56].例如,联合红外光谱和拉曼光谱对雨生红球藻LTP诱变株进行分析[51-54].基于近红外光谱数据,构建了虾青素含量的定量分析模型,揭示了强光胁迫条件下M3突变藻株高产虾青素的相关机制[51-53,56].利用红外光谱很容易将正突变株与出发株区分开来,其准确性可与常规定量技术媲美.以下特别介绍低温等离子体结合红外光谱在灵芝诱变育种方面的研究工作.
1)信息型文本:主要用于表现事物与事实,包括信息、知识、观点等。侧重传递原文的内容,语言具有逻辑性和指称性的特点。
3 等离子体结合红外光谱在灵芝育种中的应用研究进展
3.1 利用等离子体诱变灵芝原生质体获得多糖含量高的诱变菌株
为了实现有效的LTP诱变,笔者课题组搭建了介质阻挡(dielectric barrier discharge,简称DBD)放电产生等离子体的装置,并利用该装置对灵芝的原生质体进行诱变,实验采用的灵芝为赤灵芝(Ganodermalucidum)[22].实验装置如图2所示,该装置电源采用纳秒脉冲高压电源,放电气体采用氩气、氮气等.由气表控制的气体注入自制的圆柱形容器,内置石英反应皿,再注入灵芝原生质体.电极的高度可调,电极连接高压纳秒脉冲直流电.通过调控气体种类、流量和电场强度等,可优化诱变效果.在灵芝原生质体诱变实验中,发现He气为工作气体,放电电压为13 kV、气流量为2 L·min-1、放电处理时间为4 min时,能获得较好的诱变效果.

图2 对灵芝菌株原生质体进行诱变处理的实验装置(资料来源:文献[22])
利用LTP诱变灵芝原生质体之后,文献[22]利用RAPD(random amplified polymorphic DNA)对处理过的原生质体进行检测,判断诱变是否产生.通过多次RAPD检测,排除假阴性和假阳性,从而确定LTP诱变菌株.同时,使用硫酸蒽酮标准,测量灵芝多糖含量,研究诱变菌株多糖含量的变化.诱变灵芝菌株状态及性能如图3所示.通过电泳带的差异,可发现一些菌株发生了突变.这些突变株相比于出发株,其灵芝多糖含量有显著变化,其中RWY-1相比出发株,多糖含量提高了大约25%.

图3 诱变灵芝菌株状态及性能(资料来源:文献[22])
文献[57]利用LTP对灵芝原生质体进行诱变,得到了纳米硒菌株,经检测,其硒含量比出发菌株的提高了约30%.
3.2 利用红外光谱技术鉴别多糖含量高的诱变菌株
通过LTP诱变技术,研究人员可以获得大量的灵芝突变株.为了对这些突变株进行筛选,研究人员一方面在实验中继续采用传统的技术,对这些菌株的灵芝多糖和三萜含量进行测量和分析,另一方面,探索建立新的基于光谱的技术,以期得到更高效的诱变育种筛选工具.这里主要介绍灵芝菌丝体的红外光谱研究工作.
中红外光谱的频率取决于分子结构,光谱强度取决于这种分子的含量,所以红外光谱可以作为化学成分定性和定量分析的工具[45].对生物体而言,其有机体虽然复杂,但是化学成分主要由水、脂肪、蛋白质、碳水化合物和其他物质组成.不同有机生物体的化学组成不同,其光谱特征也不同.近红外光谱由基本振动跃迁的倍频和组合频构成,其吸收系数一般比中红外光谱的低10倍以上,但这个不足之处可通过化学计量技术进行弥补[52,54].
文献[58]对发酵培养获得的出发株和诱变株的灵芝菌丝体进行清洗、冷冻、干燥,研成粉末压制成片,最后进行红外光谱测量.中红外光谱检测的扫描范围为200~4 000 cm-1,分辨率为4 cm-1,扫描次数为64,用OPUS 7.0数据处理软件收集结果并分析.近红外光谱检测中,使用德国布鲁克公司MPA型近红外光谱仪采集光谱,扫描范围为4 000~12 500 cm-1,分辨率为16 cm-1,扫描次数为32.
3.2.1 灵芝菌丝体中红外(mid-IR)光谱及特征
文献[58]通过发酵培养获得不同灵芝菌丝样品,并利用中红外光谱分析各菌丝体样品.典型的灵芝菌丝体的FTIR测量结果如图4所示.灵芝菌丝体的典型峰位包括1 425 cm-1 [59-60],1 316 cm-1[61],1 152 cm-1[62],1 078 cm-1[63],1 025 cm-1[64-65],951 cm-1[65-66],在这些位置均有比较清晰的吸收峰.从中红外光谱中可以识别出碳水化合物的特征峰,即1 425,1 078 cm-1处的谱峰.
文献[22]对不同多糖含量的诱变灵芝菌株光谱进行比较和分析.由图5可知, 1 425,1 078 cm-1处谱峰的相对强度较大,这验证了1 425,1 078 cm-1亦为灵芝菌丝多糖中红外光谱的特征峰位.

图4 典型的灵芝菌丝体的FTIR测量结果(资料来源:文献[58])
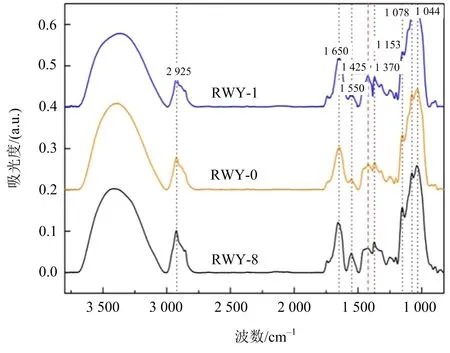
图5 不同多糖含量的诱变灵芝菌株的中红外光谱比较(资料来源:文献[22])
表1为灵芝菌丝体中红外特征光谱的基团归属.

表1 灵芝菌丝体中红外特征光谱的基团归属
3.2.2 利用近红外光谱(NIR)测量灵芝菌丝体多糖的含量
文献[80]对不同灵芝菌丝体多糖的近红外光谱定量测量模型进行了研究.模型选择的波数区间的灵芝菌丝体多糖的原始光谱如图6(a)所示,其中8 403,6 896,5 155 cm-1吸收峰归属于水,5 935,5 787,4 405,4 307 cm-1处吸收峰归属于碳水化合物.为了建立灵芝多糖NIR定量测量模型,采用移动窗口偏最小二乘法(mwPLS)和区间偏最小二乘法(iPLS)选择谱段.2种方法均一致表明波数4 000~5 268.8 cm-1有较低的交叉验证均方根误差(RMSECV),适合于定量分析.选择1阶导数、无光谱预处理、2阶导数等预处理方法进行优化,比较结果表明1阶导数方法结果最优.模型选择的波数区间的灵芝菌丝体多糖的1阶导数光谱如图6(b)所示.对于校正集,其模型的维数为6,RMSECV为0.467,残留预测偏差值(RPD)为6.73,决定系数为0.977 9.基于76个菌株构建的校正集的化学测量值与NIR预测值关系如图6(c)所示.利用该模型,对LTP诱变获得的灵芝菌株进行定量分析,得到基于诱变菌株构建的预测集的化学测量值与NIR预测值关系如图6(d)所示.

图6 灵芝菌丝体多糖的近红外光谱定量测量(资料来源:文献[80])
为了验证灵芝多糖近红外光谱定量测量模型的合理性和可靠性,文献[58]分析了不同多糖含量的灵芝菌株的近红外光谱,不同多糖含量的灵芝菌株在4 307,4 405 cm-1处的峰值有较显著的差异,如图7(a)所示.由图7(b)可知,近红外光谱的4 000~5 268.8 cm-1及中红外光谱的1 376~1 422 cm-1的相关性均最强,这是来自灵芝多糖成分的贡献.

图7 不同多糖含量的灵芝菌株近红外光谱(a)及中红外和近红外2维相关光谱(b)(资料来源:文献[58])
文献[80]建立的定量模型涵盖了4 000~5 268.8 cm-1的光谱,其中包含了4 307,4 405 cm-1特征峰,这两个特征峰对应中红外光谱的1 425,1 078 cm-1谱峰.4 307 cm-1来自C-H伸缩振动和CH2变形振动组合频[59],4 405 cm-1可能是O—H的伸缩振动和C—O伸缩振动的组合频[60].中红外光谱1 425 cm-1和1 078 cm-1的谱峰分别归属于木质素或碳水化合物中葡聚糖吡喃环的C—H和C—O—H的弯曲振动(葡聚糖广泛存在于不同种类的真菌[81]).
表2为灵芝菌丝体近红外特征光谱的基团归属.

表2 灵芝菌丝体近红外特征光谱的基团归属
3.2.3 红外光谱结合拉曼光谱在灵芝三萜分析中的应用
对于灵芝三萜成分及其含量的测量与分析,研究人员采用光谱技术做了一些探索工作[80,89-90].灵芝三萜种类多而复杂,鉴别相对困难,因此使用质谱、NMR和X-Ray等技术分离测量灵芝酸(属于灵芝三萜类化合物),测量费用高、分析时间长.文献[89]通过光谱测量,结合密度泛函理论计算,可区分出不同类型灵芝酸,且能区分灵芝酸和其衍生物灵芝烯酸.文献[91]对齐墩果酸和灵芝三萜标准样品的紫外可见光吸收数据优化后,获得了更准确的标准曲线和检测结果.
关于灵芝三萜的光谱研究,需要用到易于光谱分析多种三萜标准样品.灵芝三萜可从灵芝子实体中提取,在发酵条件下,灵芝菌丝也可产生灵芝三萜.文献[80]利用HPLC对不同灵芝菌丝体中的三萜含量进行分析,结果如图8所示.由图8可知,不同灵芝菌株的三萜含量差异很大,其中G058和G009的三萜含量显著高于G080的.

图8 利用HPLC测量的不同灵芝菌丝体中的三萜含量(资料来源:文献[80])
用各种提纯方法制备三萜纯品,并对其进行红外光谱测量分析,由此确定三萜的光谱特征峰.例如,文献[80]将不同三萜含量的灵芝菌株的红外光谱与灵芝酸T的进行比较,结果如图9所示.从图9可以看出,灵芝酸T的特征峰为1 736,1 377,1 248 cm-1,其中1 736 cm-1来自C=O伸缩振动,1 377 cm-1来自CH3中C-H对称弯曲振动,1 248 cm-1来自C-H面的振动.

图9 不同三萜含量的灵芝菌株的红外光谱与灵芝酸T的比较(资料来源:文献[80])
文献[90]对不同灵芝酸的中红外和拉曼光谱峰位进行DFT计算,详细分析了不同种类灵芝酸的特征峰位和光谱特征.图10为灵芝酸A的红外和拉曼光谱的实验测量值与理论计算值对比.由图10可知,1 500~1 800 cm-1是区分不同类型灵芝酸的光谱区域,该区域对应于C=O伸缩振动.对灵芝酸A的脱氢衍生物灵芝烯酸A进行了研究,发现灵芝烯酸A的IR和拉曼光谱的特征谱均位于1 620 cm-1附近.
文献[80]测得了灵芝菌丝体的NIR光谱,并对灵芝菌丝体三萜含量进行了定量测量,结果如图11所示.灵芝三萜定量测量模型选取的光谱谱段为5 662.3~5 963.1 cm-1,4 350.85~4 412.56 cm-1,预处理方式为1阶导数.

图11 灵芝菌丝体NIR光谱及灵芝三萜的定量测量(资料来源:文献[80])
目前三萜测量还存在定标问题[91],另外,在子实体中各种灵芝菌株三萜的种类及含量也存在较大差异,因此关于灵芝三萜更系统更精细的光谱研究工作还要持续进行.
4 总结与展望
低温等离子体与红外光谱相结合在微生物诱变育种方面有突出的优势和巨大的应用潜力.笔者概述了低温等离子体和红外光谱在微生物育种, 尤其是灵芝品种选育和品质检测中的应用.尽管目前已经取得一些研究成果,但在食用菌和药用菌品种选育和品质检测中,尚存在一些问题需要进一步研究解决.例如:灵芝含有多种药理活性成分,但主要活性成分含量较低,其化学结构复杂,需要对各种成分的特征光谱做更为系统而细致的分析和计算.等离子体结合红外光谱技术后续的研究,可以从以下几个方面考虑:①继续加强高产多糖的灵芝菌株培育工作,在已获得的灵芝多糖光谱定量测量模型基础上,利用等离子体技术获得更多的高产多糖的灵芝新品种.②灵芝三萜具有多种药理作用,因此可以利用低温等离子体诱变技术获得高产灵芝三萜的灵芝菌株.③目前灵芝总三萜的检测方法存在测量不准确的问题,因此需要探索利用红外光谱建立灵芝总三萜的定量测量模型,用以筛选高产灵芝三萜的菌株.总之,低温等离子体诱变技术结合红外光谱测量技术,能更快更有效地获得更好的品种,为改良菌种、丰富种质资源、推动食药用真菌育种产业发展,发挥更大作用.

