如何快速让学生掌握原电池原理及电极方程式的书写
郭 娜
(辽宁省本溪市高级中学 辽宁 本溪 117000)
由于我们学校整合了必修二和选修四的原电池知识,原电池属于氧化还原反应原理的应用。一部分同学在必修一的时候,氧化还原反应这部分知识点就不过关。学习这一章的状态可想而知。针对班里边这部分学生,先引导他们重新温习必修一氧化还原反应学案。然后帮助他们把原电池原理及电极方程式的书写进行了重新梳理和归类。
1.原电池的知识规律
1.1 能量转化:化学能转变成电能。
1.2 原电池的构成原理:放热的氧化还原反应。
1.3 构成原电池的条件:
(1)两个活性不同的电极。(两种活性不同的金属,或金属和能导电的非金属。燃料电池例外,燃料电池的两极材料可以相同。)
(2)两电极必须浸在电解质溶液中。(可以是水溶液;或熔融的盐;或熔融的氧化物。)
(3)两极之间要用导线连接,构成闭合回路。
1.4 两极名称:正极、负极。
1.5 两极反应:
1.6 电池反应:将负极和正极的电极反应相加,得到的即为原电池的总反应。
1.7 谨记:电子在导线中流动,离子在溶液中迁移。即”电子不下水,离子不上岸”。
小结:(以铜锌原电池为例)
2.原电池正、负极的判断方法
2.1 根据组成原电池的两级材料判:一般是活泼性较强的金属为负极;活泼性较弱的金属或能导电的非金属为正极。但不要形成“活泼金属一定做负极”的思维定势。如:
甲图中稀硝酸作电解质溶液,金属铁比铜活泼,所以Fe作负极;乙图中,铁在浓HNO3中钝化,铜在浓HNO3中发生氧化还原反应失电子作负极。
2.2 根据原电池两极发生反应的类型来判断:原电池的负极失电子发生氧化反应,正极得电子发生还原反应。
2.3 根据电子流动方向或电流方向判断:
电子:负极→正极 电流:正极→负极
2.4 根据原电池中电解质溶液内离子的定向移动方向判断:
2.5 根据电极的质量变化或电池中的现象判断:工作之后电极质量增加或有气泡产生的电极通常为正极。电极质量减轻的通常为负极。但也有例外:比如铅酸蓄电池工作之后,两电极的质量均增加。而氢氧燃料电池,工作之后两电极的质量都不会发生改变。
3.原电池原理的应用
3.1 比较金属的活动性:通常比较活泼的金属作负极。
3.2 比较阳离子的氧化性:
3.3 加快化学反应速率:锌与稀硫酸反应制H2时,加入少量CuSO4溶液或Cu粉或CuO。均可使反应速率加快。因为Zn置换出来的Cu在H2SO4溶液中构成了铜锌原电池。能形成原电池的氧化还原反应比普通的氧化还原反应速率要快。
3.4 制作化学电源:一次电池、二次电池(可充电电池)、燃料电池。
4.电极方程式书写方法:(1)反应式的相减法。(2)守恒法。
4.1 反应式相减法:用电池总反应式减去正极(负极)的电极方程式,可得出负极(正极)的电极方程。此法适用于其中一极的电极方程式较容易写出,而另一极不易写出的情况,利用反应式相减法。先写出易写的一极电极反应,再用总反应减去写出的这级电极方程式,即得到较难写的另一极电极方程式。如:
NH3燃料电池(碱性介质):
总反应:4NH3+3O2=2N2+6H2O
(1)
正极反应: 3O2+12e-+6H2O=12OH-(容易写出)(2)
(1)-(2)得负极反应: 4NH3+12OH--12e-=2N2+12H2O
4.2 守恒法:按电子守恒→电荷守恒→原子守恒的“三恒”顺序。
首先由总反应确立元素化合价升高的数值(降低的数值),进而确立失去的电子数(得到的电子数);再由电荷守恒确定参与反应的介质(H+或OH-或H2O)物质的量;最后由原子守恒得出完整的电极方程式。如:
N2H4燃料电池(碱性介质).
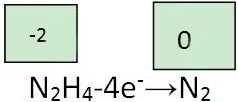
Ⅱ.平衡电荷:左边失4e-带4个单位正电荷,右边电中性。故左边加4个单位负电荷,或右边加4个单位正电荷,均可使左右达到电荷守恒。但题中给的是碱性电解质,提供带负电荷的OH-离子,只能选择左边加4个单位负电荷,即4OH-。 N2H4-4e-+4OH-→N2
Ⅲ.根据N、H、O原子个数守恒配平左右两边: N2H4-4e-+4OH-=N2↑+4H2O (2)
(1)-(2)得正极反应:O2+2H2O+4e-=4OH-
总之,课堂来不得半点虚假,熟能生巧,天道酬勤。原理记牢,勤写多练。那么原电池知识无论怎么抽象困难,都能迎刃而解。

