整体式纳米碳负载Ni-CeO2催化剂高效催化转化CO2合成天然气
郭 琳,郭章龙,李世艳,许 驰,刘岳峰*
(1.中国科学院大连化学物理研究所,辽宁 大连 116023;2. 中国科学院大学,北京 100049)
二氧化碳(CO2)作为一种存量丰富、价格低廉且可再生性的碳一(C1)资源,在化工行业中起到至关重要的作用, 如果将已释放的CO2资源进行充分有效的利用和开发将不失为一种良策,对全球治理温室效应将起到一定的促进作用[1]。 与此同时,CO2的利用和开发也将加快能源结构由传统化石燃料向可循环、可再生碳资源利用方向转变。 通过CO2催化加氢工艺制备合成天然气的过程 (CO2+4H2→CH4+2H2O,ΔG=-114 kJ/mol) 可有效地将可再生能源(电解水产生的H2)存储成高能量密度的CH4,从而实现能量的有效运输和特定环境的使用 (例如:密闭循环空间的能量供给)[2,3], 与此同时生成的目标产物CH4还是重要的化学中间体, 可以用于合成其他经济附加值较高的化学品。
设计高效的CO2甲烷化催化剂是该工艺中最为重要和关键的研究课题之一。 典型的活性金属催化剂主要包括Ni基[4,5]、Pd基[6]或者Ru基[7,8]催化剂,由于Ni基催化剂属于非贵金属,简单易得,原料成本要低于其他几种贵金属,因而受到广泛关注[9]。 然而Ni基催化剂的低温CO2活化能力和甲烷的选择性有待进一步提高,因此需要大量深入系统地加强对镍基催化剂的研究,从而提高其催化反应活性[10]。在我们前期的研究工作中发现, 通过碳纳米管负载Ni金属,并添加稀土金属氧化物(例如:La2O3)制备的催化剂可以获得优异的低温活化CO2能力,且CH4选择性接近100%[11]。 但纳米碳材料往往呈粉体,存在不利于工业运输和在固定床反应中床层压降剧增等问题[12,13],已成为纳米碳材料在气固相催化反应中的应用瓶颈。
本工作基于以上碳材料研究中存在的应用瓶颈问题,采用一种简单研磨、成型工艺制备出整体成型的纳米碳复合材料(NCNT-foam)[14],并将该材料作为载体,将金属Ni和助剂CeO2负载在整体成型的纳米碳载体上获得了Ni-CeO2/NCNT-foam催化剂,并将其应用于催化转化CO2制备CH4催化反应中;另外,本工作通过多种表征手段研究了催化剂结构与催化反应活性之间的构效关系机制,从而阐述了催化剂表现出优良的CO2甲烷化高活性的内在原因。
1 实验部分
1.1 仪器和试剂
多通道微反应系统-Agilent7890气相色谱联用,催化剂表面反应评价体系-在线质谱联用JSM-7800F和ASAP2020物理吸附仪。
D-葡萄糖(C6H12O6, 99%,Alfa Aesar ),柠檬酸(C6H8O7, 99.5% ,Alfa Aesar), 碳酸铵(Sinopharm Chemical Reagent Co. Ltd),碳纳米管(Shandong Dazhan Nanomaterials Co. Ltd),六水合硝酸镍(国药集团),六水合硝酸铈(国药集团)。
1.2 催化剂制备
整体成型的Ni-CeO2/NCNT-foam催化剂的合成方法如图1所示。 首先通过球磨、 成型等步骤合成NCNT-foam载体。 具体的操作步骤如下: 准确称取4 g D-葡萄糖 (C6H12O6, 99%), 6 g柠檬酸(C6H8O7,99.5%)和1 g碳纳米管,并在室温下将上述物质均匀研磨并充分混合,之后在上述混合物中加入3 g碳酸铵(按照这种比例混合得到的NCNT-foam的含氮原子百分比约为4%~8%)[15],机械混合均匀后于130 ℃烘箱中干燥5 h,随后移至管式炉内在流动的空气气氛下以2 ℃/min的升温速率升温至400 ℃,并在该温度下恒温3 h以分解混合物中的碳酸铵和葡萄糖,以形成形貌特定、多孔结构和大比表面积的介孔/大孔碳材料[15]。 为了增强整体式催化剂的导电性和导热性,同时使部分碳的石墨化程度增加[14],将空气中焙烧处理后的样品在Ar气氛下于800 ℃煅烧处理2 h,从而使附着于多层碳纳米管上的N、 C复合结构具备更高的石墨化程度。

图1 整体成型的Ni-CeO2/NCNT-foam催化剂的合成示意图及实物光学照片Fig. 1 Schematic illustration of the synthesis process of Ni-CeO2/NCNT-foam catalyst and the related optical photos
称取0.394 g硝酸镍和0.040 g硝酸铈,分别用去离子水溶解,并充分混合,随后将上述混合均匀的溶液慢慢滴加到整体碳材料上,直至溶液恰好将载体浸渍完全, 浸渍后的样品放入80 ℃烘箱内干燥,干燥后取出样品,重复上述步骤多次直至所配制的盐溶液完全用于整体碳材料浸渍。 将上述所制备的催化剂前驱体于Ar气氛下从室温开始, 以1 ℃/min的升温速率升至350 ℃并在此温度下保持2 h,通过该方法即制备完成了整体式Ni-CeO2/NCNT-foam催化剂, 其中Ni的理论负载量 (质量分数, 下同)为10%,CeO2的理论负载量为2%。 用相同的方法制备Ni/NCNT-foam催化剂,其Ni的理论负载量为10%。
1.3 催化剂性能评价
准确称取100 mg催化剂放置于固定床微反应器中, 在常压条件下以5 ℃/min的升温速率升温至400 ℃,氢气流速控制在40 mL/min,并在该温度下原位还原2 h; 原位还原结束后将还原气切换成Ar,并降温至180 ℃。 待反应器温度达到180 ℃后将Ar切换成H2和CO2混合气,其中n(CO2)/n(H2)的比值控制在1/4,反应气的总流量控制在40 mL/min,并用在线色谱TCD检测器实时记录从180 ℃到380 ℃这一反应温度区间内反应后尾气的信号变化。 催化剂的催化反应性能用CO2转化率和CH4选择性进行评价,其计算公式如下:
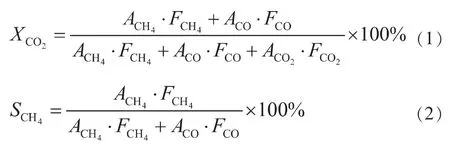
式中:A-各种物质在色谱中的出峰面积,mA·s;F-相应的响应因子;X-转化率,%;S-选择性,%。
1.4 催化剂表征
氮气吸附/脱附等温测试在ASAP2020物理吸附仪上进行。 样品首先于200 ℃真空条件下脱气预处理6 h。 比表面积通过多点BET法进行计算,平均孔体积和孔径通过脱附分支曲线的BJH方法计算得到。
还原后样品的X射线衍射(XRD) 表征, 以λ=1.5418 ×10-10m的Cu Kα射线为放射源,在管电压40 kV,管电流40 mA条件下扫描,2θ的扫描范围为10°~80°。
扫描电镜和元素分布图用JEOL-JSM-7800F(晶格分辨1.2 nm)于10 kV加速电压下测试。
透射电子显微电镜实验采用Themis ETEM G3(Thermo Fisher Scientific), 在加速电压300 kV下测试。
程序升温表面反应(TPSR):称取30 mg所制备催化剂前驱体, 在氢气流量为40 mL/min的5% H2(体积分数,下同)气氛下还原处理2 h,原位还原结束后降温至50 ℃并将还原气体切换成5%CO2-20%H2-He的混合反应气, 待基线稳定后以10 ℃/min的升温速率升温至800 ℃, 在升温的过程中通过在线质谱仪进行原位检测和记录CH4和CO2的信号变化。
2 结果与讨论
2.1 催化剂的孔结构及晶相分析
整体式NCNT-foam载体及其负载金属后样品的N2低温物理吸附/脱附实验结果如图2所示。由图2可知,制备的整体碳材料载体的N2吸附/脱附曲线是有着典型H2型回滞环的Ⅳ型等温线。 这说明NCNTfoam材料有着丰富的介孔结构。 根据低温N2吸附/脱附等温线数据测得该材料的比表面积大约为400 cm2/g, 这与未经过任何处理的商业碳纳米管(比表面积约为300 cm2/g)相比,其比表面积提高幅度大约为33.3%, 这说明该方法制备的整体式碳材料具有较大的比表面积,因此可作为分散金属活性纳米粒子的优良的催化剂载体。 结合图2(b)可发现, 该块体纳米碳复合材料的孔结构尺寸大小均一,平均孔径分布在介孔范围内,测得平均孔径大小约为3.9 nm, 孔体积约为0.3 cm3/g。 当该材料(NCNT-foam)负载金属Ni和Ce的氧化物后发现,Ni/NCNT-foam和Ni-CeO2/NCNT-foam两种催化剂的比表面积和孔结构等物理性质和材料结构并未发生明显改变, 这说明所制备的NCNT-foam材料具有较强的结构稳定性;同时,该材料的丰富的孔结构有利于金属前驱体在该材料表面的扩散和分散。

图2 整体成型的催化剂及其载体的N2吸附/脱附等温线(a)和孔径分布图(b)Fig. 2 N2 adsorption-desorption isotherms (a) and pore size distributions (b) of different NCNT-foam supported catalysts
为了研究催化剂上的活性纳米粒子的晶体结构,还原后的Ni/NCNT-foam和Ni-CeO2/NCNT-foam催化剂的XRD测试谱图如图3所示。 由图3可见,在这两个测试的催化剂的XRD谱图上检测到明显的石墨烯和金属Ni的特征衍射峰,并未能观察到明显的NiO物种的特征衍射峰,这说明在还原气氛下NiO物种已被成功还原为Ni。 根据XRD的PDF卡片分析可以发现,衍射角2θ=26°的特征衍射峰归属于Graphite-2H峰[14],金属Ni的特征衍射峰分别在2θ=44°、52°和72°,且这些位置处的特征衍射峰强度较强,分别对应于镍的(111),(200)和(220)晶面[11]。 在Ni-CeO2/NCNT-foam催化剂的XRD图谱中, 未能检测到Ce或者CeO2物种的特征衍射峰,该结果说明CeO2物种在该催化剂表面不是以颗粒聚集而是以高分散的形式存在,或者CeO2物种在该催化剂表面主要以无定型的形式存在。 与Ni/NCNT-foam催化剂相比较,Ni-CeO2/NCNT-foam催化剂中碳的特征衍射峰和Ni的特征衍射峰的强度均呈现变弱的趋势,这说明在整体式催化剂Ni-CeO2/NCNT-foam中CeO2的加入使得部分石墨烯和Ni被覆盖从而使得Ni物种和石墨烯的衍射峰强度变弱。

图3 还原后的块状镍基催化剂X射线衍射图谱Fig. 3 XRD patterns of the reduced nickel-based monolithic catalysts
2.2 催化剂微观结构和表面元素分析
图4 是 催 化 剂Ni/NCNT-foam 和Ni-CeO2/NCNTfoam的SEM表征图像和EDS元素分析照片。 由SEM图像结果可知,整体式催化剂样品表面呈现出丰富的开放式三维孔状结构。 结合图2低温氮气吸附/脱附的表征结果可知,金属活性中心的引入并没有出现明显的孔道堵塞和大孔结构坍塌等现象。 说明这种大孔-介孔贯通的孔结构特征存在于所制备的整体式催化剂中,这种独特的孔结构为反应物和产物提供了传质扩散的通道: 有利于CO2分子在甲烷化反应过程中的传质和扩散,也有利于反应产物甲烷分子快速地从催化剂表面进行脱附和分离。 通过对催化剂的EDS元素分析可以发现,Ni-CeO2/NCNTfoam表面存在着C、 N、 Ni、 Ce等元素, 且元素在催化剂表面均匀分布,这说明通过所制备的具有高比表面积和独特孔结构的催化剂载体有利于金属元素在其表面的分散。 另外,通过分析Ni-CeO2/NCNTfoam的EDS结果发现, 元素Ni和元素Ce在催化剂表面的分布位置大体相同,这说明金属Ni与助剂CeO2之间存在着相互作用, 因此CeO2的加入有望在CO2催化加氢反应过程中起到促进作用。

图4 催化剂Ni/NCNT-foam (a, b)和Ni-CeO2/NCNT-foam(c, d)的扫描电镜图和EDS元素分布图Fig. 4 SEM images and EDS elemental mapping of Ni/NCNT-foam (a,b) and Ni-CeO2/NCNT-foam (c, d)catalysts
为了进一步研究催化剂的形貌结构,对典型的Ni-CeO2/NCNT-foam催化剂进行了相关的HR-TEM表征分析,结果如图5所示。 根据图5的实验结果可以发现,Ni-CeO2/NCNT-foam催化剂呈现相互交错的形式从而形成了整体式催化剂,其中,氮掺杂的介孔碳与多壁碳纳米管相互连接,形成了丰富且连续的多孔网状结构。 活性金属和助剂均匀地分散在碳材料表面,这进一步证明了该材料有利于金属在其表面的分散, 通过对颗粒的粒径进行统计计算,计算得到其平均粒径大小为6.2 nm。

图5 催化剂Ni-CeO2/NCNT-foam的高分辨电镜照片(a, b)和纳米粒子粒径分布图(c)Fig. 5 TEM images (a,b) and particles size distribution(c)of Ni-CeO2/NCNT-foam catalyst
2.3 催化剂性能测试
催化剂Ni/NCNT-foam和Ni-CeO2/NCNT-foam在不同反应温度下的(180~380 ℃)CO2转化率和CH4选择性如图6所示。从图6可以看出,当反应温度为180℃时, 这两个催化剂上只有少量CO2分子发生活化和转化,这主要是由于较低的反应温度无法克服活化高热力学稳定的CO2分子键能。 随着反应温度的进一步升高,CO2转化率随着反应温度的增加而逐渐升高,这主要归因于较高的反应温度有利于提高高度对称性和高热力学稳定性的CO2分子的活化。NCNT-foam负载的CeO2促进的Ni催化剂表现出优异的低温CO2的转化能力。 当反应温度在320 ℃时,Ni-CeO2/NCNT-foam催化剂的CO2转化率和CH4选择性分别高达80.1%和99.7%,而Ni/NCNT-foam催化剂的CO2转化率和CH4选择性分别仅为10.4%和80.6%,远低于添加CeO2助剂的催化剂。 通过该结果可以发现负载的CeO2促进的Ni基催化剂表现出优异的CO2甲烷化性能。 结合上述表征结果和文献报道可以推断Ni-CeO2/NCNT-foam催化剂表面较高的催化活性主要归因于活性金属Ni和CeO2助剂相互作用(如图4)形成Ni-CeO2的界面, 从而有利于氢气解离和CO2分子的活化, 正是由于助剂CeO2的加入降低了活化CO2所需要的能垒[16,17]:加入稀土助剂铈后,催化剂在较低的温度下CO2的转化能力显著提升,Ni-CeO2/NCNT-foam催化剂在240~280 ℃的温度区间内对甲烷的选择性比Ni/NCNT-foam催化剂要高40%。 可能是CeO2和金属Ni发生强相互作用,形成金属-助剂界面[17],即助剂CeO2能够在反应过程中实现Ce3+和Ce4+之间的价态可逆转变,产生更多氧空位,进而可以活化含氧分子CO2[18]。这些缺陷位点的存在能够极大程度上降低CO2活化所需的能垒[19], 氧缺陷浓度越高, 甲烷化反应的决速步骤即CO2吸附活化速率越大[18]。 同时金属Ni和助剂CeO2之间的电子作用使得金属Ni对产物CO吸附较强,CO不易从Ni表面脱附,从而在催化剂表面进一步被氢化生成CH4[16]。正是由于助剂CeO2和活性金属Ni之间的这种协同作用促使催化剂Ni-CeO2/NCNT-foam表现出较好的催化活性。

图6 不同催化剂的CO2加氢制合成天然气的反应性能测试Fig. 6 CO2 hydrogenation activity and selectivity over various catalysts
2.4 程序升温表面反应(TPSR)
为了证明助剂CeO2的加入有利于CO2的活化,对Ni/NCNT-foam和Ni-CeO2/NCNT-foam催化剂分别进行了程序升温表面反应TPSR实验, 结果如图7所示。 由TPSR实验结果可以发现,Ni/NCNT-foam催化剂的起始活化CO2产生的温度约为257 ℃,而添加稀土元素Ce后,在Ni-CeO2/NCNT-foam催化剂上开始活化CO2和产生CH4的反应温度降至207 ℃, 这说明助剂CeO2的加入有利于降低CO2的活化温度和提高反应的转化率,这主要归因于助剂CeO2的添加有利于在金属Ni和助剂的界面处产生氧空位从而有利于吸附和活化CO2。

图7 整体式碳负载Ni (a)和Ni-CeO2(b)催化剂的程序升温表面反应图Fig. 7 Temperature programed surface reaction (TPSR) of monolithic carbon supported (a) Ni and (b) Ni-CeO2 catalysts
3 结论
本研究成功合成了一种整体式纳米碳负载的Ni-CeO2催化剂, 该催化剂表现出优异的CO2甲烷化催化反应性能。催化剂Ni-CeO2/NCNT-foam中活性金属粒径较为均匀 (TEM 测得颗粒平均粒径为6.2 nm),与此同时助剂CeO2均匀分散在活性金属和载体周围, 从而使得该催化剂具有较低的CO2活化温度和CH4生成温度;TPSR结果表明该催化剂的CH4生成温度低达207 ℃,并且催化剂在300~360 ℃的反应温度区间已表现出最佳活性温度窗口;当反应温度为320 ℃时,Ni-CeO2/NCNT-foam 催化剂的CO2转化率达到80.1%,甲烷的选择性高达99.7%,这主要归结于该催化剂较高的比表面积和助剂CeO2与活性金属Ni接触界面上大量氧空位的存在,有利于高度分散的金属对吸附的氢气的解离和CO2分子的活化。 该工作为设计低温催化活化和转化CO2用整体式催化剂提供了一种设计思路。

