合成气制二甲醚中残留钠对催化剂的影响
边仲凯,刘雷强,李 芳,孙 凯,张小雨,张 琳,时培祥,黄 伟
(太原理工大学煤科学与技术教育部与山西省共建重点实验室,山西 太原 030024)
随着国民经济的日益发展,化石能源储量减少及传统燃料造成污染的问题愈来愈严重,我国的当务之急便是寻找可替代燃料来抑制能源短缺和环境污染。 煤在中国的能源消费结构中高居首位[1],但其排放的SO2、NOx及烟尘等污染物严重, 研发新的可替代燃料势在必行。 作为“绿色能源”的二甲醚(DME)物理性质与液化石油气十分相似,其十六烷值高、对环境污染小、颗粒物排放少,是替代柴油燃料的较佳选择[2-4]。 除了作为最终产品,DME还可用作气雾剂,并转化成其他化学产品和能源产品[5]。
早期的DME是在强酸作用下经甲醇脱水合成,如今可以利用合成气直接合成,即合成甲醇和甲醇脱水两个反应同时进行,称之为一步法[6]。 合成气一步法合成DME的催化剂活性组分同时具备甲醇合成和甲醇脱水两种功能,称为双功能催化剂,其中Cu、Zn组分用于甲醇合成, 酸性组分如γ-Al2O3或HZSM-5被用来使甲醇进一步脱水形成DME[7-9]。 目前在研的DME合成反应床型主要有固定床和浆态床两种, 其中浆态床由于反应产生的热量能及时转移,反应近似恒温,对反应过程非常有利,但在浆态床中反应的催化剂较易失活,于是本课题组在此基础上提出了完全液相法的全新理念,对于浆态床反应过程催化剂失活率高有了很大的改进[10-11]。
本文基于完全液相法的理念,采用共沉淀法制备了甲醇合成的前驱体,后通过凝胶法与酸性脱水组分结合制得催化剂。 催化剂制备是一个复杂的过程,需要严格控制每一个步骤,且很多因素诸如沉淀剂的选择、老化温度等都有至关重要的影响。 研究表明,催化剂中残留的碱金属杂质对其活性有一定的影响,Jong等[12]发现使用Na2CO3和K2CO3做沉淀剂时,残留的碱金属离子会导致其Zr-镁碱沸石催化剂活性降低。 Jun等[13]的研究表明Na+的存在抑制了CuO与ZnO的相互作用,Cu组分的还原难度增加,比表面积降低, 对CO2加氢制备甲醇造成了极大的阻碍。 因此,为了考察残留Na+对催化剂结构及性能的影响,本文在洗涤前驱体过程中设定离心次数分别为1、2、3、4,以此制备了4个催化剂,进一步研究Na+对甲醇合成和甲醇脱水的影响,以及对一步法合成DME催化剂活性的影响。
1 实验部分
1.1 实验试剂
硝酸铜[Cu(NO3)2·3H2O]、硝酸锌[Zn(NO3)2·6H2O]、无水乙醇[CH3CH2OH]、无水碳酸钠[Na2CO3]、液体石蜡、石油醚,分析纯,天津科密欧化学试剂有限公司;硝酸铝[Al(NO3)3·9H2O]、聚乙烯吡络烷酮K30,分析纯, 上海阿拉丁生化科技有限公司;1,6-己二胺,分析纯,晶纯生化科技股份有限公司;硅溶胶,型号JN-40,青岛基亿达硅胶试剂有限公司;蒸馏水,太原理工大学煤化所中试基地;司班80[span-80],型号L+ML-1,分析纯,天津市东丽区天大试剂厂。
1.2 催化剂的制备
(1) 将n(Cu2+):n(Zn2+):n(Al3+)为2:1:0.8的三者硝酸盐与220.00 mL蒸馏水混合,在70 ℃水浴条件下,与1 mol/L的Na2CO3溶液并流滴进装有15.00 mL蒸馏水的烧瓶中,搅拌转速为350 r/min;利用pH计调节并流过程的pH在7.0~7.2之间,并流结束后继续在水浴条件下老化2 h,冷却至室温,抽滤,离心。使用300 mL无水乙醇将滤饼溶解,加入3.90 g PVP,在90%超声频率、20 ℃水浴、100 r/min搅拌条件下超声10 min,随后置于烧瓶中; 使用8.50 mL己二胺+10.00 mL乙醇+5.00 mL蒸馏水配置成己二胺-乙醇溶液, 与30 mL硅溶胶并流滴入烧瓶; 接着15.00 g Al (NO3)3+20.00 mL H2O混合成溶液,缓慢加入烧瓶,随后老化6 h成凝胶,在120 ℃的烘箱内干燥过夜。
(2) 将干燥后的滤饼研碎,同350 mL液体石蜡与0.5 mL span-80一起缓慢升温到300 ℃,使用氮气作保护气,搅拌转速设定为350 r/min,并于300 ℃条件下还原4 h。
上述制备过程(1)中离心次数分别为1、2、3、4,所得催化剂依次命名为Cat-L1、Cat-L2、Cat-L3、Cat-L4。
1.3 催化剂的活性评价
选用500 mL带控制搅拌的高压反应釜对催化剂进行评价,活性评价过程包括了催化剂还原和反应两个阶段。 第一阶段中催化剂需在H2流量15 mL/min、N2流量60 mL/min的氛围下, 设定程序升温至280 ℃, 常压条件下还原10 h; 待釜内温度降至室温,通入合成气比例为V(H2):V(CO)=1:1,总流速为100 mL/min,设定背压阀为4.0 MPa,缓慢加压,之后设定程序升温至280 ℃,进入反应阶段。上述两阶段的机械搅拌速率均控制在1000 r/min, 一般在升温24 h后进行采样, 每24 h做一次采样点进行数据分析。 产物通入上海海欣GC-950气相色谱中分析,内标物选用甲烷,通过碳平衡计算得到DME选择性和CO转化率。
1.4 催化剂的表征
选用石油醚在索氏抽提中对浆态催化剂进行48 h的抽提,每隔16 h更换一次石油醚保证其效果,随后将催化剂在室温下干燥10 h,再于60 ℃下干燥10 h成粉末状固体催化剂,用于下一步表征测试。
ICP-AES表征选用Agilent公司生产的7700型电感耦合等离子质谱仪。 RF功率设定1150,泵速为45 r/min。 称取0.5 g催化剂样品,精确至0.0001,测试前需用2.0 mL王水和0.5 mL氢氟酸混合将其溶解。
SEM测试选用日本JEOL公司的JSM-6010PLUS/LV型扫描电镜, 测试前, 样品在真空条件下喷金1 min,设定15~20 kV的操作电压运行,主要确定催化剂的晶粒形状特征, 通过EDS进一步分析测试表明元素含量。
XRD 表征采用日本岛津公司理学的 D/max 2500型X射线衍射仪,Cu Kα作辐射源,滤片材料为Ni,电压40 kV,管电流为100 mA,在5°~85°范围内扫描,速率8°/min,通过Scherrer公式可计算得晶体粒径。
H2-TPR表征采用天津市先权仪器有限公司的TP-5000型程序升温吸附仪,称取70 mg样品装入石英管反应器,催化剂两段用石英棉塞紧,先在He氛围下吹扫30 min, 然后切换成体积比1:19的氢氮混合气,以30 mL/min的流速通过,设定从50 ℃至810℃的程序升温,升温速率为10 ℃/min,耗氢量的检测需用热导,进而确定催化剂的TPR曲线,此仪器采用外标法, 用20 mg Ag2O还原所需耗氢量作为定量计算基准。
NH3-TPD-MS选用TP-5080多用吸附仪(天津先权仪器有限公司),称取100 mg催化剂样品,在He氛围下, 从50 ℃以10 ℃/min的速率升温至280 ℃;切换成体积比1:19的氢氮混合气, 维持30 min进行还原,随后再换成He吹扫,待温度降至50 ℃后,吸附NH3至饱和状态,继续使用He吹扫30 min;最后以He为载气,设定从50 ℃至810 ℃的程序升温,升温速率为10 ℃/min,采用质谱检测器(QIC-20)检测NH3信号, 以防止催化剂中未处理干净的石蜡造成影响。
BET表征选用美国Quantachrome SI系列吸附仪。 称取一定量的催化剂样品,先在真空环境、200℃条件下干燥、 脱气预处理4 h, 随后在液氮氛围、-196 ℃下进行N2吸附测定,进而确定其吸脱附曲线与孔径分布曲线。
2 结果与讨论
2.1 催化剂性能评价

表1 不同催化剂的活性数据Table1 Catalytic performance of catalysts
表1为不同离心次数所制备催化剂的评价结果。 从表1可知催化剂的活性具有较大差异,但其整体趋势相近,当离心4次时催化剂的CO转化率最高,平均为71.41%。 在此120 h评价过程中,各催化剂随着离心次数的增加,DME选择性依次上升,Cat-L4的选择性最高,稳定在85.36%。 随着离心次数的增加甲醇选择性减小, 烃类和CO2选择性均保持在较低水平, 说明催化剂中残存的Na+对活性组分的影响确实存在。 总之,从甲醇和烃类的选择性分布中可看出,增加离心洗涤次数有利于提升甲醇脱水并降低成烃反应的活性。
2.2 ICP-AES表征

表2 不同反应前催化剂ICP-AES测量结果Table 2 ICP-AES results of different catalyst surfaces before reaction
表2为不同催化剂在反应前的ICP-AES表征结果。可以看出,催化剂体相中Na元素的含量从Cat-L1到Cat-L4逐渐下降,Cat-L1与Cat-L2的差值最大,说明完全去除对催化剂中残留Na+不现实, 结合活性评价数据Cat-L2、Cat-L3与Cat-L4的性能提升幅度较小,说明Na的残留对催化剂性能存在不利影响。
2.3 SEM表征

图1 不同催化剂反应前的SEM照片Fig.1 SEM micrographs of different catalysts before reaction
图1为不同洗涤次数的催化剂在放大倍数为300条件下的SEM照片。 从图中可以看出,从Cat-L1到Cat-L4的分布越来越均匀, 催化剂晶粒尺寸随着离心洗涤次数的增加而递减, 其中Cat-L1与Cat-L2存在较大的颗粒,Cat-L3与Cat-L4的颗粒明显减小。

表3 不同反应前催化剂表面EDS测量结果Table 3 EDS results of different catalyst surfaces before reaction
表3给出了各催化剂表面的EDS结果。随着离心洗涤次数的增加,催化剂表面Na元素含量呈现规律性下降,表明通过增加洗涤次数可以在一定程度上减少催化剂中残留的Na+。
2.4 XRD表征
图2为不同离心次数制备的催化剂反应前后的XRD谱图。 从图中可看出,反应前后各个催化剂均未出现Al物种的衍射峰,表明Al物种在催化剂中以高分散度或无定型状态存在。 CuO衍射峰同样未观察到,这是完全液相技术特有的热处理[10,14]方式造成。 图2还显示,从Cat-L1到Cat-L4,Cu0、Cu2O及ZnO衍射峰均有所减弱, 表明三者的分散程度增大,这与图1结果相符。四个催化剂中仅有Cat-L1中发现有NaNO3的衍射峰, 这也证实了洗涤可以除Na的一种可能,反应后的Cat-L1中未发现NaNO3的衍射峰,表明反应过程中其可能溶解在反应体系中。 综上所述,Na+会影响活性组分的分散程度, 其量越少,对应Cu0、Cu2O及ZnO三者的分散性则越高。
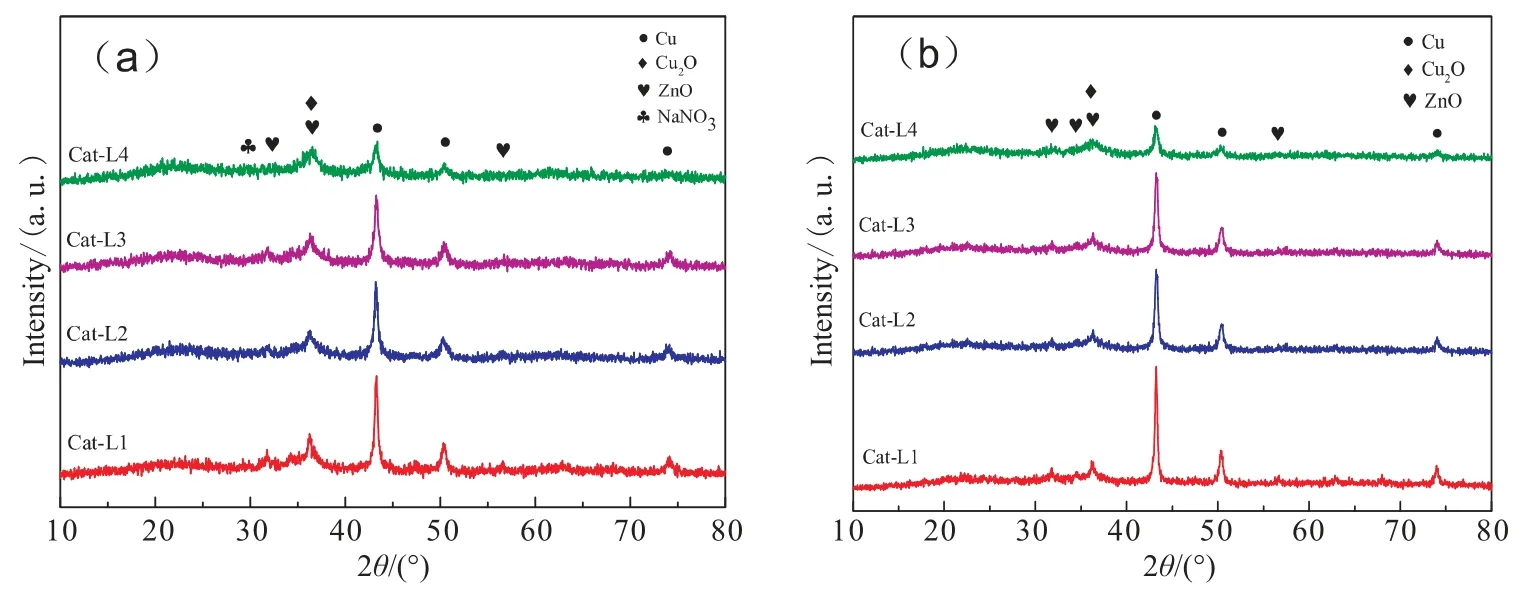
图2 催化剂反应前(a)和反应后(b)的XRD谱图Fig. 2 XRD patterns of different catalysts before (a) and after (b) reaction

表4 催化剂反应前后Cu晶粒平均直径Table 4 Cu crystal sizes of catalysts before and after reaction
表4是通过Scherrer公式计算所得Cu0晶粒尺寸,从表4中可以看出尽管Cat-L1与Cat-L2反应前的晶粒大小相近,但Cat-L1反应后粒径增幅大,表明Na的残留促进了反应过程中Cu 物种团聚;Cat-L3 和Cat-L4的晶粒尺寸有一定下降, 且反应过程中增幅较小,结构稳定[7,15]。
2.5 H2-TPR表征
图3是不同催化剂的H2-TPR谱图。 图3(a)中四个催化剂反应前均只有一个还原峰,根据之前XRD结果推测应是Cu2O还原为Cu0的耗氢峰[10,16]。 从图中可以发现Cat-L1反应前的还原峰温度最高, 表明Na对Cu2O的还原具有一定的阻碍作用[17],这是由于Cu物种与ZnO和Al2O3的相互作用较强造成[18,19],与Jun等[13]的研究结果一致。

图3 催化剂反应前(a)与反应后(b)的H2-TPR谱图Fig. 3 H2-TPR profiles of different catalysts before (a) and after (b) reaction

表5 不同催化剂的耗氢量Table 5 Hydrogen consumption from H2-TPR
表5是以AgO为标准物通过对各催化剂的H2-TPR还原峰面积积分计算所得的耗氢量。 从表中可看出,各催化剂反应前后的耗氢量相差较大,Cat-L1和Cat-L2的耗氢量相比于Cat-L3和Cat-L4较少,表明Cat-L3和Cat-L4中具有更多的可还原物种且更易发生氧化还原反应。 本课题组之前研究表明,DME催化剂的活性中心由Cu0和Cu+组成,其中Cu0颗粒的大小决定活性差异, 而Cu+浓度对选择性的稳定有所影响[8]。 从本文可知,残留Na+的量对可还原Cu物种的数量及氧化还原性有明显影响,进而对选择性产生显著影响。

图4 各催化剂反应前后的N2吸脱附曲线与孔径分布曲线Fig. 4 N2 adsorption-desorption isotherms and pore size distribution curves of different catalysts before and after reaction
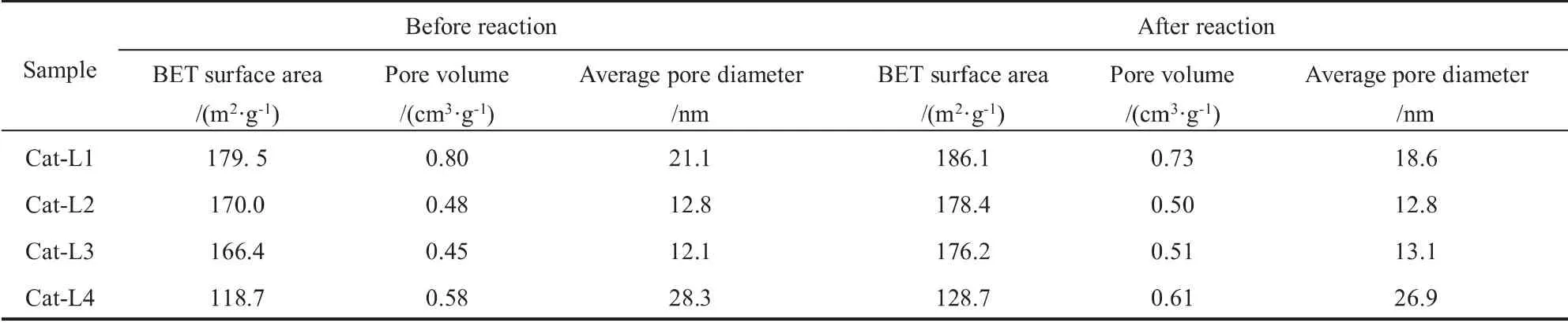
表6 催化剂反应前后的织构性质Table 6 Texture parameters of different catalysts before and after reaction
2.6 N2-吸附测试表征
图4是不同催化剂反应前后的吸脱附曲线和孔径分布曲线。 由图可以看出,所有催化剂的吸脱附等温线均属于第Ⅳ类,形状为H3型回滞环,其中反应前Cat-L1与Cat-L4的最可几孔径在12.3 nm左右,Cat-L2、 Cat-L3则分别对应为7.8 nm和6.6 nm, 表明Na对催化剂孔道形状影响不大。
表6是各催化剂反应前后的孔结构参数。 一般认为,比表面积越大,催化剂表面存在的活性位就越多。 随着离心洗涤次数的增加,Cat-L1到Cat-L4的比表面积依次下降, 孔容与孔径未呈规律性变化,与催化剂性能也未呈现出对应的变化关系。 四个催化剂反应后的比表面积均有不同程度的增大,这是完全液相方法的特点造成[20-22]。
2.7 NH3-TPD-MS表征

图5 不同催化剂反应前的NH3-TPD谱图Fig. 5 NH3-TPD profiles of catalysts before reaction
图5是不同离心次数制备的催化剂反应前NH3-TPD谱图。 从图中可知,Cat-L1、Cat-L2以及Cat-L3的峰温接近,在175 ℃和510 ℃附近出现两个脱附峰,而Cat-L4的两个脱附峰温均低于前三者, 分别为153 ℃和491 ℃,可知Cat-L4的酸性有所减弱,表明Na+对催化剂酸性位点的强度有一定影响。
通常认为,催化剂的活性由酸性位点和酸性中心的密度等因素共同影响,弱酸中心对甲醇脱水生成DME过程非常有利,强酸中心则有益于其进一步生成烃类,两者比率直接关系到催化剂活性[23,24]。 为深入考察Na+对弱酸中心和强酸中心密度的影响,进一步通过对图5曲线进行积分, 计算得到的数据如表7所示。 可知,Cat-L1至Cat-L4的弱酸中心数量逐渐增加,对应其DME选择性也依次上升,强酸中心数量先增加后降低。 催化剂弱酸量与强酸量的比率顺序:Cat-L4>Cat-L3>Cat-L2>Cat-L1,与催化剂活性正相关, 可归因于Na元素相对含量不同。 总之,Na+对催化剂酸性强度和酸性中心的密度均有一定程度的影响, 通过降低催化剂中残留Na+的浓度可有效控制酸性对催化剂性能的作用。

表7 不同催化剂的强、弱酸量及比值Table 7 Surface acidity of catalysts before reaction
3 结论
催化剂制备过程中增加离心洗涤次数可以有效减少催化剂表面和体相中残余Na+的相对含量。残留的Na+导致Cu晶粒尺寸及比表面积增大, 同时对可还原Cu物种的量及氧化还原性、表面酸量均有显著的调控作用,进而影响了催化剂活性。 综合而言,对沉淀洗涤次数最多的Cat-L4具有最优的性能,在120 h的活性评价周期内,其CO转化率为71.41%,DME选择性达85.36%。

