油菜抗咪唑啉酮类除草剂基因标记的开发与应用
胡茂龙 程 丽 郭 月 龙卫华 高建芹 浦惠明,* 张洁夫 陈 松
研究简报
油菜抗咪唑啉酮类除草剂基因标记的开发与应用
胡茂龙1,2程 丽1郭 月1龙卫华1高建芹1浦惠明1,*张洁夫1,2陈 松1
1江苏省农业科学院经济作物研究所/ 国家油料作物改良中心南京分中心/ 农业农村部长江下游棉花与油菜重点实验室/江苏省农业生物学重点实验室/ 江苏省现代作物生产协同创新中心, 江苏南京 210014;2江苏大学生命科学研究院, 江苏镇江 212023
草害已成为严重制约我国油菜生产的重要因素。种植抗除草剂品种和采用化学除草是防控草害的经济有效途径。为了开展分子标记辅助选择(marker-assisted selection, MAS)育种, 加速抗除草剂品种培育, 本研究针对已发现的抗咪唑啉酮类除草剂油菜M9中基因编码区第1913位点的SNP变异, 开发高通量、低成本的竞争性等位基因特异PCR (kompetitive allele specific PCR, KASP)标记。采用筛选出的KBA1R19681913B标记在2个F2群体中进行KASP反应。结果表明, 该标记能有效检测群体中存在的3种基因型, 其分离比均为1︰2︰1, 遵循单基因遗传规律, 且基因型与表型完全吻合。将该标记用于抗性纯合基因的回交转育, 获得200多个抗咪唑啉酮油菜恢复系。该标记还可在油菜苗期鉴定抗性杂交种的纯度。KASP标记KBA1R19681913B的获得为油菜抗除草剂MAS育种以及抗性新种质的培育提供了技术支撑。
草害; 油菜; 标记辅助选择; 咪唑啉酮类除草剂; KASP标记
油菜是我国第一大油料作物, 产油量占国产油料作物总产的55%以上, 发展油菜生产对维护我国食用油供给安全具有重要的战略意义[1]。然而, 随着我国农村经济的快速发展, 劳动力成本大幅提高, 油菜比较效益下降, 农户种植油菜积极性不高, 生产管理粗放, 草害日益严重,已成为制约我国油菜生产的重要因素。生产上使用的稳杀得、盖草能等除草剂能有效防除油菜田单子叶杂草, 对减轻杂草危害和提高油菜产量起到一定的作用。但对绝大多数阔叶杂草, 目前生产上尚未开发出安全高效的除草剂, 我国油菜田化学除草面积非常有限。开发抗性基因, 选育种植对特定除草剂具有选择抗性的油菜品种, 是解决油菜化除最经济有效的途径[2]。
咪唑啉酮(imidazolinone, IMI)类除草剂是应用较广泛的一类除草剂。该类除草剂具有选择性强、广谱、高活性等优点, 可进行播前混土、苗前土表处理以及茎叶喷雾, 除草剂经植物根与叶吸收后可有效防除一年生禾本科与阔叶杂草, 也能防除多年生杂草[3]。但该类除草剂对一般不具有抗(耐)除草剂特性的农作物本身也会产生药害, 极大限制了其使用时间和空间, 如需要在农作物播种前一段时间使用才能避免产生药害。培育抗(耐)除草剂品种可减少药害、拓宽现有咪唑啉酮类除草剂的使用范围。通过定向诱变IMIs的靶标酶乙酰乳酸合酶(acetolactate synthase, ALS)氨基酸变异, 可引起除草剂与ALS结合方式的变化产生抗性植物[4]。参照模式植物拟南芥ALS氨基酸序列, 已报道的抗性位点中主要涉及Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653、Gly654等氨基酸, 其中对IMIs产生抗性的氨基酸突变位点主要有Pro122、Trp574、Ser653和Gly654[5-10]。而已发现抗IMI的油菜突变位点主要是Trp574和Ser653[11-14]。前期我们获得了自然突变的抗IMI油菜M9, 其抗性浓度是除草剂有效杀草浓度的2~3倍, 抗性稳定、具有利用价值[15-17]。胡茂龙等[18]从M9中克隆到抗性基因发现, 抗性基因与野生型基因在第1913位点存在1处SNP, 导致ALS1的第638位丝氨酸残基被天冬酰胺酸替代。抗性基因的发现为我国提供了具有自主知识产权的抗除草剂基因, 通过常规的杂交、回交等育种手段可将该基因转育到栽培品种中, 但需要喷施除草剂逐代筛选鉴定, 其过程经历多代的杂交和回交, 育种周期较长, 而且该基因为不完全显性基因, 表型选择难以分辨纯合和杂合抗性基因型, 更增加了育种的周期和难度。因此, 若能开发到检测抗性功能基因分子标记, 利用分子标记辅助选择(marker-assisted selection, MAS)技术鉴定基因型, 指导田间育种, 对于抗除草剂基因快速转育、加快育种进程具有重要意义。
竞争性等位基因PCR (kompetitive allele specific PCR, KASP)标记技术是基于引物末端碱基的特异匹配来对SNPs和InDels (Insertions and Deletions, 插入和缺失)进行高精度的双等位基因分型方法, 是由LGC (Laboratory of the Government Chemist)公司(http://www.lgcgroup.com/)设计和创制, 具有通量高、成本低、准确度高等优点, 已经成为新一代的SNP分型标记, 在水稻、小麦、玉米、大豆等作物的基因精细定位、MAS育种、种质资源鉴定等方面被广泛应用[19-22]。但迄今, KASP标记在油菜研究上鲜有报道, 特别是有关检测油菜抗除草剂基因在国内外未见报道。本研究根据M9中基因第1913位点的SNP变异, 设计开发了KASP标记, 能够高效、精确选择抗除草剂基因的基因型, 加快了油菜材料的抗性稳定进程, 以期为油菜抗除草剂MAS育种提供技术支撑。
1 材料与方法
1.1 试验材料
M9-2、M9-14为含有抗性基因的M9后代系选材料, M9是浦惠明等[17]在油菜和大豆多年轮作的试验田中发现的抗IMI自然突变体。3075R和N341为江苏省农业科学院经济作物研究所选育的MICMS细胞质雄性不育双低恢复系, 均经过多代自交, 各项性状稳定。F1-2是以N341为母本、抗性材料M9-2为父本杂交F1代, F1-3是以3075R为母本、抗性材料M9-14为父本杂交F1代。2个F1自交衍生获得F2群体, 用于基因型在分离群体中检测鉴定。10M169为带有抗性基因的MICMS恢复系, 对应不育系宁A7均由江苏省农业科学院经济作物研究所选育保存。
1.2 分子试剂与除草剂
由英国LGC公司合成KASP反应试剂、KASP引物及特定的FAM和HEX荧光接头序列。由上海英俊(Invitrogen)生命技术有限公司合成其他常规引物, DNA测序委托南京钟鼎生物技术有限公司完成。DNA分子量标准、DNA回收试剂盒购自天根生化科技北京有限公司, 高保真性DNA聚合酶KOD-Plus及PCR试剂购自东洋纺(上海)生物科技有限公司。IMI类除草剂为山东先达化工有限公司生产的5.0%“豆施乐”水剂。
1.3 田间试验与除草剂处理
油菜材料种植于江苏省农业科学院南京溧水植物科学基地油菜隔离繁殖区, 试验严格控制花粉外漂, 以常规方法栽培管理。油菜花期用M9-2、M9-14与MICMS双低恢复系3075R和N341配制F1组合, 次年春自交获得F2世代, 秋播鉴定分离世代的抗性表现。同时用抗性恢复系10M169与不育系宁A7以人工杂交、网罩隔离和天然授粉3种方法生产抗性杂交种, 秋播鉴定F1和亲本的抗性表现。油菜三至四叶期用浓度为90 g a.i. hm–2除草剂处理, 处理前取少许叶片保存于−80℃冰箱, 用于DNA提取。21 d后调查抗性表型。处理后油菜植株生长良好, 无药害表现, 为抗除草剂材料, 抗性表型用R表示; 处理后油菜植株生长受到抑制, 最终死亡, 为感除草剂材料, 抗性表型用S表示。
1.4 分子标记设计与KASP分型
M9与常规油菜宁油16、宁油18编码ALS家族中的核苷酸序列存在1处SNP[12], 根据该处SNP可开发KASP分子标记检测抗性基因。将己克隆的基因序列与野生型序列比对, 明确SNP在油菜基因的第1913位。以候选SNP位点为中心提取两侧50 bp侧翼序列, 设计2组KASP分子标记引物, 每组标记由3条引物组成, 其中2条特异引物3'末端为等位变异碱基G/A, 且在5'端分别连接英国LGC公司KASP反应试剂特定的FAM和HEX荧光接头序列。通用引物的序列选择要保证扩增片段在60~120 bp (表1)。

表1 抗性基因BnALS1R的KASP分子标记引物序列
下画线黑体碱基表示SNP位点。The underlined and bold bases indicate SNP loci.
采用CTAB法并稍作修改提取DNA, 用1% (v/w)的琼脂糖电泳和分光光度法检测其纯度[2]。KASP反应体系包含模板DNA (20 ng µL-1) 2.5 µL、2×KASP Master mix 2.5 µL、KASP Assay mix 0.07 µL。PCR反应条件为94℃ 15 min; 94℃ 20 s, 61~55℃ 1 min, 每个循环退火温度降低0.6℃, 共10个循环; 94℃ 20 s, 55℃ 1 min, 共26个循环。若扩增效果不理想可加循环, 每次加3个循环, 最多3次。KASP反应在LGC Hydrocycler-16进行, 完成反应后利用扫描仪Pherastar对KASP产物读取荧光数据, 荧光扫描的结果会自动转化成图形。利用BMG PHERAstar仪器检测荧光信号并查看分型情况。若分型不充分, 则继续扩增, 每3个循环查看分型情况, 直至分型完全。根据分析结果确定待测样本中抗性基因的基因型, 在X轴附近显示蓝色的样本基因型为连接FAM荧光标签序列的等位基因型G/G, 为不含抗性基因的纯合体; 在Y轴附近显示红色样本的基因型为连接HEX荧光标签序列的等位基因型A/A, 为含抗性基因的纯合体; 中间显示绿色样本的基因型为杂合等位基因型G/A, 为含抗性基因的杂合体; 显示黑色的样本为空白对照。
1.5 基因克隆与测序
利用Primer Premier 5.0软件根据甘蓝型油菜(GenBank登录号为Z11524)基因序列设计正向引物ALS1-5F: 5'-TGGATATTGACGGTGATGG-3'和反向引物ALS1-5R: 5'-CGAGTACGTCTGGGAACAA-3', 通过PCR特异扩增一段含有突变位点(G/A)的基因片段, 长度为537 bp。PCR反应体系包含DNA模板5 μL、10×酶反应缓冲液5 μL、25 mmol L−1MgSO42 μL、2 mmol L–1dNTPs 5 μL、10 μmol L–1引物各5 μL、1 U μL–1KOD-Plus酶1 μL, 加ddH2O水至50 μL。反应程序为94℃ 5 min; 94℃ 30 s, 60℃ 30 s, 72℃ 30 s, 35个循环。经1.2% (v/w)琼脂糖凝胶电泳分离, 用DNA凝胶回收试剂盒将目的片段回收纯化, 采用上下游引物双向测序。通过DNAMAN 6.0、Sequencher、DNASTAR等生物信息学软件分析测序结果, 确定样本中的基因型。
1.6 应用标记检测F2群体基因型和F1杂种纯度
于苗期提取1.3中的2个F2分离群体和3种不同授粉条件下的F1杂交种叶片DNA, 利用标记KBA1R19681913B引物进行KASP分型。根据基因分型结果, 统计F1杂种的纯度和F2群体的基因型分离比例, 并对F2群体基因分型结果进行卡平方测验。
2 结果与分析
2.1 BnALS1R基因KASP标记的开发与验证
油菜突变体M9中的抗性基因与常规油菜的在第1913处存在SNP位点(G/A), 属于错义突变位点(丝氨酸/天冬酰胺), 携带A等位变异为含抗除草剂基因的抗性材料, 携带G等位变异的为不含抗除草剂基因的敏感材料[18]。由于油菜ALS基因家族核酸序列的高度同源性, 特别是和(GenBank登录号为Z11524、Z11526)在核酸水平的同源性达98%[23-24], 因此本研究选择在第1913突变位点上下游2个基因序列有差异的位置设计2组特异性KASP标记引物KBA1R19681913A和KBA1R19681913B (表1)。选取含有抗性基因的M9后代株系M9-2、M9-14和不含抗性基因的MICMS双低恢复系3075R和N341, 以及它们杂交获得的F1代和F2群体单株共18个油菜材料, 利用设计的KASP 标记进行多态型筛选与小群体验证。多次验证结果发现, 标记KBA1R19681913A在亲本和小群体中没有多态性, 而标记KA1R19681913B具有多态性, 其中KBA1R19681913B-X-allele检测携带敏感基因的等位变异, KBA1R19681913B-Y-allele检测携带抗性基因的等位变异, 上游共同引物KBA1R19681913B-common与存在3处碱基差异(图1)。从图2可以看出, 该标记可以清晰地把3种基因型分开, 其中靠近Y轴的红点为携带A等位变异的抗IMI类除草剂基因纯合型材料, 如M9后代株系M9-2、M9-14等; 靠近X轴的蓝点为携带G等位变异的不含抗IMI类除草剂基因纯合型材料, 如MICMS双低恢复系3075R和N341等; 中间的绿点为携带G/A等位变异的含抗IMI类除草剂基因杂合型材料, 如F1代和F2群体单株M318-5、M318-7和M318-9等, 黑点为空白对照(图2和表2)。
为了进一步验证KASP标记引物的特异性和准确性, 设计1对引物特异扩增含有突变位点(G/A)的基因片段进行双向测序。所有材料的PCR产物测序结果与KASP标记分型结果一致(表2)。油菜田间苗期抗除草剂表型鉴定的结果也发现, 基因型与抗除草剂鉴定表型结果吻合(表2)。因此, 本研究获得了检测油菜抗IMI类除草剂基因的KASP分子标记引物, 能够精确鉴定出抗性基因的3种基因型。

图1 油菜BnALS1与BnALS3基因序列比对与多态性引物位置
倒三角形表示突变位点。箭头线表示引物位置和扩增方向。
The single-site mutation is denoted by inverted triangle. The arrow lines represent primer sites and amplification directions.

图2 KASP标记KBA1R19681913B在小群体中分型图
2.2 群体中标记KBA1R19681913B检测效果及抗性分析
利用标记KBA1R19681913B检测2个F2群体(3075R/M9-14和N341/M9-2)基因型。2个F2群体中标记检测效果良好, 呈现3种基因型(图3)。携带抗IMI类除草剂基因的纯合和杂合基因型的F2单株都表现抗除草剂, 而所有不携带抗IMI类除草剂基因纯合基因型的F2群体单株均表现感除草剂。其中F2(3075R/M9-14)群体共分析29个单株, 有7个单株为抗性基因的纯合体, 8个单株为不含抗性基因的纯合体, 14个单株为抗性基因的杂合型, 3种基因型符合1︰2︰1 (χ2= 0.012,= 0.994)。F2(N341/M9-2)群体共分析50个单株, 有16个单株为抗性基因的纯合体, 11个单株为不含抗性基因的纯合体, 23个单株为抗性基因的杂合型, 3种基因型符合1︰2︰1 (χ2= 0.085,= 0.958)。2个群体均符合单基因遗传分离规律, 标记检测结果与苗期喷施除草剂鉴定表型完全一致, 即标记KBA1R19681913B与抗/感除草剂表型完全共分离, 同时能检测到抗性杂合基因型, 表明标记KBA1R19681913B可用于抗IMI类除草剂育种的MAS选择(表3)。
2.3 利用标记KBA1R19681913B辅助选择抗性恢复系
本研究以M9-2和M9-14为抗性基因供体亲本,MICMS恢复系3075R和N341为轮回亲本, 分别对3075R/M9-14和N341/M9-2组合后代的抗性植株进行回交转育, 回交2代, 每一代均对杂交种检测保留抗性基因的杂合型单株, 与轮回亲本回交; 对BC2F2单株保留抗性基因纯合单株, 再自交一代, 结合农艺和品质性状选择, 获得除草剂抗性稳定BC2F3株系。同时, 由于3075R和N341均为带有不育细胞质的恢复系, 因此在回交后代连续选择可育单株自交并进行抗性鉴定, 就育成抗咪唑啉酮的MICMS恢复系。目前已从2个回交后代群体选择到生长势强、成熟期适中的200多个抗性株系, 可为选育抗除草剂杂交种提供亲本。
2.4 标记KBA1R19681913B在杂交种纯度鉴定中的利用
利用携带抗性基因的MICMS恢复系10M169与不育系宁A7在3种不同授粉条件下配置F1杂种, 通过利用分子标记KBA1R19681913B对未经IMI类除草剂咪唑乙烟酸处理和经过喷药处理的菜苗进行纯度鉴定发现, 在网罩隔离授粉和自然授粉条件下, 除草剂未处理的F1杂种纯度分别为84%和80%, 均达不到85%的国标要求[25], 而经过除草剂处理的F1杂种纯度分别为97%和96%, 且标记鉴定结果与杂交种田间鉴定纯度结果吻合, 表明标记KBA1R19681913B可用于抗性杂交油菜种子纯度提前鉴定(表4)。因此, 在生产上如果通过KBA1R19681913B标记鉴定的杂交种子纯度达不到国标要求, 可对F1杂种苗期进行除草剂处理, 以达到提高种子纯度的目的, 同时兼顾大田除草, 一举多得。
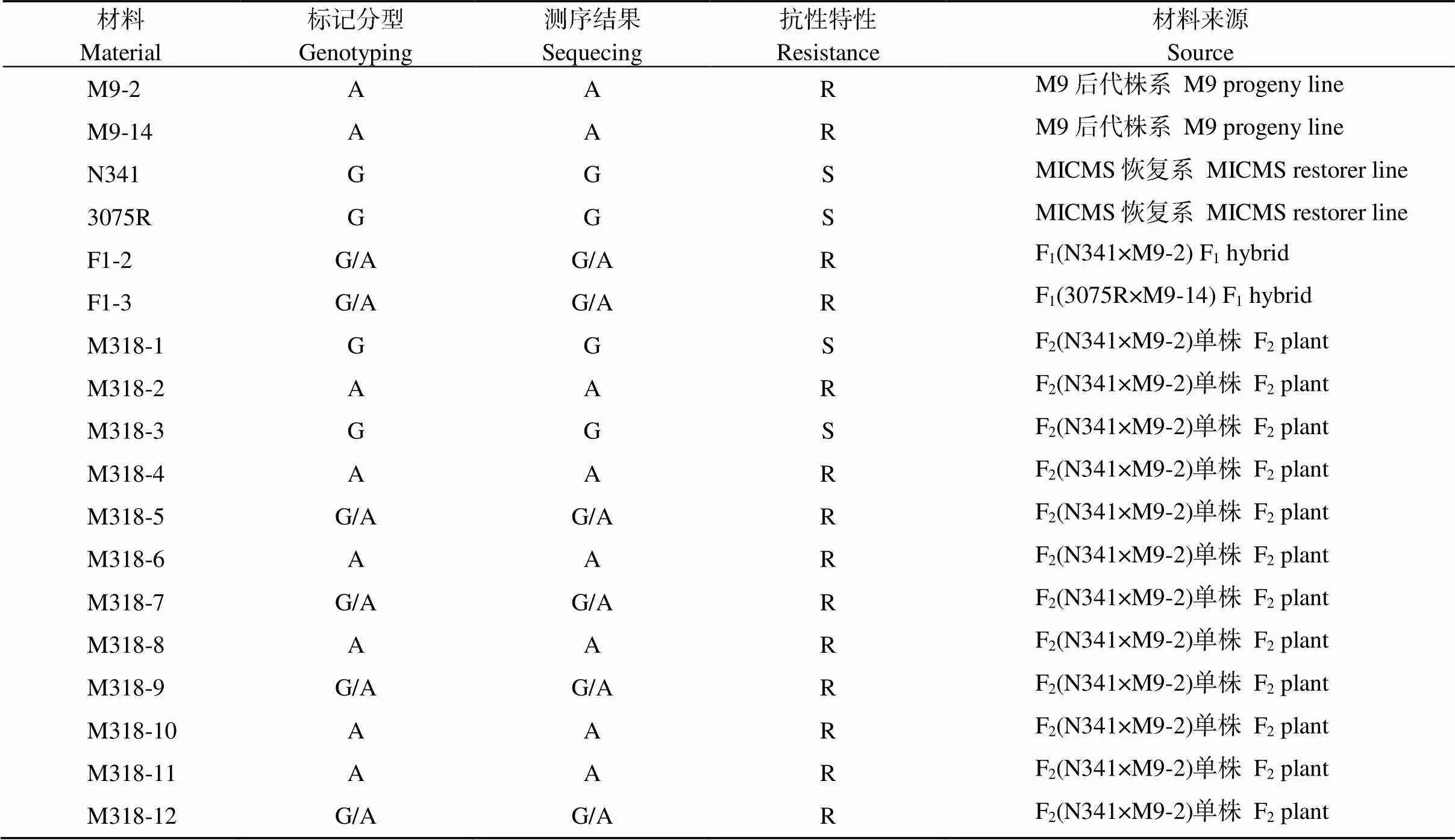
表2 KASP标记KALS1R19681913B在小群体中的分型结果与抗性表型
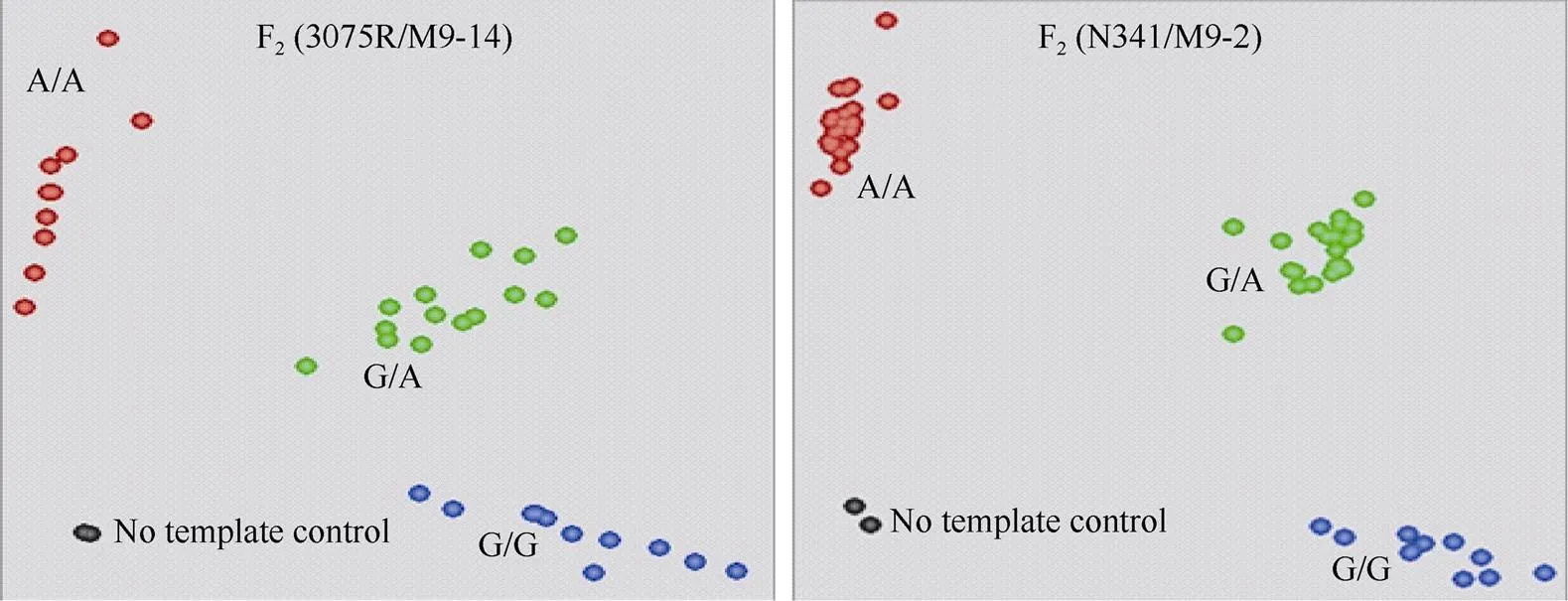
图3 标记KBA1R19681913B在2个F2群体及亲本中的基因分型
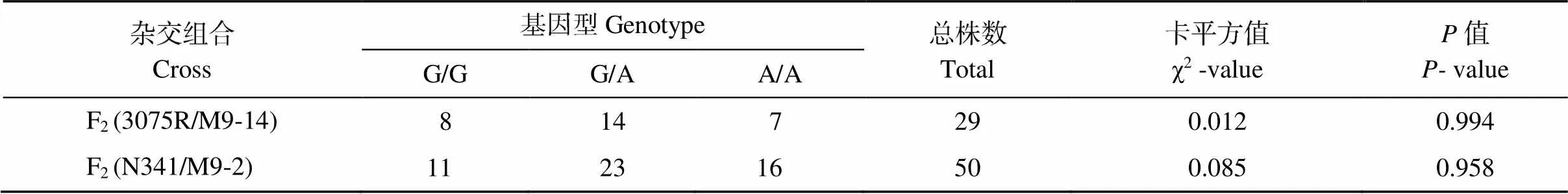
表3 标记在F2群体中基因型分型
3 讨论
杂草是影响油菜生产的重要生物灾害之一, 喷施除草剂是防治草害的有效手段。加拿大、澳大利亚、法国、德国等油菜主产区早以通过种植抗IMI油菜实施杂草化学防控[4]。然而我国缺乏自主知识产权的油菜抗性基因, 至今无法应用IMI类除草剂进行化学除草[26-27]。前期我们从M9中克隆获得抗性基因, 该基因的突变位点与Swanson等[11]报道的PM1突变位点相同, 属于除草剂靶标酶ALS的Ser653位点突变, 但是我国自主研发具有知识产权的抗性基因, 不受国际知识产权保护的限制[2]。本研究基于该突变位点的SNP, 在国内外首次开发了检测该抗性基因的KASP标记KBA1R19 681913B, 将该标记在F2群体进行验证, 并应用到抗性恢复系选育和杂交种纯度鉴定中, 发现该KASP标记能够快速、精确区分出的3种基因型和真假杂种。显然, 以上研究可加快我国抗IMI油菜的选育和推广应用步伐。
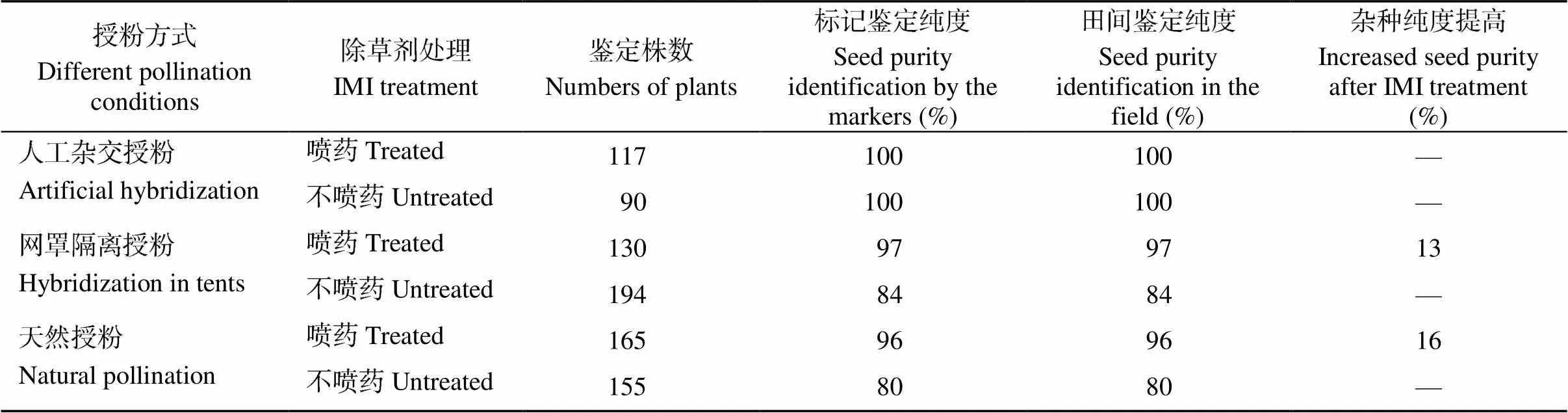
表4 标记KBA1R19681913B在鉴定杂交种子纯度的应用
便宜、高效且准确的基因SNP分型方法一直是遗传学家和育种家追求的技术手段。目前SNP分型技术有RFLP、CAPS等传统的标记方法, 也有高通量测序和基因芯片等现代方法[28-30]。前者涉及到繁琐的分子杂交和酶切实验, 操作流程复杂、通量不高; 后者具有快速高效、结果可靠等优势, 但费用相对昂贵。同时芯片技术主要用于对百个以上的SNP检测, 对少量SNP或单个基因的SNP进行检测时, KASP技术具有经济高效的优势[31]。与基于芯片的Illumina GoldenGate相比, 使用KASP分型用于MAS回交选择比使用其他高通量平台节省7.9%~46.1%的费用[31]。KASP技术价格低廉、高效灵活特性[32], 已在水稻、小麦、玉米、大豆等作物中得到应用[19-22,33]。在油菜中, Chang等[34]开发了源于黑芥()的抗根肿病基因的KASP标记, 并应用于基因的精细定位和同源性关系分析。Fu等[35]利用BSR-Seq (bulked segregant RNA Sequencing)技术开发了多个KASP标记, 对油菜抗黑胫病(blackleg)基因进行了精细定位, 获得了候选基因和可用于MAS选择的KASP标记。但迄今在国内外未见有关油菜抗IMI类除草剂基因分型的报道。本研究获得了高效、精确检测抗除草剂基因基因型的KASP标记KBA1R19681913B, 与之前的检测该基因型的AS-PCR标记相比, 本研究获得的标记在实际应用中成本更低、通量更高[36]。另外, KASP标记仅需PCR和荧光检测2个步骤, 无需对产物进行凝胶电泳检测, 彻底杜绝了电泳中常用的染色剂溴化乙锭对人体的危害和环境的污染。综上, 本研究获得的基因分型方法具有简便、快速、通量高、环境友好的显著优点, 更加适用于育种家在遗传大群体中对不同基因型的鉴定以及MAS育种。
咪唑啉酮类除草剂的靶标ALS是植物支链氨基酸合成的关键酶。除草剂通过抑制ALS酶活性, 导致支链氨基酸合成受阻, 达到杀草目的。ALS基因碱基位点变异引起编码氨基酸的改变产生抗性基因, 可使敏感作物产生除草剂抗性。在获得抗性基因后, 开发合适的分子标记鉴定抗性基因型是进行MAS选择的前提, 此方面前人有些研究。Thompson等[37]开发了检测鹰嘴豆(L.)抗性位点Ala205的KASP标记; Kadaru等[38]开发了检测水稻抗性位点Ser653和Gly654的AS-PCR标记; Lee等[39]开发了检测大麦抗性位点Ser653的AS-PCR标记。然而, 与鹰嘴豆染色体组(2=16)、水稻(2=24)和大麦(2=14)不同, 甘蓝型油菜为异源四倍体(2=38), 基因组庞大, 包括A、C两套基因组。基因组进化的高度重排导致甘蓝型油菜相关基因多以基因家族的形式存在[40]。同一家族基因核酸序列高度同源, IMI的靶基因ALS也不例外。位于基因组A的和基因组C的核酸同源性达98%, 这给KASP标记检测增加了难度, 因为在进行PCR扩增过程中会受到同源序列的干扰[23-24]。为此, 在本研究中为明确KASP标记KBA1R19681913B基因分型的准确性, 我们另外设计了特异性引物进行双向测序, 测序结果与KASP分型结果一致(表2)。同时, 用该标记对2个F2群体进行检测发现, 基因型分离比遵循单基因遗传模式, 证明标记KBA1R19681913B可以有效、准确检测的3种不同基因型。有意思的是, KBA1R19681913B的共用引物恰好锚定在和的3个SNP上(图1), 而无多态性的KBA1R19681913A共用引物仅锚定在和的1个SNP (数据未列出)。这给了我们启示, 即将来在油菜中开发KASP标记要特别重视共用引物序列的特异性。
[1] 王汉中. 以新需求为导向的油菜产业发展战略. 中国油料作物学报, 2018, 40: 613–617. Wang H Z. New-demand oriented oilseed rape industry developing strategy., 2018, 40: 613–617 (in Chinese with English abstract).
[2] 胡茂龙, 浦惠明, 高建芹, 龙卫华, 戚存扣, 张洁夫, 陈松. 油菜乙酰乳酸合成酶抑制剂类除草剂抗性突变体M9的遗传和基因克隆. 中国农业科学, 2012, 45: 4326–4334. Hu M L, Pu H M, Gao J Q, Long W H, Qi C K, Zhang J F, Chen S. Inheritance and gene cloning of an ALS inhabiting herbicide-resistant mutant line M9 in.,2012, 45: 4326–4334 (in Chinese with English abstract).
[3] 张婷, 师志刚, 王根平, 程汝宏, 陈媛, 冀小绵, 杨伟红. 咪唑乙烟酸对冀谷33生长发育的影响及对后茬作物的安全性. 中国农业科学, 2015, 48: 4916–4923. Zhang T, Shi Z G, Wang G P, Cheng R H, Chen Y, Jin X M, Yang W H. Effect of imazethapyr on millet Jigu 33 growth and its safety on succeeding crops., 2015, 48: 4916–4923 (in Chinese with English abstract).
[4] Tan S, Richard R E, Mark L D, Bijay K S, Dale L S. Imidazolinone-tolerant crops: history, current status and future., 2005, 61: 246–257.
[5] Lyu J Y, Huang Q X, Sun Y Y, Qu G P, Guo Y, Zhang X J, Zhao H X, Hu S W. Male sterility of an AHAS-mutant induced by tribenuron-methyl solution correlated with the decrease of AHAS activity inL., 2018, 9: 1014.
[6] Li H T, Li J J, Zhao B, Wang J, Yi L C, Liu C, Wu J S, King G J, Liu K D. Generation and characterization of tribenuron-methyl herbicide-resistant rapeseed () for hybrid seed production using chemically induced male sterility., 2015, 128: 107–118.
[7] Piao Z Z, Wang W, Wei Y N, Francesco Z, Wan C Z, Bai J J, Wu S W, Wang X Q, Fang J. Characterization of an acetohydroxy acid synthase mutant conferring tolerance to imidazolinone herbicides in rice ()., 2018, 247: 693–703.
[8] Han H, Yu Q, Purba E, Li M, Walsh M, Friesen S, Powles S B. A novel amino acid substitution Ala-122-Tyr in ALS confers high-level and broad resistance across ALS-inhibiting herbicides., 2012, 68: 1164–1170.
[9] Tranel P J, Wright T R, Heap I M. Mutations in herbicide- resistant weeds to ALS inhibitors. Online [2020-02-24]. http://www. weedscience.com.
[10] Murphy B P, Tranel P J. Target-site mutations conferring herbicide resistance., 2019, 8: 382.
[11] Swanson E B, Herrgesell M J, Arnoldo M, Sippell D W, Wong R S C. Microspore mutagenesis and selection: Canola plants with field tolerance to the imidazolinones., 1989, 78: 525–530.
[12] Hattori J, Douglas B, Mourad G, Labbé H, Ouellet T, Sunohara G, Rutledge R, King J, Miki B. An acetohydroxy acid synthase mutant reveals a single site involved in multiple herbicide resistance., 1995, 246: 419–425.
[13] Hu M L, Pu H M, Gao J Q, Long W H, Chen F, Zhang W, Zhou X Y, Peng Q, Chen S, Zhang J F. Comparative analysis of miRNAs of two rapeseed genotypes in response to acetohydroxyacid synthase-inhibiting herbicides by high-throughput sequencing., 2017, 12: e184917.
[14] Hu M L, Pu H M, Gao J Q, Long W H, Chen F, Zhou X Y, Zhang W, Peng Q, Chen S, Zhang J F. Inheritance and molecular characterization of resistance to AHAS-inhibiting herbicides in rapeseed., 2017, 16: 2421–2433.
[15] 高建芹, 浦惠明, 戚存扣, 张洁夫, 龙卫华, 胡茂龙, 陈松, 陈新军, 陈锋, 顾慧. 抗咪唑啉酮油菜种质的发现与鉴定. 植物遗传资源学报, 2010, 11: 369–373. Gao J Q, Pu H M, Qi C K, Zhang J F, Long W H, Hu M L, Chen S, Chen X J, Chen F, Gu H. Identification of imidazolidone-resistant oilseed rape mutant., 2010, 11: 369–373 (in Chinese with English abstract).
[16] 高建芹, 浦惠明, 龙卫华, 胡茂龙, 戚存扣, 张洁夫. 抗咪唑啉酮油菜对非选择性除草剂的抗性效应. 江苏农业学报, 2010, 26: 1186–1191. Gao J Q, Pu H M, Long W H, Hu M L, Qi C K, Zhang J F. Resistance of imidzolidone-resistant oilseed rape to nonselective herbicide imazethapyr., 2010, 26: 1186–1191 (in Chinese with English abstract).
[17] 浦惠明, 高建芹, 龙卫华, 胡茂龙, 张洁夫, 陈松, 陈新军, 陈锋, 顾慧, 傅三雄, 戚存扣. 油菜抗咪唑啉酮性状的遗传及其应用. 中国油料作物学报, 2011, 33: 15–19. Pu H M, Gao J Q, Long W H, Hu M L, Zhang J F, Chen S, Chen X J, Chen F, Gu H, Fu S X, Qi C K. Studies on inheritance of imidazolinones resistance inand its utilization., 2011, 33: 15–19 (in Chinese with English abstract).
[18] Hu M L, Pu H M, Kong L N, Gao J Q, Long W H, Chen S, Zhang J F, Qi C K. Molecular characterization and detection of a spontaneous mutation conferring imidazolinone resistance in rapeseed and its application in hybrid rapeseed production., 2015, 35: 46.
[19] Liu Z Y, Zhu C S, Jiang Y, Tian Y L, Yu J, An H Z, Tang W J, Sun J, Tang J P, Chen G M, Zhai H Q, Wang C M, Wan J M. Association mapping and genetic dissection of nitrogen use efficiency-related traits in rice (L.)., 2016, 16: 323–333.
[20] Tan C T, Yu H J, Yang Y, Xu X Y, Chen M S, Rudd J C, Xue Q W, Ibrahim A M H, Garza L, Wang S C. Development and validation of KASP markers for the greenbug resistance geneand the Hessian fly resistance gene H32 in wheat., 2017, 130: 1867–1884.
[21] Nair S K, Babu R, Magorokosho C, Mahuku G, Semagn K, Beyene Y, Das B, Makumbi D, Kumar P L, Olsen M. Fine mapping of, a major QTL for resistance to maize streak virus leads to development of production markers for breeding pipelines., 2015, 128: 1839–1854.
[22] Shi Z, Liu S M, Noe J, Arelli P, Meksem K, Li Z L. SNP identification and marker assay development for high-throughput selection of soybean cyst nematode resistance., 2015, 16: 314.
[23] Rutledge R G, Quellet T, Hattori J, Miki B L. Molecular characterization and genetic origin of theacetohydroxyacid synthase multigene family., 1991, 229: 31–40.
[24] Ouellet T, Rutledget R G, Miki B L. Members of the acetohydroxyacid synthase multigene family ofhave divergent patterns of expression., 1992, 2: 321–330.
[25] 中国国家标准: GB4407.2-2008. 经济作物种子,第2部分: 油料类. 中国国家标准化管理委员会发布, 2018. National Standards of China: GB4407.2-2008. Seed of Economic Crops. Part 2: Oil Species. Standardization Administration of China, 2018 (in Chinese).
[26] 浦惠明, 戚存扣, 张洁夫, 高建芹, 傅寿仲, 陈新军, 陈松, 赵祥祥. 转基因抗除草剂油菜对近缘作物的基因漂移研究. 生态学报, 2005, 25: 196–203. Pu H M, Qi C K, Zhang J F, Gao J Q, Fu S Z, Chen X J, Chen S, Zhao X X. Studies on the gene flow from herbicide-tolerant GM rapeseed to its close relative crops., 2005, 25: 196–203 (in Chinese with English abstract).
[27] 浦惠明, 戚存扣, 张洁夫, 高建芹, 傅寿仲, 陈新军, 陈松, 赵祥祥. 转基因抗除草剂油菜对十字花科杂草的基因漂移研究. 生态学报, 2005, 25: 910–916. Pu H M, Qi C K, Zhang J F, Gao J Q, Fu S Z, Chen X J, Chen S, Zhao X X. The studies on gene flow from GM herbicide-tolerant rapeseed to cruciferous weeds., 2005, 25: 910–916 (in Chinese with English abstract).
[28] Konieczny A, Ausubel F. A procedure for mapping Arabidopsis mutations using co-dominant ecotype specific PCR-based markers., 1993, 4: 403–410.
[29] Michaels S D, Amasino R M. A robust method for detecting single-nucleotide changes as polymorphic markers by PCR., 1998, 14: 381–385.
[30] Neff M M, Neff J D, Chory J, Pepper A E. dCAPS, a simple technique for the genetic analysis of single nucleotide polymorphisms: experimental applications ingenetics., 1998, 14: 387–392.
[31] LGC Genomics. KASP genotyping chemistry user guide and manual. LGC, 2013 [2018-04-12]. https://www.lgcgroup.com/ LGCGroup/media/PDFs/Products/Genotyping/KASP-genotyping- chemistry-User-guide.pdf?ext=.pdf.
[32] Semagn K, Babu R, Hearne S, Olsen M. Single nucleotide polymorphism genotyping using kompetitive allele specific PCR (KASP): overview of the technology and its application in crop improvement., 2014, 33: 1–14.
[33] 田宇, 杨蕾, 李英慧, 邱丽娟. 抗大豆胞囊线虫位点的KASP 标记开发和利用. 作物学报, 2018, 44: 1600–1611. Tian Y, Yang L, Li Y H, Qiu L J. Development and utilization of KASP marker forlocus resistant to soybean cyst nematode., 2018, 44: 1600–1611 (in Chinese with English abstract).
[34] Chang A, Lamara M, Wei Y D, Hu H, Parkin I A P, Gossen B D, Peng G, Yu F Q. Clubroot resistance geneinresides in a genomic region homologous to chromosome A08 in., 2019, 19: 224.
[35] Fu F Y, Liu X J, Wang R, Zhai C, Peng G, Yu F Q, Fernando W G D. Fine mapping ofblackleg resistance genethrough bulked segregant RNA sequencing., 2019, 9: 14600.
[36] 胡茂龙, 龙卫华, 高建芹, 付三雄, 陈锋, 周晓婴, 彭琦, 张维, 浦惠明, 戚存扣, 张洁夫, 陈松. 油菜抗咪唑啉酮类除草剂基因等位基因特异PCR标记的开发与应用. 作物学报, 2013, 39: 1711–1719. Hu M L, Long W H, Gao J Q, Fu S X, Chen F, Zhou X Y, Peng Q, Zhang W, Pu H M, Qi C K, Zhang J F, Chen S. Development and application of allele-specific PCR markers for imidazolinone-resistant genein., 2013, 39: 1711–1719 (in Chinese with English abstract).
[37] Thompson C, Tar’an B. Genetic characterization of the acetohydroxyacid synthase () gene responsible for resistance to imidazolinone in chickpea (L.)., 2014, 127: 1583–1591.
[38] Kadaru S, Zhang W Q, Yadav A, James H O. Development and application of allele-specific PCR assays for imazethapyr resistance in rice ()., 2008, 160: 431–438.
[39] Lee H, Sachin R, Neeraj K, Burkea I, Yenisha J P, Gilla K S, Wettsteina D V, Steven E U. Single nucleotide mutation in the barley acetohydroxy acid synthase (AHAS) gene confers resistance to imidazolinone herbicides., 2011, 108: 8909–8913.
[40] Chen X, Martin T, Crystal L S, Aliaa E M, Saleh S, Weselake R J. Three homologous genes encoding sn-glycerol-3- phosphate acyltransferase 4 exhibit different expression patterns and functional divergence in., 2011, 155: 851–865.
Development and application of the marker for imidazolinone-resistant gene in
HU Mao-Long1,2, CHENG Li1, GUO Yue1, LONG Wei-Hua1, GAO Jian-Qin1, PU Hui-Ming1,*, ZHANG Jie-Fu1,2, and CHEN Song1
1Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences / Nanjing Sub-center, National Center of Oil Crops Improvement / Key Laboratory of Cotton and Rapeseed (Nanjing), Ministry of Agriculture and Rural Affairs / Provincial Key Laboratory of Agrobiology, Jiangsu Academy of Agricultural Sciences / Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing 210014, Jiangsu, China;2Institute of Life Sciences, Jiangsu University, Zhenjiang 212013, Jiangsu, China
Weed damage is one of the most important factors restricting the development of rapeseed production in China. Cultivation of herbicide-resistant varieties combined with chemical herbicides was an extremely effective help to control field weed in rapeseed production. To accelerate the breeding of cultivars with resistance imidazolinone herbicides through molecular marker-assisted selection in, the simplest, most cost-effective and high-throughput KASP markers were developed by using a SNP mutation at 1913 bp position of ALS (acetolactate synthase) gene in the mutant. A polymorphic marker designed KBA1R19681913B was obtained to effectively distinguish the homozygous resistant M9 from susceptible rapeseeds. Meanwhile, the KASP marker was evaluated in two F2populations and could effectively discriminate three genotypes. F2populations gave a good fit to the expected 1:2:1 ratio, confirming a single gene Mendel model with the perfect matched between phenotyping and genotyping. About more than two hundred homozygous restoring lines containingwere developed through KASP marker selection in multi-generation backcross and showed stable imidazolinone herbicide resistance. This functional marker can also be used to identify the purity of hybrid seeds at the seedling stage. In conclusion, the validated KASP marker KBA1R19681913B would provide a technical support for developing herbicide-resistant rapeseed in marker-assisted selection and identification of resistant germplasm.
weed damage; rapeseed (L.); marker-assisted selection; imidazolinone herbicides; KASP marker
10.3724/SP.J.1006.2020.04056
本研究由国家重点研发计划项目(2016YFD0101300), 国家自然科学基金项目(31671731, 31901503), 国家现代农业产业技术体系建设专项(CARS-13)和江苏省自然科学基金项目(BK20190267)资助。
This study was supported by the National Key Research and Development Program of China (2016YFD0101300), the National Natural Science Foundation of China (31671731, 31901503), the China Agricultural Research System (CARS-13), and the Natural Science Foundation of Jiangsu Province (BK20190267).
浦惠明, E-mail: puhuiming@126.com, Tel: 025-84390370
E-mail: humolon@163.com, Tel: 025-84390372
2020-03-02;
2020-06-02;
2020-06-14.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200612.1531.006.html

